PRRSV浙江分离株Nsp2基因序列分析*
2011-05-31张涵淞扈鸿霞赵灵燕周彩琴李肖梁方维焕
张涵淞,扈鸿霞,赵灵燕,周彩琴,李肖梁,方维焕,徐 辉*
(1.浙江大学浙江省动物预防医学重点实验室,浙江杭州 310029;2.浙江省动物疫病预防控制中心,浙江杭州 310020)
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)属于套式病毒目动脉炎病毒科动脉炎病毒属的成员,是引起猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)的病原。临床主要表现为妊娠母猪的繁殖障碍以及仔猪与育肥猪的呼吸困难等。1991年确认PRRSV有2个基因型,即欧洲型和北美洲型。
PRRSV的基因组为一条单链、不分节段的正链RNA,大小约为15kb。5′端有帽子结构类似物,3′端有poly(A)尾结构。PRRSV基因组含有9个开放阅读框,ORF1a和ORF1b编码复制酶和聚合蛋白,ORF2a、ORF2b编码结构蛋白。ORF1a编码蛋白pp1a,裂解后产生9个非结构蛋白 Nsp1α,Nsp1β,Nsp2Nsp 8。研究发现,ORF1a的变异最为明显,其中非保守氨基酸的变异主要集中在Nsp2[1]。
Nsp2约有980个氨基酸,是PRRSV中最大的蛋白,有3个结构域,即N末端的半胱氨酸蛋白酶区(PL2)、C末端的疏水性跨膜区(TM)和一个中间功能不祥的区域[2-3]。一般情况下,PL2区域比较保守,而中间及TM区域有3个高变区[4]。2006年“高热病”在中国暴发[5-7],当时有学者认为是与Nsp2的30个氨基酸缺失有关[5],所以近年来关于PRRSV的研究逐步转向Nsp2。本试验对2008年-2009年从浙江省不同猪场采集分离的41株来自发生高热病死亡猪只的PRRSV进行了Nsp2基因序列的克隆和序列分析,旨在分析该地区Nsp2基因分子进化特征。
1 材料与方法
1.1 材料
1.1.1 病料 采集2008年-2009年间发生高热病且死亡猪的肺脏、淋巴结和脾脏组织41份,死亡猪只均来源于杭州、绍兴、湖州、嘉兴、丽水、宁波、衢州、温州和金华等地区的不同猪场。
1.1.2 试剂 总RNA提取试剂盒为上海生工生物工程技术服务有限公司产品;反转录酶为Promega公司产品;RNA酶抑制剂、DTT均为北京鼎国生物技术有限责任公司产品;dNTPs、Super Taq为上海申能博彩生物科技有限公司产品;连接试剂盒和pMD18-T载体为宝生物工程(大连)有限公司产品;UNIQ-5柱离心式胶回收试剂盒为Axygen公司产品。
1.1.3 引物设计与合成 在Nsp2保守区域内设计1对引物用于PRRSV病毒的检测,Nsp2-1:5′-GCACCAGTTCCTGCACCGC-3′, Nsp2-2: 5′-AGGGAGCTGCTTGATGACACAG-3′,扩增 Nsp2部分片段,Nsp2未缺失株的片段大小为317bp,缺失株的片段大小为227bp。引物均采用Primer Select 5.0软件设计,由Invitrogen上海生物技术有限公司合成。
根据GenBank发表的PRRSV的全基因组序列,设计扩增 Nsp2的特异性引物,A2-1:5′-GACACACATGGACCTATCGTCATAC -3′,A3-2:5′-CTGCACTCAGGATCAGCTTTCACTC -3′(第 1轮);Nsp2-full-1:5′-GTTGAGCCCAATACGTCACCA -3,Nsp2-full-2:5′-CTCCAGCCAAGATACAGTCTGC-3′(第2轮),扩增片段为2 992bp。
1.2 方法
1.2.1 RNA提取和RT-PCR检测 取少量组织病料(包括脾、肺、淋巴结),剔除结缔组织,加入0.02mol/L PBS 1mL,用铜纱网和研钵进行研磨。将研磨好的组织悬液放入干净的1.5mL离心管中,反复冻融3次,5 000r/min离心10min。分别取200μL病料上清抽提病毒RNA(按试剂盒说明操作)。20μL体系合成cDNA:RNA样品10μL、下游引物N2(25μmol/L)1μL,混匀。65℃水浴5 min,后放置冰上2min。5×MMLV buffer 4μL,dNTP Mix(10mmol/L)2μL,DTT 2μL,RNasin(30U/L)0.5L以及 MMLV reverse transcriptase(100U/L)0.5μL,轻轻混匀。42℃作用1h,95℃水浴5min后,取2μL cDNA为模板进行套式PCR检测。
第1轮反应体系为:10×PCR缓冲液3μL,10 mmol/L dNTP Mix 0.6μL,25μmol/L A2-1 0.5 μL,25μmol/L A3-2 0.5μL,Super Taq 0.5μL,灭菌ddH2O补足至30μL。PCR反应程序为:94℃预变性3min;94℃40s,58℃30s,68℃3min 35 s,30个循环;68℃ 延伸10min。取0.5μL PCR产物进行第2轮扩增。第2轮反应体系为:10×PCR缓冲液3μL,10mmol/L dNTP Mix 0.5μL,25 μmol/L Nsp2-full-1 0.5μL,25μmol/L Nsp2-full-2 0.5μL,Super Taq 0.5μL,灭菌ddH2O补足至30 μL。PCR反应程序为:94℃预变性3min;94℃40 s,60℃30s,68℃3min,30个循环;68℃ 延伸10 min。PCR产物用10g/L琼脂糖凝胶电泳检测。
1.2.2 PCR产物的克隆、鉴定与测序 将上述PCR产物用UNIQ-5柱进行割胶回收,纯化的PCR产物与pMD18-T载体连接,转化至E.coli DH5α感受态细胞。重组质粒经PCR鉴定后,由Invitrogen上海生工生物工程技术服务有限公司对核苷酸序列进行双向测定。
1.2.3 序列分析 用DNA Star软件中的 Meg A-lign方法对PRRSV分离株的Nsp2基因序列与GenBank中发表的PRRSV Nsp2序列进行比较,并构建系统发生进化树。对NSP2全长氨基酸序列也进行比对分析。
2 结果
2.1 Nsp2基因的克隆与序列测定
对41份病料进行PCR检测,有21个毒株用RT-PCR的方法扩增Nsp2基因条带大小为317 bp,为Nsp2未缺失株;另20个毒株所扩增的目的条带大小为227bp,为Nsp2缺失株(图1)。
2.2 Nsp2基因序列分析
将这41条Nsp2基因序列用DNA Star软件中的MegAlign方法与GenBank中发表的PRRSV Nsp2序列进行比较,发现41条基因之间的核苷酸同源性比较高,为89.2%~100.0%。其中20个缺失株之间的核苷酸同源性为94.2%~99.8%;21个非缺失株之间的核苷酸同源性为99.2%~100.0%。20个缺失株与国内分离的高致病性PRRSV毒株HUN4、JXA1等Nsp2基因序列的同源性为95.9%~99.4%,与北美洲型标准毒株VR2332和国内分离的PRRSV经典毒株CH2002等Nsp2基因序列的同源性仅为52.8%~61.7%。21个非缺失株与VR2332、CH2002等经典毒株Nsp2基因序列同源性为81.1%~93.5%,与HUN4、JXA1等Nsp2基因序列的同源性仅为59.2%~60.1%。
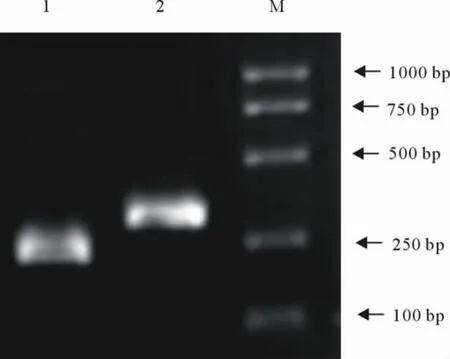
图1 病猪样本的中PRRSV病毒的PCR检测Fig.1 PCR detection of PRRSV from clinical samples of pigs
从构建的系统发生进化树中可知PRRSV分离株可构成两个基因型,即欧洲型和北美洲型(图2)。2008年-2009年我们分离到的PRRSV均属于北美洲型,其中22-09-WZ64等20株属于亚群1,18-09-NB67等21株属于亚群2。此外,在亚群2上存在2个分支:一个为本试验分离毒株;另一个为GenBank中已登录的早期的国内外分离毒株。

图2 以Nsp2基因为基础构建PRRSV的系统发生进化树Fig.2 Phylogenetic analysis of PRRSV based on Nsp2genes
2.3 Nsp2基因的推导的氨基酸序列分析
通过氨基酸序列的比对,我们发现部分NSP2序列的缺失部位是在全长序列的高变区域部分(324 aa~876aa),为非连续缺失(482aa和534aa~562 aa)(图3)。此外,在第47位到第240位的半胱氨酸水解酶功能区域基本上是保守的。在一些关键的位点中,如第55位的C,56位的G,124位的H和125位的W没有发生突变。还有第111位,142位和147位的半胱氨酸也都保守(图4)。

图3 部分PRRSV毒株Nsp2的氨基酸缺失位置Fig.3 Location of deletion sites of amino acids in the Nsp2protein of representative PRRSV

图4 部分PRRSV毒株Nsp2第47位到第240位氨基酸比较Fig.4 Comparison of amino acid sequences between 47aa-240aa of the Nsp2protein of representative PRRSV
3 讨论
自20世纪末PRRS开始暴发以来,已给世界养猪业造成了巨大经济损失。临床上导致妊娠母猪的流产、早产、产死胎、木乃伊胎以及仔猪成活率下降和育肥猪的呼吸道疾病,常继发其他病原感染[8],混合感染的现象也较多[9]。我国自1996年开始暴发PRRS,关于该病的报告与研究日渐增多[3,10]。有资料显示,不同PRRSV分离毒株在毒力、基因序列和抗原性等方面存在较大的差异[11],所以PRRSV的变异也在一定程度上导致本病更加难以防控。在ORF1编码所有非结构蛋白中,Nsp2变异程度最高,并且在北美洲型毒株和欧洲型毒株间存在着很大的差异。有报道指出,其氨基酸同源性低于40%[12-13],明显低于 PRRSV 其他非结构蛋白的氨基酸同源性[14-15]。另有研究认为 ORF1复制酶基因的变异与PRRSV的毒力致弱以及在MA104细胞上的复制增强有关[16],使得Nsp2在近年来成为一个研究的热点。
通过序列比对分析,41条基因之间的核苷酸同源性比较高,为89.2%~100.0%。其中毒株8-09-HZ68和23-09-JH71分别分离于杭州和金华,但是它们的核苷酸同源性为100%,说明它们可能来源于同一毒株。从系统发生进化树中可知,PRRSV分离株可明显分为欧洲型和北美洲型2个基因型。北美洲型中存在的2个亚群,这2个亚群在进化关系上的差异正是由于30个氨基酸位点的缺失而形成的。亚群2中,本试验的21个非缺失株与国内外分离的非缺失株存在于两个明显的分支上。本试验21个非缺失株之间核苷酸同源性为99.2%~100.0%,属于高度同源,而与 VR-2332、CH-2002等经典非缺失毒株Nsp2基因序列相似性仅为81.1%~93.5%,说明本试验分离的21个非缺失株与国内外分离的非缺失株相比,已经存在一定程度的变异,在进化树上显示的亲缘关系也渐行渐远。亚群1在进化树上没有明显的分布规律,在各个分支中均有分布。20个缺失株之间核苷酸同源性为94.2%~99.8%,与国内报道PRRSV变异株Nsp2序列高度同源,高达98.2%~100%基本相符[17]。
有研究表明[18],Nsp2高变区的基因缺失或者突变,对于PRRSV没有影响,尤其是中国流行毒株中30个氨基酸的缺失,不会影响到PRRSV毒力的变化[19]。但是,在PL2的结构域中,有一些关键的氨基酸位点,将影响病毒的复制及功能。比如第55位的C,56位的G,124位的H和125位的 W的突变,对于PRRSV来说是致死性突变,而第111位,142位和147位的半胱氨酸则对于维持PL2的反式剪辑活性是必须的[18]。但是,这些位点在本试验毒株的基因序列中高度保守。另外,第26、80、174、198、201、209位氨基酸则变化较大。那么,是否可以推测,这些位点对于维持PL2这个重要的功能域的活性来说,不是关键性位点呢?当然,这还需要进一步的试验来验证。总之,通过对浙江地区流行毒株的Nsp2基因序列分析,可以看出其高变性,但是一些关键位点依然保守。
[1]Yoshii M,Okinaga T,Miyazaki A,et al.Genetic polymorphism of the nsp2gene in North American type-porcine reproductive and respiraiory syndrome virus[J].Arch Virol,2008,153(7):1323-1334.
[2]Ziebuhr J,Snijder E J,Gorbalenya A E.Virus-encoded proteinases and proteolytic processing in the Nidovirales[J].J Gen Virol,2000,81:853-879.
[3]Han J,Wang Y,Faaberg K S.Complete genome analysis of RFLP 184isolates of porcine reproductive and respiratory syn-drome virus[J].Virus Res,2006,122(1-2):175-182.
[4]刘 准,王凤雪,武 华.猪繁殖与呼吸综合征病毒非结构蛋白研究进展[J].动物医学进展,2010,31(12):120-124.
[5]Li Y,Wang X,Bo K,et al.Emergence of a highly pathogenic porcine reproductive and respiratory syndrome virus in the Mid-Eastern region of China[J].Vet J,2007,174:577-584.
[6]Tian K,Yu X,Zhao T,et al.Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoS ONE,2007,2(6):e526.
[7]Zhou Y J,Hao X F,Tian Z J,et al.Highly virulent porcine reproductive and respiratory syndrome virus emerged in China[J].Transboundary Emerg Dis,2008,55:152-164.
[8]Cho J G,Dee S A.Porcine reproductive and respiratory syndrome virus[J].Theriogenology,2006,66(3):655-662.
[9]陈钟鸣,张定东,方光远,等.PRRSV,CSFV和JEV混合感染的多联PCR诊断[J].动物医学进展,2008,29(12):23-27.
[10]Chen J,Liu T,Thu C G,et al.Genetic variation of Chinese PRRSV strains based on ORF5sequence[J].Biochem Gen,2006,44(9-10):425-435.
[11]杨汉春,黄芳芳.猪繁殖与呼吸综合征病毒(PRRSV)BJ24株全基因组序列测定与分析[J].农业生物技术学报,2001(9):212-218.
[12]Allende R,Lewis T L,Lu Z,et al.North American and European porcine reproductive and respiratory syndrome viruses differ in non-structural protein coding regions[J].J Gen Virol,1999,80:307-315.
[13]Nelsen C J,Murtaugh M P,Faaberg K S.Porcine reproductive and respiratory syndrome virus comparison:divergent evolution on two continents[J].J Virol,1999,73:270-280.
[14]刘业兵,郑 杰,宁宜宝.高致病性PRRSV(HuN株)Nsp2基因的扩增与分析[J].中国兽药杂志,2007,41(10):10-12.
[15]高志强,郭 鑫,杨汉春,等.猪繁殖与呼吸综合征病毒缺失变异株的基因组特征[J].畜牧兽医学报,2005,36(6):578-584.
[16]Cavanagh D.Nidoviralses:A new order comprising coronaviridae and arterividae[J].Arch Virol,1997,142:633-639.
[17]童光志,周艳君,都晓芳,等.高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007,9(5):323-326.
[18]Han J,Mark S R,Kay S F.The porcine reproductive and respiratory syndrome virus nsp2cysteine protease domain possesses both trans-and cis-cleavage activities [J].J Virol,2009,83:9449-9463.
[19]Zhou L,Zhang J L,Zheng J W,et al.The 30-amino-acid deletion in the Nsp2of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China is not related to its virulence[J].J Virol,2009,83:5156-5167.
