黄檗叶片内保护酶活性的时序变化1)
2011-05-31何冬明严善春鲁艺芳
何冬明 严善春 鲁艺芳
(东北林业大学,哈尔滨,150040)
在自然界,植物要面临病菌侵染、昆虫取食等一系列来自外界的压力,为了适应这种生态压力,植物形成了复杂的防御体系[1]。其中,过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)都是植物体内重要的保护酶[2-3],它们可以催化有机物,能够产生毒害昆虫的防御物质,从而有效地抵御害虫的侵袭[4-5],保证植株健康生长。黄檗(Phellodendron amurense Rupr.)又称黄波椤,为芸香科的阔叶乔木,是东北三大硬阔之一。一直以来很少有关于黄檗病虫害大发生和危害的报道。在本研究的样品采集过程中发现,黄檗遭到黄波椤丽木虱(Calophiya nigra Kuwayama)[6]的侵袭,造成大量叶片萎缩溃烂。哈尔滨松乐公园内黄檗人工混交林,丽木虱对其雌、雄株的危害率:7月份,分别为89.46%和67.31%;8月份,分别为65.93%和42.85%;6月份,危害率最低,分别为21.53%和12.97%。东北林业大学哈尔滨实验林场内黄檗人工混交林,丽木虱对雌、雄株的危害率;7月份,分别为93.62%和75.47%;8 月份,分别为 79.31%和 52.11%;6 月份,危害率最低,分别为30.77%和19.84%。由此可见,黄檗并非能抵御所有害虫,且不同月份的危害程度有明显差别。目前,国内外众多科研工作者对植物抗性与酶活关系的研究,大多是在胁迫条件下分析各种保护酶活性变化[7-10],而对自然条件下林木保护酶与抗性关系的研究较少,对黄檗的相关研究尚未见报道。本研究主要研究生长时期和健康状况对黄檗叶片内保护酶活性的影响,探索黄檗组成抗性防御机制,为黄檗人工林的有效管理和害虫防治提供理论参考。
1 材料与方法
1.1 植物材料
实验地点选在哈尔滨松乐公园和东北林业大学哈尔滨实验林场,黄檗均为人工混交林。松乐公园位于黑龙江省哈尔滨市香坊区,黄檗平均树龄为37 a,郁闭度为0.6左右,林内有白桦、榆树等乔木,紫丁香、榆叶梅等灌木。东北林业大学哈尔滨实验林场位于哈尔滨市南岗区,黄檗平均树龄为56 a,郁闭度在0.7左右,林内有樟子松、蒙古栎、榆树等乔木,乌苏里鼠李、暖木条荚蒾等灌木。2块样地立地条件相似。分别在6、7、8月每月月底,在2块样地随机抽取健康和受害的黄檗雌雄各6株,在每株样树树冠的上、中、下3个层次的东、南、西、北4个方向,即12个方位采摘叶片,将同株样树上所采摘的叶片充分混合装入夹链袋内,迅速放入冰盒,带回实验室放入冰柜中,-40℃保存,待测。
1.2 测定方法
1.2.1 CAT 活性测定
酶液的提取:称取1.0 g鲜样,液氮研磨,加入6 mL 0.05 mol/L磷酸缓冲液(pH=7.8);冰浴研磨至匀浆,4℃下,10 000 r/min离心10 min,取上清液为酶提液。
活性测定:参照王晶英的过氧化氢氧化法[11]82-83。取40 μL酶提液,加入2.5mL 0.05mol/L磷酸缓冲液和1mL蒸馏水,设置不加酶液为对照。反应体系在30℃水浴中保温10 min后,逐管加入0.3 mL 0.1 mol/L 的 H2O2,于240 nm 下测定吸光度,以1 min内OD240变化0.1的酶量为1个酶活力单位(U·g-1)。
1.2.2 POD 活性测定
酶液的提取:称取1.0 g鲜样,液氮研磨,加入6 mL 0.1 mol/L 的磷酸缓冲液(pH=6.0,每 100 mL 含 0.1 g PVP),冰浴研磨至匀浆,4℃下,10 000 r/min离心10 min,取上清液为酶提液。
活性测定:参照李合生[12]的愈创木酚法。取100 μL酶提液,加入2.9 mL 0.1 mol/L 磷酸缓冲液和 1 mL 0.1 mol/L愈创木酚,设置不加酶液为对照。反应体系在30℃水浴中保温30 min后,逐管加入1 mL 0.8%H2O2终止反应(测的时候现加),于470 nm下测定吸光度,以1 min内OD470变化0.01的酶量为1个酶活力单位(U·g-1)。
1.2.3 SOD 活力测定
酶液的提取:称取1.0 g鲜样,液氮研磨,加入6 mL 1/15 mol/L的磷酸缓冲液(pH=7.8),冰浴研磨至匀浆,4℃下,10 000 r/min离心10 min,取上清液为酶提液。
活性测定:参照王晶英的氮蓝四唑染色法[11]136-138,略有改动。样品值(光照):100 μL酶提液加3 mL反应液(0.05 mol/L磷酸缓冲液);最大光化值(光照):100 μL缓冲液加3 mL反应液;对照(暗处;调零):100 μL缓冲液加3 mL反应液。反应体系在4 000 lx日光灯下反应20 min,对照置于暗处,于560 nm下测定吸光度,以将氮蓝四唑(NBT)的还原抑制到50%时所需的酶量为1个酶活力单位(U·g-1)。
1.3 数据分析
数据处理使用SPSS16.0软件,采用Univariate模型对生长时期和健康状况进行交互效应分析(α=0.05或α=0.01);以One-Way ANOVA(单向方差分析法)和Paired-Sample T Test(配对样本t检验)进行差异显著性分析,以最小差异显著法LSD对生长时期和健康状况的影响进行多重比较分析。所有统计比较n=6。
2 结果与分析
2.1 生长时期及健康状况对黄檗叶片内保护酶活性的影响
从表1可看出,生长时期对CAT、POD和SOD的活性影响差异均极显著(p<0.01),健康状况对CAT、POD和SOD的活性影响不显著(p>0.05)。

表1 影响叶片内保护酶活性变化的主效应分析检验结果
2.2 健康和受害的黄檗叶片内CAT活性的时序变化
从表2中可看出,不同树龄的健康和受害黄檗雌、雄株叶片内CAT的活性大小依次为7月份、8月份、6月份,且7月份均与6、8月差异极显著(p<0.01),而健康和受害的叶片内CAT活性之间差异均不显著(p>0.05)。
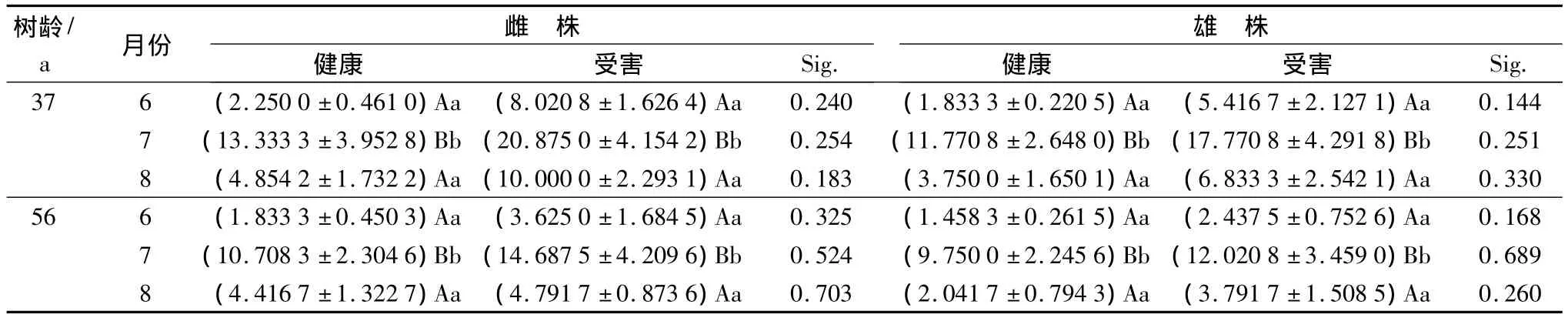
表2 不同生长时期健康和受害的黄檗叶片内CAT活性的时序变化 U·g-1min-1
2.3 健康和受害的黄檗叶片内POD活性的时序变化
从表3中可看出,不同树龄的健康和受害黄檗雌、雄叶片内POD的活性均表现为7月份>8月份>6月份。黄檗叶片内POD的活性,37年生的受害雌株及56年生的健康和受害雌株,7月份均与6月和8月差异极显著(p<0.01);37年生的健康雌雄株及56年生的健康雄株,6月份均与7月和8月差异极显著(p<0.01);37年生和56年生的受害雄株,6月、7月和8月之间差异均极显著(p<0.01)。健康和受害的叶片之间,7月份差异显著(p<0.05),而在6月份和8月份差异均不显著(p>0.05)。
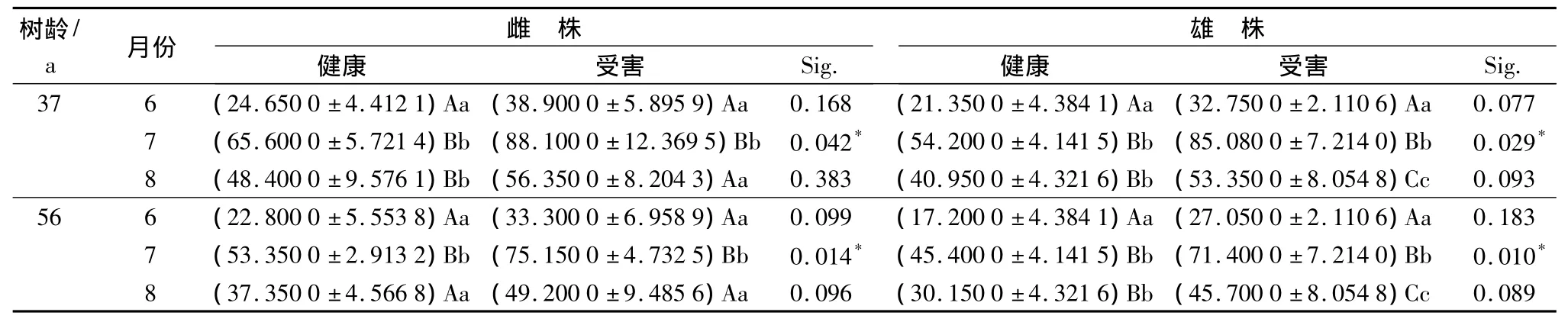
表3 不同生长时期健康和受害的黄檗叶片内POD活性的时序变化 U·g-1min-1
2.4 健康和受害的黄檗叶片内SOD活性的时序变化
从表4中可看出,不同树龄的健康和受害黄檗雌、雄叶片内SOD的活性由大到小依次为7月份、8月份、6月份。黄檗叶片内SOD的活性,37年生和56年生的健康雌株,6月份与7月和8月差异极显著(p<0.01);37年生的健康雄株、受害雌雄株及56年生的受害雌株,6月、7月和8月份之间差异均极显著(p<0.01);56年生的健康和受害雄株,7月份与6月和8月差异极显著(p<0.01);健康和受害叶片之间在各个月份差异均不显著(p>0.05)。
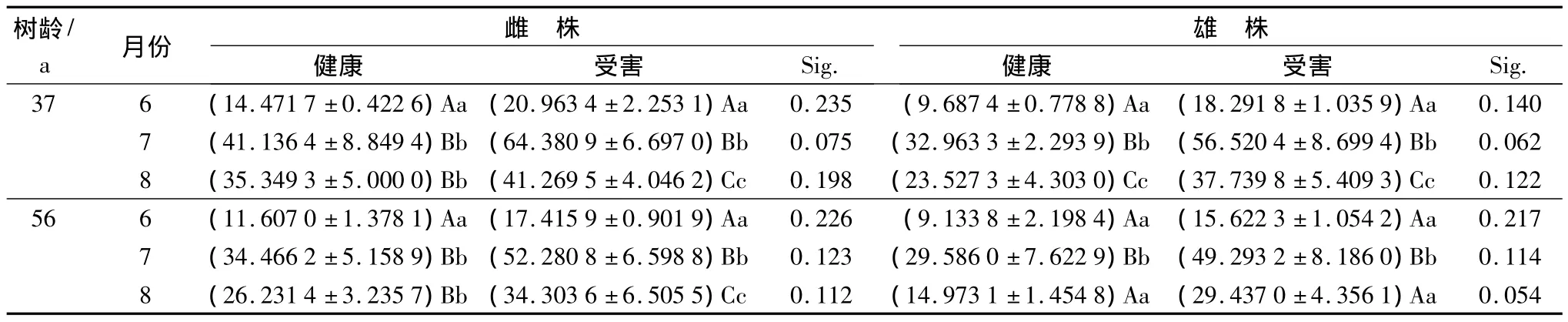
表4 不同生长时期健康和受害的黄檗叶片内SOD活性的时序变化 U·g-1
3 结束语
植物和昆虫在长期的协同进化过程中不断相互作用,彼此形成了许多防御及适应机制[13]。黄波椤丽木虱1 a发生3代,6月为第1代若虫危害期,7月为第2代若虫危害期,8月为第3代若虫危害期,7月下旬,随着个体数量的不断增加,若虫排泄的大量蜜露及由此滋生的煤污病造成60%的若虫死亡[6],使第3代若虫数量大幅度降低。本研究结果表明健康和受害的黄檗叶片内CAT、POD和SOD的活性均表现为7月份>8月份>6月份,这种变化与其害虫黄波椤丽木虱的种群数量变化趋势相吻合。说明黄檗为抵御丽木虱的危害,在长期的协同进化过程中形成了独特的随时序调整抗虫性的机制。
植物对昆虫的防御是通过物理防御和化学防御共同实现的[14],害虫的胁迫能引起植物生理的应激反应[15],而应激反应可表现为保护酶活力的变化[16]。本研究结果发现,健康和受害的黄檗叶片内保护酶的活性,POD只有在7月份差异显著(p<0.05),其在6月和8月以及CAT和SOD在各个月份差异均不显著(p>0.05)。这说明黄檗诱导抗性机制较差,诱导防御不是其自身保护的主要措施。
[1]Lacy S,Thomas L B,Sullivan T J.Effects of methyl jasmonate and an endophytic fungus on plant resistance to insect herbivores[J].Journal of Chemical Ecology,2008,34(12):1511 -1517.
[2]陈祖静,曹支敏,苟兴庆,等.杨树与松杨栅锈菌互作中寄主活性氧及抗性相关酶变化[J].林业科学,2010,46(8):101 -106.
[3]Vatankhah E,Niknam V,Ebrahimzadeh H.Activity of antioxidant enzyme during in vitro organogenesis in Crocus sativus[J].Biologia Plantarum,2010,54(3):509 -514.
[4]Yordanova R Y,Christov K N,Popova L P.Antioxidative enzymes in barley plants subjected to soil flooding[J].Environmental and Experimental Botany,2004,51(2):93 -101.
[5]Wang Zunsheng,Gu Yuxiang,Yuan Qinsheng.Effect of nutrition factors on the synthesis of superoxide dismutase,catalase,and membrane lipid peroxide levels in Cordyceps militaris Mycelium[J].Current Microbiology,2006,52(1):74 -79.
[6]许雄山,侯爱菊,刘景全.黄波椤丽木虱的初步研究[J].东北林业大学学报,1991,19(专刊):197 -208.
[7]徐兴友,王子华,张风娟,等.干旱胁迫对6种野生耐旱花卉幼苗根系保护酶活性及脂质过氧化作用的影响[J].林业科学,2008,44(2):41 -47.
[8]李跃强,宣维健,盛承发.大强度去叶对棉花叶绿素和保护酶系的影响[J].生态学报,2006,26(3):830 -836.
[9]Li Dongxiao,Li Cundong,Sun Hongchun,et al.Effects of drought on soluble protein content and protective enzyme system in cotton leaves[J].Frontiers of Agriculture in China,2010,4(1):56 -62.
[10]Ren Yinghong.Protective enzyme activity and physiological properties of fourmulberry varieties affected by drought stress in the Panxi Region of Sichuan Province,China[J].Forestry Studies in China,2009,11(3):190 -195.
[11]王晶英,敖红,张杰,等.植物生理生化实验技术与原理[M].哈尔滨:东北林业大学出版社,2003.
[12]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:164-169.
[13]彭金英.植物和昆虫相互关系:植物对植食性昆虫的防御反应和昆虫的生理适应[D].上海:中国科学院研究生院(上海生命科学研究院),2005.
[14]Revandy I D,Mahmood M,Mohd R I,et al.Responses of the antioxidative enzymes in Malaysian rice(Oryza sativa L.)cultivars under submergence condition[J].Acta Physiologiae Plantarum,2010,32(4):739 -747.
[15]Kaarina P,Jyrki P,Katja K,et al.Genotypic variation in growth and resistance to insect herbivory in silver birch(Betula pendula)seedlings[J].Oecologia,2003,137(4):572 -577.
[16]Zhang Shize,Hua Baozhen,Zhang Fan.Induction of the activities of antioxidative enzymes and the levels of malondialdehyde in cucumber seedlings as a consequence of Bemisia tabaci(Hemiptera:Aleyrodidae)infestation[J].Arthropod-Plant Interactions,2008,2(4):209-213.
