秋水仙碱肝损伤机制探讨
2011-05-31宋金萍陈雪梅张富春
宋金萍,王 涛,陈雪梅,杨 洁,张富春,尚 靖
(1.新疆大学生命科学与技术学院,新疆乌鲁木齐 830046;2.中国药科大学新药筛选中心,江苏南京 210009)
秋水仙(Colchicum autumnaleL.),百合科秋水仙属多年生草本植物,是我国新疆维吾尔常用药材,药用部位多为球茎。主要成分为生物碱,秋水仙碱是已知其主要药效和毒性成分,其余还包括2-去甲秋水仙碱,2-去甲脱羰秋水仙碱,2-去甲-17-羟基秋水仙碱,2-去甲-β-光秋水仙碱,β-光秋水仙碱等[1]。
秋水仙碱(colchicin,COL)主要用于治疗急性痛风以及痛风的防预。近年来其临床应用又有所拓宽,发现其有抗肿瘤、抗纤维化活性,并对肝炎、心包炎、青光眼等疾病也有一定疗效[2-3]。秋水仙碱治疗剂量范围窄,容易造成毒副作用。临床主要不良反应包括:胃肠道症状,肌肉、外周神经病变,肝功能损害,骨髓抑制,休克,致畸,脱发、皮疹、发热等。肝脏是秋水仙碱的主要代谢部位,也是毒性靶器官。秋水仙碱肝毒性机制尚不明确,本文旨在探讨秋水仙碱的肝损伤机制。
1 材料和方法
1.1动物SPF级SD大鼠,♀♂各半,体质量(250±20)g,购自军事医学科学院实验动物中心,合格证号:SCXK(军)2007-0004;
1.2药品与主要试剂秋水仙碱由南京泽郎公司提供(纯度>99%),批号:ZL201001010A;秋水仙总碱,棕黄色粉末(1 g总碱/200 g粗提物),含量>80%,自秋水仙粗提物分离提纯,由新疆自治区维吾尔药物研究所提供,经HPLC测定秋水仙碱含量为9.7%。一抗:MRP2(M2Ⅲ-5):sc-59611;CYP7A1(H-58):sc-25536;BSEP(H-180):sc-25571;FXR(H-130):sc-13063均购 Santa Cruz。β-actin一抗:(A1978)购自Sigma公司。BCA蛋白浓度测定试剂盒(P0010),全蛋白提取试剂盒 RIPA裂解液(P0013B)购自上海碧云天生物技术有限公司。
1.3实验方法
1.3.1动物饲养动物饲养于屏障系统内〔动物设施使用许可证号:SYXK(苏)2007-0017〕空气洁净度10 000级气流速度(0.1 ~0.2)m·s-1,环境压差(20~50)Pa,温度(20~25)℃,湿度40% ~70%,氨浓度≤14 mg·m-3,换气(10 ~20)次·h-1,明暗交替时间12 h/h,每笼5只,自由摄食和进水。鼠全价颗粒饲料购自江苏协同生物医药工程有限公司。
1.3.2分组与给药70只SD大鼠随机分为正常对照组(ig,0.5%CMC-Na)、对乙酰氨基酚组(ig,4-acetamidophenol 1.0 g·kg-1)、秋水仙碱组(ig,2、4、6 mg·kg-1)、秋水仙总碱组(ig,10、20 mg·kg-1)。各实验组大鼠每天连续灌胃染毒28 d。染毒期间每3天记录各组大鼠的体重和摄食量。实验结束后,股动脉采血约8 ml,用于血清生化指标的检测。快速分离大鼠肝脏并称重。取大鼠肝右大叶,经10%中性甲醛固定后,进行病理学检查。剩余肝组织置于液氮中保存备用。
1.3.3血生化检测指标测定血清三酰甘油(TG)、总胆固醇(TC)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶 (AST)碱性磷酸酶(ALP)、总蛋白(TP)、白蛋白(ALB)、总胆汁酸(TBA)、总胆红素(TBiL)、血糖(GLU)含量以评价肝功能。
1.3.4肝组织病理学检测大鼠肝脏石蜡包埋,连续切片,进行常规HE染色,光学显微镜下观察组织病理改变。
1.3.5免疫组织化学法检测MRP2的表达变化免疫组织化学染色采用 HRP-Polymerase标法,石蜡组织切片经抗原暴露修复、血清封闭后,加入相应第一抗体MRP2(M2Ⅲ-5):sc-59611(1∶100),第二抗体(1∶3 000),进行肝组织原位检测MRP2表达量变化。
1.3.6肝组织蛋白样品制备按照碧云天全蛋白提取法提取肝组织蛋白。采用BCA蛋白浓度测定试剂盒测定蛋白含量。蛋白变性后,用Western blot检测目标蛋白表达量。
1.3.7Western blot检测FXR、BSEP、CYP7A1蛋白表达变化上述制备好的蛋白样品,进行聚丙烯凝胶电泳,蛋白上样量为60 μg。按分子量大小不同,制备不同浓度凝胶。电泳条件为80 V,30 min;120 V,80 min。湿转条件为0.32 A,3 h。一抗稀释比例,CYP7A1(1 ∶300),BSEP(1 ∶300),FXR(1∶300)。凝胶成像仪曝光30 min,并进行灰度扫描分析。
1.3.8数据处理和统计方法数据用±s表示,组间的差异性分析采用单因素方差(oneway-ANOVO)和组间t检验。所有数据均采用SPSS12.0统计软件包进行分析。
2 结果
2.1秋水仙碱对大鼠体重和肝脏脏器指数的影响与正常对照组比较,染毒给药3 d后,秋水仙碱6 mg·kg-1、秋水仙总碱 20 mg·kg-1和阳性药对乙酰氨基酚组大鼠体质量明显下降;其余染毒组大鼠体重增长正常(Fig 1)。与正常组相比,除秋水仙总碱10 mg·kg-1,其余各染毒组大鼠肝重/体重指数均明显升高(Tab 1)。
2.2秋水仙碱对大鼠血生化指标的影响与正常对照组相比,除秋水仙总碱10 mg·kg-1组,其余各组血清ALT活性均明显升高。对乙酰氨基酚组,ALP、TBA水平也明显增加,ALB、TP和GLU水平均正常。秋水仙碱6 mg·kg-1组血清ALB和TP含量均明显降低,而ALP活性和TBA含量明显升高。秋水仙总碱组,血糖水平偏高,其余指标无明显变化(Tab 2)。
Tab 1 Effect of COL,TA(ig,28 d)on liver weight and liver index of intoxicated rats(±s,n=10)

Tab 1 Effect of COL,TA(ig,28 d)on liver weight and liver index of intoxicated rats(±s,n=10)
COL:colchicines;TA:total alkaloid extract of Colchicum autumnale L;APAP:4-Acetamidophenol.*P <0.05,** P <0.01 vs control group.
Control 0.5%CMC-Na 348.8 ±22.8 9.7 ±0.6 2.70 ±0.15 APAP 1000 306.0 ±16.5**14.7 ±0.9* 4.80 ±0.15*COL 2 332.5 ±1.5 10.0 ±0.3 2.90 ±0.10*4 338.3 ±7.6 10.9 ±0.6 3.20 ±0.09**6 313.0 ±14.0**10.3 ±0.8 3.30 ±0.26**TA 10 337.6 ±14.9 9.1 ±0.6 2.70 ±0.02 20 306.1 ±19.7** 8.9 ±0.7 3.30 ±0.26**

Fig 1 Effect of COL,TA(ig,28 d)on body weight of intoxicated rats(±s,n=10)
Tab 2 Effect of COL,TA on the blood biochemistry in rat(±s,n=10)
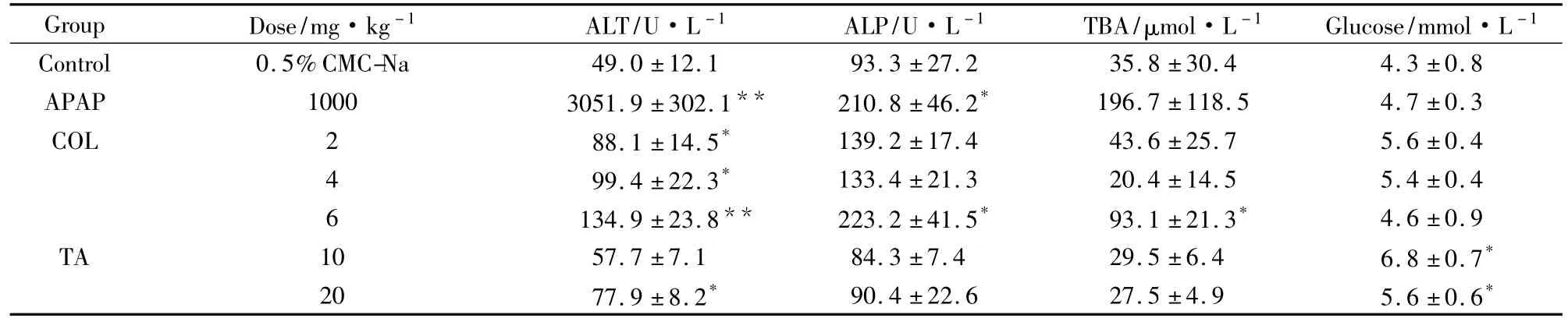
Tab 2 Effect of COL,TA on the blood biochemistry in rat(±s,n=10)
*P<0.05,**P<0.01 vs control group
Group Dose/mg·kg-1 ALT/U·L-1 ALP/U·L-1 TBA/μmol·L-1 Glucose/mmol·L -1 Control 0.5%CMC-Na 49.0 ±12.1 93.3 ±27.2 35.8±30.4 4.3 ±0.8 APAP 1000 3051.9 ±302.1** 210.8 ±46.2* 196.7 ±118.5 4.7 ±0.3 COL 2 88.1 ±14.5* 139.2 ±17.4 43.6 ±25.7 5.6 ±0.4 4 99.4 ±22.3* 133.4 ±21.3 20.4 ±14.5 5.4 ±0.4 6 134.9 ±23.8** 223.2 ±41.5* 93.1 ±21.3* 4.6 ±0.9 TA 10 57.7 ±7.1 84.3 ±7.4 29.5 ±6.4 6.8 ±0.7*20 77.9 ±8.2* 90.4 ±22.6 27.5 ±4.9 5.6 ±0.6*

Fig 2 Effects of COL,TA on pathological impairment of liver tissue in intoxicated rats(HE)
2.3大鼠肝脏组织病理学改变在光镜下可以观察到,正常组大鼠肝细胞排列整齐,中央静脉和汇管区结构正常。对乙酰氨基酚组大鼠肝凝固性坏死,纤维组织增生 ),肝内有假小叶结构,肝内淤胆,小胆管纤维增生,淋巴细胞浸润。秋水仙碱2 mg·kg-1和4 mg·kg-1组在组织水平未见明显病变。秋水仙碱6 mg·kg-1组,大鼠肝脏可见多处灶性坏死(⇨),淋巴细胞浸润(→),并伴有严重的肝细胞水肿。秋水仙总碱10 mg·kg-1组,大鼠肝脏也未观察到明显病变。秋水仙总碱20 mg·kg-1组大鼠肝脏也发现小灶性坏死细胞,淋巴细胞浸润,并伴有严重的脂肪变性(▶),结果见Fig 2。
2.4秋水仙碱对大鼠肝脏组织MRP2表达的影响MRP2在肝细胞质膜表达,着棕红色,为阳性信号。与正常对照组相比,对乙酰氨基酚组和秋水仙碱6 mg·kg-1组MRP2阳性细胞率均降低,且质膜着色区域少。总碱20 mg·kg-1组,阳性细胞率和质膜着色区域无区别,结果见Fig 3。
2.5秋水仙碱对大鼠肝脏胆汁酸合成酶和转运蛋白表达量的影响与正常对照组相比,秋水仙碱6 mg·kg-1组和对乙酰氨基酚组的变化趋势一致,均能诱导FXR明显下调,CYP7A1明显上调,BSEP表达也有所下调,灰度分析结果见Fig 4。
3 讨论
本研究结果表明,SD大鼠灌服染毒28 d 6 mg·kg-1秋水仙碱和20 mg·kg-1秋水仙总碱提取物可导致肝细胞功能损伤,肝组织病变。与正常对照组相比,6 mg·kg-1秋水仙碱和20 mg·kg-1秋水仙总碱提取物均可诱导ALT活性明显升高。但是与20 mg·kg-1秋水仙总碱提取物组相比,秋水仙碱6 mg·kg-1组ALT活性约是其2倍;肝组织灶性坏死,肝细胞水肿和脂肪变性程度比其严重。
同时,我们还发现,与对乙酰氨基酚组一致,秋水仙碱组的大鼠血清ALP和TBA水平均明显升高。由此提示我们,秋水仙碱和对乙酰氨基酚对肝脏中胆汁酸合成及转运通路中的相关靶标蛋白的表达可能有影响。

Fig 3 Immunohistochemical detection of MRP2 in livers of rats treated with COL,TA(400×)
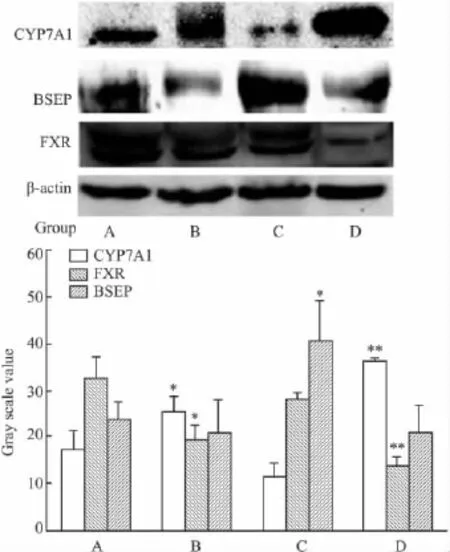
Fig 4 Western blot detection of CYP7A1,BSEP,FXR in livers of rats treated with COL,TA
肝脏中胆汁酸主要由CYP7A1启动并限速的经典途径合成[4]。在体内,FXR与异源二聚体伴侣(SHP)结合为复合体,可以直接作用于CYP7A1的启动子,抑制CYP7A1的转录,从而抑制胆汁酸的合成[5-6]。
肝细胞上胆汁酸主要的转运蛋白是MRP2和BSEP。MRP2参与的胆汁排泌是肝脏胆汁形成的主要过程和限速步骤[7]。研究表明MRP2基因突变是导致肝内胆汁淤积的主要原因之一。现已发现ABCB11基因的某些变异导致BSEP的低表达会使人们对药物诱导的肝内胆汁淤积的易感性增加[8-9]。研究还证实FXR对MRP2和BSEP都具有正调控作用[10-14]。
研究发现,与正常对照组相比,秋水仙碱6 mg·kg-1组和对乙酰氨基酚组大鼠肝脏FXR表达量明显下降,同时CYP7A1表达升高,BSEP表达有所降低(Fig 4)。免疫组化检测也发现,和正常对照组比较,秋水仙碱6 mg·kg-1组和乙酰氨基酚组大鼠肝脏中的MRP2蛋白表达均下调(Fig 2)。
因此推断,秋水仙碱引起大鼠肝脏损伤时抑制了核受体FXR的表达,致使肝细胞中胆汁酸负反馈调控失控,CYP7A1过表达,胆酸合成失衡。同时胆汁酸转运蛋白MRP2和BSEP的表达下调,更加剧了肝细胞内大量胆酸对肝细胞的细胞毒性。肝细胞淤胆损伤条件下,胆酸会被转运至血管,再经肾脏排泄,以减轻对肝脏的损伤。但是在病理条件下,秋水仙碱对胆汁合成和转运的干预机制有待于进一步探讨。
研究结果显示,秋水仙碱和秋水仙总碱提取物的大鼠28 d灌服给药均可引起肝损伤,但肝损伤程度和机制有差别。①在本实验的用药剂量下,秋水仙碱和秋水仙总碱提取物比较,秋水仙碱对大鼠肝功能和肝组织损伤更为严重。②秋水仙碱和对乙酰氨基酚,都可诱导大鼠血清TBA和ALP水平明显升高,肝毒性特征为胆汁淤积;且均诱导FXR、BSEP和MRP2表达降低,CYP7A1表达上调,因此推断二者引起大鼠肝细胞内胆汁淤积的机制相似。
[1]何红平,胡 琳,刘复初 .秋水仙的化学成分[J].化学研究与应用,1999,11(5):509 -10.
[1]He H P,Hu L,Liu F C.Chemicl constituents of colchicum autumnale[J].Chem Res Appl,1999,11(5):509 - 10.
[2]田冰锋.秋水仙碱临床应用的若干进展[J].昆明医学院学报,2009,30(2B):107 -11.
[2]Tian B F.Progress in the clinical application of colchicines[J].J Kunming Med Univ,2009,30(2B):107 -11.
[3]陈小亮,李 俊,邓子煜,等.苦参素对肝纤维化大鼠肝脏TGF-β1 的调节作用[J].中国药理学通报,2009,25(6):761-4.
[3]Chen X L,Li J,Deng Z Y,Jin Y,et al.Regulating effect of oxymatrine on TGF-β1 in CCl4-induced hepatic fibrosis rats[J].Chin Pharmacol Bull,2009,25(6):761 - 4.
[4]Gueguen Y,Souidi M,Baudelin C,et al.Short-term hepatic effects of depleted uranium on xenobiotic and bile acid metabolizing cytochrome P450 enzymes in the rat[J].Arc Toxicol,2006,80(4):187-95.
[5]李小林,朱心强.胆汁酸代谢相关核受体的研究进展[J].中国药理学与毒理学杂志,2007,21(2):152-6.
[5]Li X L,Zhu X Q.Advance in the research on several nuclear receptor related to bile acid metabolism[J].Chin J Pharmacol Toxicol,2007,21(2):152 -6.
[6]吴晓平,柴 进,陈文生.阻塞性胆汁淤积大鼠肝脏胆固醇7A-羟化酶和核受体FXR、SHP表达变化[J].第二军医大学学报,2009,30(12):1398 -401.
[6]Wu X P,Chai J,Chen W S.Changes of cholesterol 7alpha-hydroxylase,farnesoid X receptor,and small heterodimer partner expression in liver tissues of rat s with obstructive cholestasis[J].Acad J Second Mil Med Univ,2009,30(12):1398 -401.
[7]Zinchuk V S,Okada T,Akimaru K,Seguchi H.Asynchronous expression and colocalization of Bsep and Mrp2 during development of rat liver[J].Am J Physiol Gastrointest Liver Physiol,2002,282(3):G540-8.
[8]申遂科,马巧莲.急性药物性肝病60例临床分析[J].新乡医学院学报,2006,23(3):290-1.
[8]Shen S K,Ma Q L.Clinical analysis for 60 cases of acute drug-induced hepatotoxicity[J].J Xinxiang Med Coll,2006,23(3):290-1.
[9]刘丽艳,朱启镕,王建设.ABCB11基因变异与淤胆性疾病[J].实用儿童临床杂志,2009,24(19):1525-7.
[9]Liu L Y,Zhu Q R,Wang J S.ABCB11 gene variation and cholestatic diseases[J].Appl Clin Pediatr,2009,24(19):1525 - 7.
[10]吴晓平,柴 进,何 宇,等.梗阻性黄疸大鼠肝细胞 MRP2和FXR蛋白表达变化及意义分析[J].胃肠病学和肝病学杂志,2009,17(9):765-7.
[10]Wu X P,Chai J,He Y,et al.Changes of MRP2 and FXR expression in bile duct ligated rat liver and the significance[J].Chin J Gastroenterol Hepato,2009,17(9):765 -7.
[11]Lu T T,Makishima M,Repa J J,et al.Molecular basis for feedback regulation of bile acid synthesis by nuclear receptors[J].MOC,2000,6(3):507 -15.
[12]黄健容,刘 建,常淑芳.FXR、BSEP在ICP胎盘胆酸转运中的作用机制研究[J].重庆医学,2006,35(21):1949-50.
[12]Huang J R,Liu J,Chang S F.Mechanism of FXR receptor and BSEP on bile acid transport in placenta of ICP[J].Chongqing Med,2006,35(21):1949 -50.
[13]Zhang Y,Edwards P A.FXR signaling in metabolic disease[J].FEBS Letter,2008,582(1):10 -8.
[14]Ananthanarayanan M,Balasubramanian N,Makishima M,et al.Human bile salt export pump promoter is transactivated by the farnesoid X receptor/bile acid receptor[J].J Chem,2001,276(31):28857-65.
