多杀菌素生产菌种保藏方法的研究
2011-05-30漏佳伟傅盼翰裘娟萍
漏佳伟,傅盼翰,裘娟萍
(1.浙江工业大学 生物与环境工程学院,浙江 杭州 310014;2.浙江工业大学 健行学院,浙江 杭州 310014)
多杀菌素 (spinosad)是刺糖多孢菌(Saccharopolyspora spinosa)有氧发酵产生的次级代谢产物,是一种安全、高效、广谱的大环内酯类杀虫剂,其主要有效成分是多杀菌素A和D[1-3]。实验证明多杀菌素能有效防治害虫,尤其对鳞翅目、缨翅目害虫有极强的选择性毒杀作用[4-7]。多杀菌素的杀虫作用具较强的靶标性,对烟芽夜蛾等重要农业害虫的杀虫活性远远超过常用的多种有机磷类、环戊二烯类、氨基甲酸酯类杀虫剂,对非靶标生物的毒性很低,对包括人在内的哺乳动物非常安全[8-9],迄今为止没有发现与其他杀虫剂有交叉抗性[10-11]。国内外对于多杀菌素的物理化学性质、作用机理和毒性、杀虫谱、分析检测方法和发酵工艺都做了大量的研究,但由于菌种在保藏过程中易退化,产量极不稳定,导致国内多杀菌素依然没有实现工业化生产。为此,研究刺糖多孢菌的稳定性,找到维持产量稳定的保藏方法,对实现多杀菌素工业化生产具有重大意义。
1 材料与方法
1.1 菌种
刺糖多孢菌5个菌株 (本实验室保存菌种),其特性列于表1。

表1 待保藏菌株的典型特性
1.2 培养基
固体培养基。葡萄糖0.9%,MgSO4·7 H2O 0.2%,酵母膏0.3%,玉米浆1.0%,琼脂2.0%,pH值7.0
种子培养基。葡萄糖1.0%,酵母膏0.4%,蛋白胨 0.4%,MgSO4·7 H2O 0.05%,KH2PO40.002%,K2HPO40.004%,p H值7.0
发酵培养基。葡萄糖7.0%,蛋白胨2.5%,CaCO30.5%,玉米浆1.5%,大豆油4.0%,棉籽粉2.5%,p H值7.0。
1.3 主要仪器与试剂
主要仪器有:gilent 1100 series液相色谱仪(美国安捷伦公司),Thermo Scientific Heraeus Multifuge X1 R离心机 (美国热电公司),SPX-250B-Z生化培养箱 (上海博讯实业有限公司),PYX-DHS-40×50隔水式电热恒温培养箱 (上海市跃进医疗器械一厂),ZHWY-2112B双层特大容量恒温培养振荡器 (上海智诚分析仪器制造有限公司),SW-CJ-1F超净工作台 (苏净集团安泰公司)。
试剂,多杀菌素标样 (菜喜)(美国陶氏益农公司)。
1.4 方法
1.4.1 菌种斜面低温保藏
将菌种接种在斜面培养基上,30℃培养7 d,置于密封盒中4℃低温保藏。
1.4.2 菌种冻干管保藏
带棉塞的安瓿管灭菌备用。脱脂牛奶间歇灭菌备用。在培养好的斜面中加入无菌脱脂牛奶制成孢子悬液,分装于安瓿管中,每管4~5滴。将安瓿管预冻至-30℃左右,置于冷冻机内进行冷冻真空干燥直至水分被抽干,继续抽真空冻干30 min。在真空条件下熔封,用高频电火花真空测验器检查真空度,真空管放入密闭容器,4℃低温保藏[12]。
1.4.3 菌种沙土管保藏
河沙过80目 (0.177 mm)筛,用20%盐酸浸泡24 h后弃盐酸,水洗至中性,将沙子烘干备用。取非耕作层瘦黄土 (不含有机质),研碎后过100目 (0.149 mm)筛并用水洗至中性,烘干备用。将处理后的沙、土按质量比3∶1混合。混匀的沙土分装入安瓿管中,每管0.35 g,塞好棉塞,121℃湿热灭菌30 min,无菌检验合格后烘干备用。需保藏菌株斜面培养,以无菌水制成孢子悬液滴入沙土管中,每支沙土管4至5滴 (刚刚使沙土润湿),塞好棉塞,低温真空抽去水分。在真空条件下熔封,用高频电火花真空测验器检查真空度,真空管放入密闭容器,4℃低温保藏[12]。
1.4.4 菌株产孢能力测定
菌种保藏30,90,180,270 d,将各保藏菌株用斜面活化,在30℃恒温培养箱中培养7 d,观察菌薹上的孢子形成情况。
菌种保藏180,270 d后,用无菌生理盐水将沙土管和冻干管中的菌株制成单孢子悬液,适当稀释后涂布平板,30℃恒温培养7 d,各菌株挑取10个大小相似、呈火山口型的典型单菌落至斜面,冻干管菌株分别标记为1、2、…、10,沙土管菌株分别标记为a、b、…、j。在30℃恒温培养箱中培养7 d,观察菌薹上的孢子形成情况。
1.4.5 菌株死亡率检验
将安瓿管中的孢子移至装有无菌生理盐水的试管中,振荡打散,制成单孢子悬液,用血球板计数法测定孢子总数。将孢子悬液适当稀释后涂布于平板上,每组3个平板。30℃恒温培养7 d,记录菌落形成单位数。菌株死亡率的计算公式:死亡率(%)=(孢子总数-菌落形成单位数)/孢子总数×100。
1.4.6 菌株耐药性检验
将一定浓度的红霉素、乙酸钠分别加入固体培养基中,制成平板,再将菌株划线接种至加药平板与不加药物的对照平板上,于30℃下培养10 d,观察菌株生长情况,计算其典型遗传特性保持率。计算公式:典型遗传特性保持率 (%)=抗性平板菌株数/对照平板菌株数×100。
1.4.7 菌株摇瓶发酵条件
菌株用种子培养基30℃、220 r·min-1培养48 h,取3 mL种子液接种至含30 mL发酵培养基的250 mL锥形瓶中,于30℃、220 r·min-1条件下培养7 d。
1.4.8 高效液相色谱法测定
参照张苑的方法[13],色谱柱:Agilent XDB C18;流动相:甲醇∶乙腈∶0.05%的乙酸钠水溶液为 45∶45∶10(V∶V);流速:1.0 mL·min-1;进样量:20 μL;柱温:室温。
菌株相对效价 (%)=菌株产量/原始菌株产量×100,默认原始菌株产量为100%;产量下降率 (%)=(原始菌株产量-菌株产量)/原始菌株产量×100。
2 结果与讨论
2.1 保藏方法对刺糖多孢菌不同菌株产孢能力的影响
2.1.1 保藏30 d
保藏30 d,菌薹上的孢子形成情况见表2。
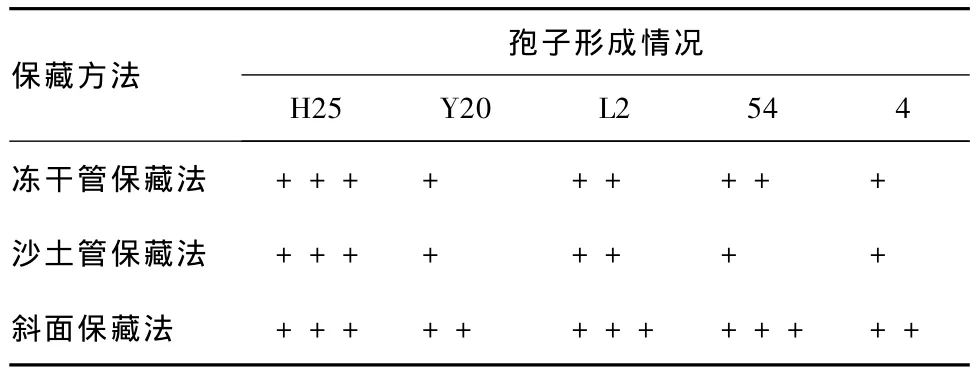
表2 保藏30 d各菌株的孢子形成情况
分析表2可知,保藏30 d,斜面保藏法对菌株产孢子的能力影响最小,冻干管保藏法和沙土管保藏法对其影响基本相同,均有减弱趋势。
2.1.2 保藏90 d
保藏90 d,菌薹上的孢子形成情况见表3。
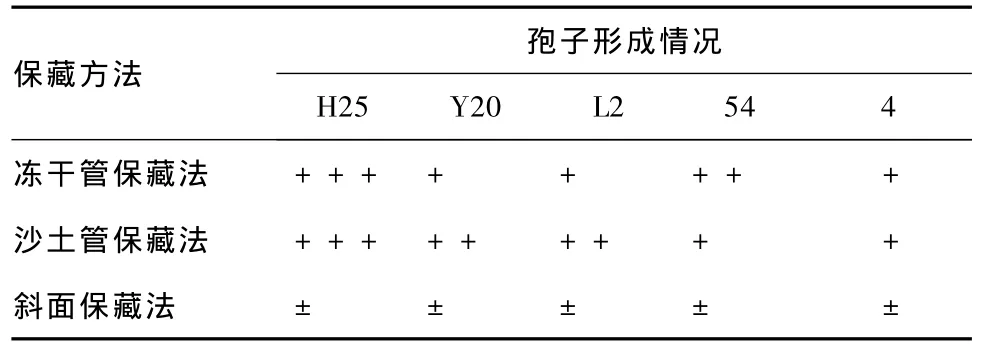
表3 保藏90 d各菌株的孢子形成情况
分析表2和3可知,保藏90 d,斜面保藏的菌株产孢能力退化严重,冻干管和沙土管保藏的菌株产孢能力与保藏30 d的情况基本一致。由此说明,斜面保藏法不适用于长期保藏。
2.1.3 保藏180 d
保藏180 d,菌薹上的孢子形成情况见表4。

表4 保藏180 d各菌株的孢子形成情况
分析表4可知,保藏180 d,斜面保藏的菌株存活率为零,冻干管和沙土管保藏菌株生长状况明显减弱,产孢能力退化严重。
对比表2、3和4中菌株的生长及孢子形成情况可知,随着菌株保藏时间延长,菌株的生长及孢子形成能力均严重退化。
沙土管和冻干管中的菌株分离纯化后菌薹上的孢子形成情况见表5和表6。

表5 冻干管保藏180 d各菌株分离纯化株的孢子形成情况
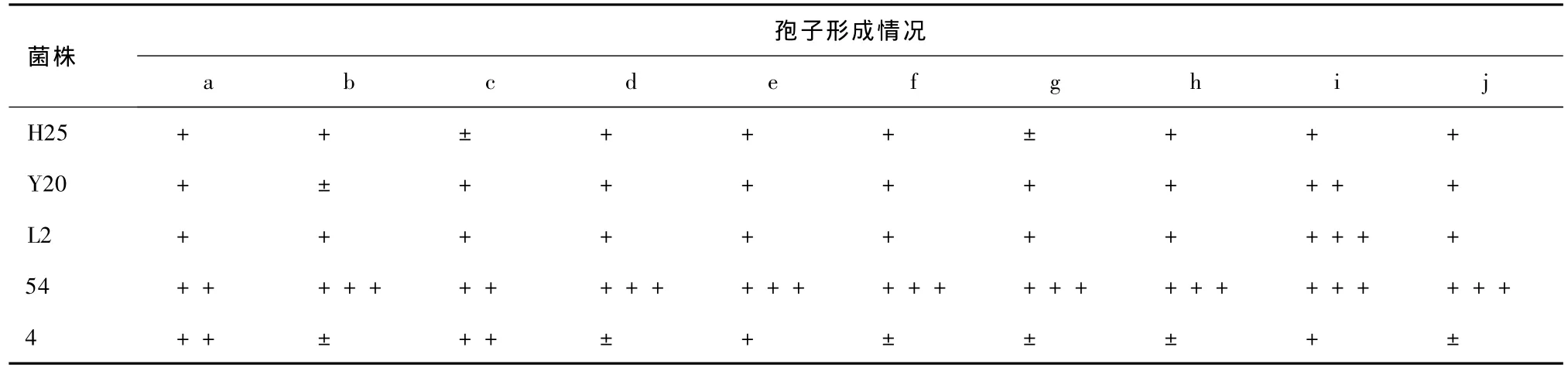
表6 沙土管保藏180 d各菌株分离纯化株的孢子形成情况
对比表5和表6可知,同种保藏方法对不同菌株的保藏效果差异明显,说明不同菌株的抗逆性不同。冻干管保藏法对菌株的生长及产孢能力影响较小,大部分菌株生长较旺盛。菌株54的分离纯化株产孢能力最强,与其原始典型特性 (表1)相符。
对比表4、5和6中菌株的生长及孢子形成情况可知,若先经平板分离纯化,挑取健壮单菌落至斜面,则菌株的生长状况相对旺盛,产孢能力强。这说明孢子的初步分离纯化可达到一定程度的复壮效果。菌株54的产孢能力提高幅度最大,L2其次,其余3个菌株较小。
由此可知,菌株的产孢能力不仅受保藏方法的影响,而且与保藏时间的长短、菌株本身的特性等因素有关。
2.1.4 保藏270 d
保藏270 d沙土管和冻干管中的菌株分离纯化后菌薹上的孢子形成情况见表7和表8。
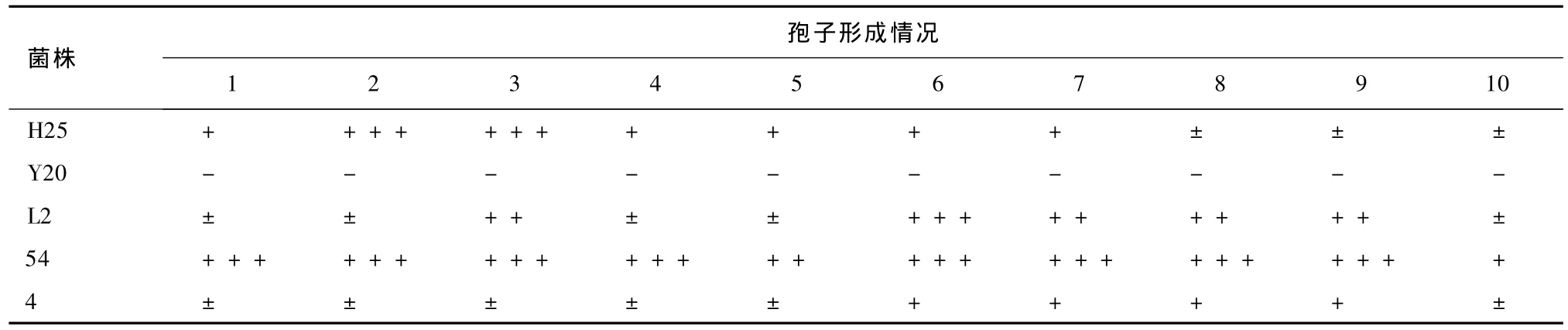
表7 冻干管保藏270 d各菌株的孢子形成情况

表8 沙土管保藏270 d各菌株的孢子形成情况
对比表7和表8可知,冻干管和沙土管保藏法对菌株产孢能力的影响基本相同。其中,菌株54的产孢能力强。
分析比较表5和表7、表6和表8可知,随着保藏时间的延长,菌株的产孢能力下降。
2.2 保藏方法对菌株死亡率的影响
保藏180 d、270 d计算菌株死亡率,结果见图1、图2。

图1 冻干管保藏法对菌株死亡率的影响
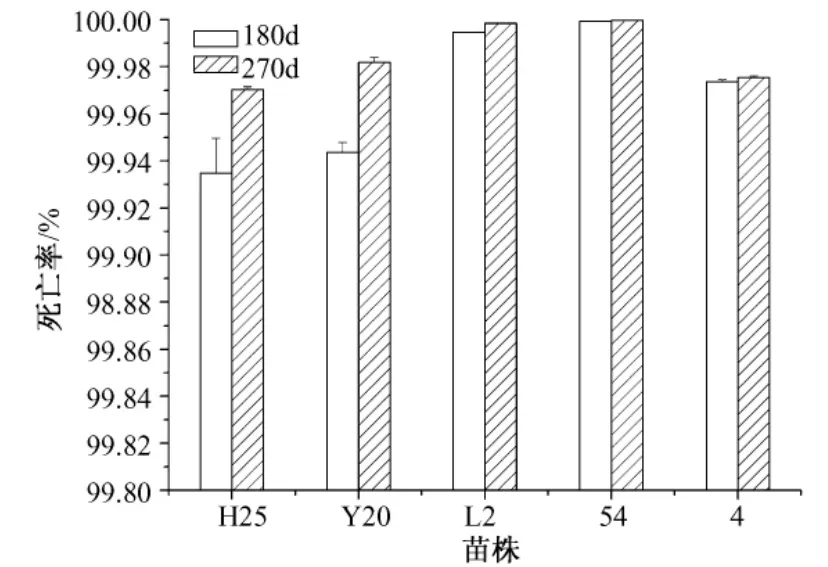
图2 沙土管保藏法对菌株死亡率的影响
从图1和2可以看出,保藏180 d、270 d,各菌株的死亡率都大于90%,特别是沙土管保藏的菌株,死亡率都接近100%。对比图1和图2,冻干管保藏菌株死亡率相对较低,保藏效果相对较好。这说明脱脂牛奶作保护剂的效果比无保护作用的沙土好。
对比同一菌株保藏180 d和270 d的死亡率,可见随着保藏时间的延长,菌株的死亡率增加,但增加的幅度较小,说明菌株对干燥和低温敏感,在保藏过程中大部分孢子在180 d前死亡。
2.3 保藏方法对菌株典型遗传特性的影响
分别配制含红霉素浓度25 U·mL-1、35 U·mL-1,含乙酸钠浓度10 mg·mL-1、25 mg·mL-1的抗性平板,将保藏270 d的分离纯化株划线接种至相应抗性平板和不含药物的对照平板上,30℃条件下培养10 d,观察菌株的生长情况,结果见表9。

表9 各菌株在药物及对照平板上的生长情况
根据表9中各菌株的生长情况,计算菌株典型遗传特性保持率,结果见表10。

表10 保藏方法对菌株典型遗传特性的影响
分析表10可知,不同保藏方法对同一菌株同一遗传特性的保持率不同。菌株4用冻干法保藏时,红霉素抗性稳定,但用沙土管保藏时,红霉素抗性丢失。菌株H25用冻干法保藏时,红霉素抗性稳定,但用沙土管保藏时,50%的菌株已丢失抗性。由此说明冻干管保藏法能更好地保持菌株的遗传特性。同一菌株同一保藏方法对不同遗传特性的保持能力也不同,2种保藏方法都导致菌株4失去乙酸钠抗性的性状,但红霉素抗性却未完全失去。由此说明乙酸钠抗性比红霉素抗性更不稳定。
2.4 保藏方法对菌株产多杀菌素能力的影响
2.4.1 保藏180 d
保藏180 d,各冻干管、沙土管分离纯化株中斜面生长状况良好的菌株进行摇甁发酵,发酵结束测定p H值,用HPLC法测定发酵液中多杀菌素的含量,结果见表11。比较各菌株与原始菌株的生产多杀菌素的能力,结果见表12。由表11和12可知,冻干管保藏法分离纯化株的产量比较稳定,不同菌株间相对效价差异不明显,平均产量下降率均在85%左右。而沙土管保藏分离纯化株的产量不稳定,不同菌株间相对效价差异明显,产量下降率最高的菌株Y20-180-i及最低的菌株54-180-h均出现在沙土管中。此外,沙土管保藏菌株4-180-c的产量最高,达到131.06 mg·L-1。
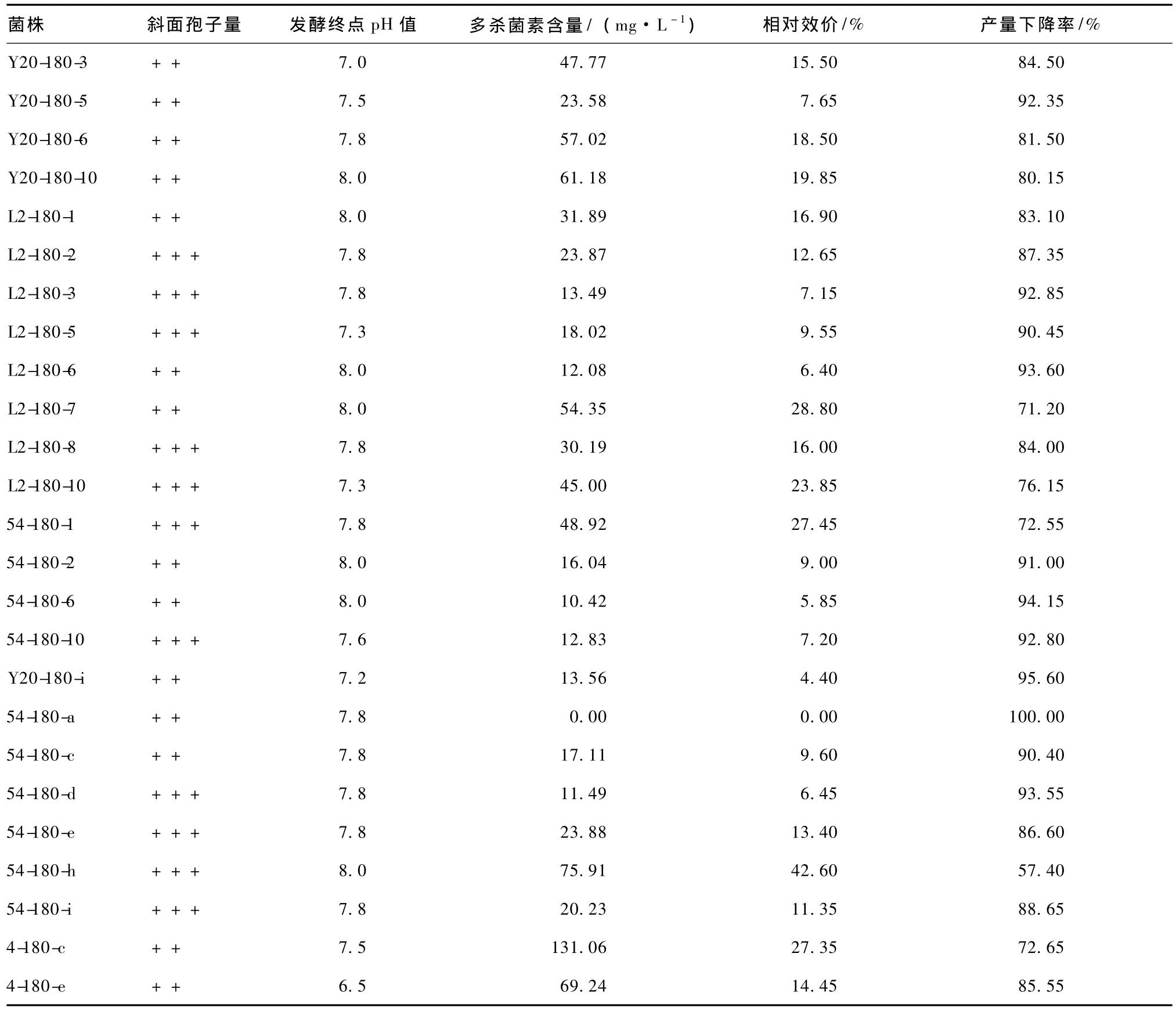
表11 保藏180 d各分离纯化株的发酵结果
表12 保藏180 d各分离纯化株产多杀菌素能力与原始菌株的比较
2.4.2 保藏270 d
保藏270 d,各冻干管、沙土管分离纯化株发酵液中多杀菌素的含量见表13。比较各菌株与原始菌株的生产多杀菌素的能力,结果见表14。对比表12和14可知,随着保藏时间的延长,同一保藏方法同一菌株产多杀菌素的能力不断退化,部分菌株甚至失去产多杀菌素的能力。由表13和14可知,保藏270 d,2种保藏方法对菌株产多杀菌素能力的影响均较严重,但菌株差异明显。菌株H25用冻干管保藏时,产多杀菌素能力已全部丧失,用沙土管保藏时却未丧失。说明不同保藏方法对同一菌株产多杀菌素能力的影响不同。
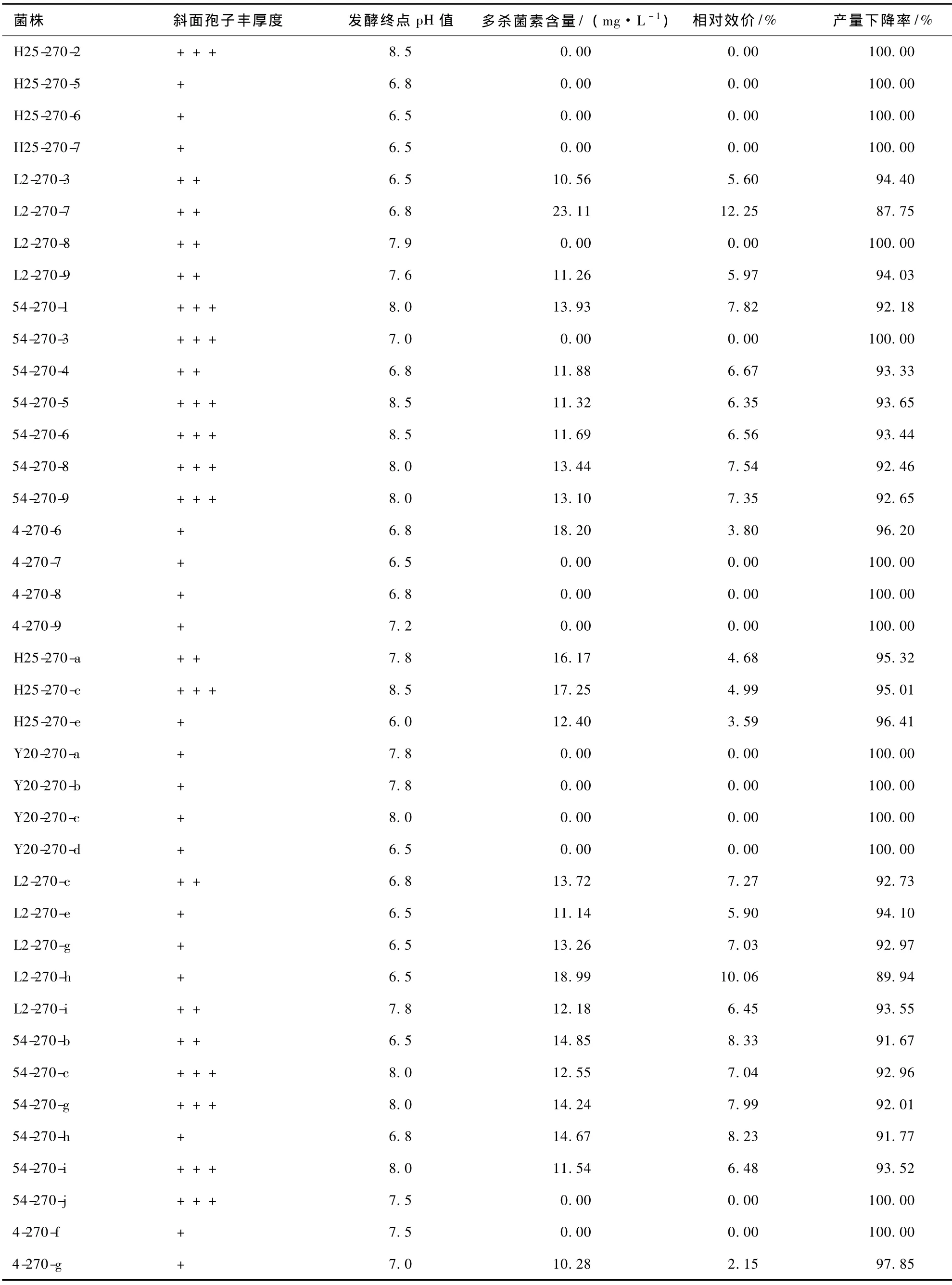
表13 保藏270 d各分离纯化株发酵结果
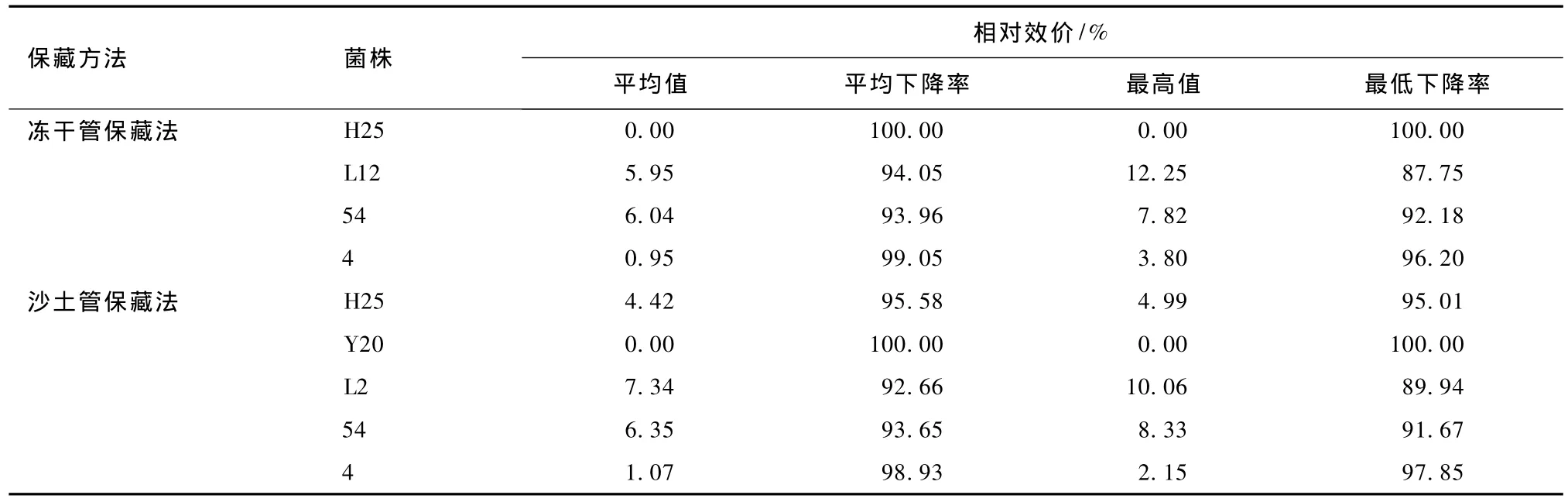
表14 保藏270 d各分离纯化株产多杀菌素能力与原始菌株的比较
3 小结
斜面保藏法操作最简单,保藏30 d,活化菌株生长最旺盛,产孢能力最强;保藏90 d,菌株完全丧失产孢能力。用冻干管和沙土管保藏法保藏270 d,菌株产孢能力、产多杀菌素能力和部分遗传特性仍能保持;但随着保藏时间的延长,部分遗传特性失去,菌株产孢子和产多杀菌素的能力严重下降。与沙土管保藏法相比,冻干管保藏法对菌株产孢子、产多杀菌素的能力以及对其遗传特性的影响较小,死亡率较低,菌种产量较稳定。但产量最高的菌株以及相对效价最高的菌株均出现在沙土管中,2种保藏方法的保藏效果因菌株不同而差异明显。
[1] 高菊芳,亦冰.生物农药的作用、应用与功效:微生物产物农药 [J].世界农药,2001,23(1):1-6.
[2] 黄剑,吴文君.新型杀虫剂的作用机制和选择毒性 [J].贵州大学学报,2004,21(2):163-171.
[3] Salgado V L,Sheets J J,Gerald B,et al.Studies on the mode of action of spinosad:the internal effective concentration and the concentration dependence of neural excitation [J]. Pestic Biochem Physiol,1998,60:103-110.
[4] Musser F R,Shelton M A.The influence of post-exposure temperature on the toxicity of insecticides to Ostrinia nubilalis(Lepidoptera:Crambidae) [J].Pest Manag Sci,2005,61:508-510.
[5] Semiz G,Cetin H,Isik K,et al.Effectiveness of a naturally derived insecticide,spinosad,against the pine processionary moth Thaumetopoea wilkinsoni Tams (Lepidoptera:Thaumetopoeidae)under laboratory conditions [J]. Pest Manag Sci,2006,62:452-455.
[6] Jones T,Scott D C,Harris R,et al.The efficacy of spinosad against the western flower thrips,Frankliniella occidentalis,and its impact on associated biological control agents on greenhouse cucumbers in southern Ontario [J].Pest Manag Sci,2005,61:179-185.
[7] Premachandra D W,Borgemeister C,Poehling H M.Effects of neem and spinosad on Ceratothripoides claratris(Thysanoptera:Thripidae),an important vegetable pest in Thailand,under laboratory and greenhouse conditions [J].J Econ Entomol,2005,98(2):438-448.
[8] Holt K M,Opit G P,Nechols J R,et al.Testing for non-target effects of spinosad on two spotted spider mites and their predator Phytoseiulus persimilis under gre enhouse conditions[J].Exp Appl Acarol,2006,38:141-149.
[9] Cleveland C B,Mayes M A,Cryer S A.An ecological risk assessment for spinosad use on cotton [J].Pest Manag Sci,2001,58:70-84.
[10] Wei Y P,Appel A G,Moar W J.Pyrethroid resistance and cross-resistance in the German cockroach,Blatella germanica(L)[J].Pest Manag Sci,2001,57:1055-1059.
[11] Mota S D,Hollingworth R M,Grafius E J,et al.Resistance and cross-resistance to neonicotinoid insecticides and spinosad in the Colorado potato beetle,Leptinotarsa decemlineata(Say)(Coleoptera:Chrysomelidae)[J].Pest Manag Sci,2006,62:30-37.
[12] 沈萍,陈向东.微生物学实验 [M].北京:高等教育出版社,2008:267-270.
[13] 张苑,金志华,林建平,等.多杀菌素的高效液相色谱[J] .农药,2003,42(10):27-28.
