黄条金刚竹中总黄酮的提取及含量测定
2011-05-30陈少妃徐耀华
丁 明,陈少妃,徐耀华
(浙江农林大学,浙江 临安 313000)
黄条金刚竹 (Pleioblastus kongosanensis f.aureostriaus),混生竹,秆高0.5~1 m,径0.2~0.3 cm。叶片较宽大,绿色,不规则间有黄条纹,是北美箭竹超族北美箭竹族北美箭竹亚族大明竹属大明竹亚属,是大明竹属金刚竹的一个变种。黄条金刚竹是一种观叶竹种,非常美丽,观赏价值高[1-2]。由田中辛南于1972年在名古屋市的守山镇发现,1986年被引进南京林业大学竹种园,国内主要分布于浙江和江苏[3]。
竹子中含有大量的黄酮类化合物和其他生物活性成分,如酚类、蒽醌类、香豆素类内酯、活性多糖、特种氨基酸等,其中黄酮是主要的有效成分并具有显著的生理功能,如抗活性氧自由基、抗脂质过氧化、抗衰老、降低血脂、抗菌抑菌、增强免疫力等,而且竹叶黄酮安全无毒,其安全性大大高于银杏提取物,由此竹叶黄酮类物质的提取纯化及功能作用的研究已成为一个热点[4-6]。目前,国内外对黄条金刚竹中所含黄酮情况尚未报到,经本组研究发现黄条金刚竹中总黄酮含量为0.44%~0.71%,虽比多数竹类总黄酮含量较低,但其具有生长速度快,可反复割采等特点,是一个相当丰富的潜在资源。
本文通过正交试验考察了多种因素对于竹叶黄酮提取效果的影响,对总黄酮提取和含量测定进行研究,旨在为天然黄酮类物质的提取条件的优化提供有益的参数,为黄条金刚竹的开发利用提供技术基础。
1 材料与方法
1.1 材料
竹子样品。分别于2010年6月1日和2010年8月3日采自浙江农林大学校园竹种园;竹子经过如下处理:洗净,烘干,粉碎,过筛 (60目筛),棕色磨口瓶保存备用。
试剂。芦丁对照品 (中国药品生物制品检定所),甲醇、乙醇、AlCl3、Al(NO3)3、NaNO2、CH3COOK、NaOH(均为分析纯),水 (Ⅰ级)。
仪器。CHA-S型恒温振荡器 (国华电器有限公司);PHS-4 A型智能酸度计 (上海虹益仪器仪表有限公司);DK-S22型数显恒温水浴锅 (上海精宏实验设备有限公司);FZ102植物试样粉碎机(齐家务科学仪器厂);60目试样标准筛 (浙江上虞华康化验仪器厂);DF-101 S集热式恒温加热磁力搅拌器 (巩义市予华仪器有限责任公司);SHZC型循环水式多用真空泵 (巩义市予华仪器有限责任公司);DGG-9240A型电热恒温鼓风干燥箱 (上海森信实验仪器有限公司);BS224 S电子天平(赛多利斯科学仪器 (北京)有限公司);T6紫外可见分光光度计 (北京普析通用仪器有限公司)。
1.2 方法
1.2.1 样品的提取
称取干燥粉碎的竹粉2.00 g置于洁净的平底烧瓶中,加人30 mL 70%乙醇溶剂,放置24 h浸泡,然后移至恒温水浴锅浸提;提取条件:水浴恒温,浸提1.5 h,经过2次浸提,将提取液转入250 mL棕色容量瓶中定容,避光保存。
1.2.2 提取物的光谱测定
研究表明[7],竹叶黄酮主要是黄酮糖苷,并以C-甙为主,4种主要的竹叶碳甙黄酮分别是荭草苷、异荭草苷、牡荆苷和异牡荆苷。
提取液的紫外/可见光谱图。移取10 mL竹粉提取液于棕色50 mL容量瓶中,用乙醇补至18 mL,先加5%亚硝酸钠溶液1.2 mL,摇匀,放置10 min;再加10%硝酸铝溶液1.2 mL,摇匀 (溶液无色),放置10 min,加入1 mol·L-1的氢氧化钠8 mL,摇匀,此时溶液呈铜红色。用70%乙醇稀释至刻度,摇匀,放置10 min后。在波长200~800 nm、吸光度-0.020~5.000范围内进行扫描,测其最大吸收波长 (λmax和吸收光度 D),不加显色剂做为对照。其结果见图1所示,该提取物在240~280 nm和300~400 nm下有类似黄酮结构的特征吸收,且加入显色剂后300~400 nm波长下有明显减弱现行,可能为黄酮的酚羟基离解或形成络合物等,导致光谱发生变化。由此我们推断该提取液可能含黄酮类物质。
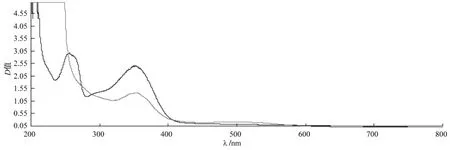
图1 竹子黄酮提取物的紫外/可见光谱
1.2.3 总黄酮的测定
NaNO2-Al(NO3)3显色法:取1 mL样品置于10 mL的比色管中,用70%的乙醇补充至5 mL,加入0.3 mL 5%NaNO2溶液,摇匀,放置5 min后,加入0.3 mL 10%的Al(NO3)3溶液,摇匀,放置6 min后加入2 mL 1 mol·L-1NaOH溶液,并用30%乙醇溶液定容至刻度,摇匀,放置10 min,500 nm波长处分光光度计比色法测定。
1.2.4 标准曲线的绘制
精确称取芦丁对照品0.010 0 g,置于小烧杯中,加70%乙醇溶液溶解后,移入100 mL容量瓶中,用乙醇溶液稀释至刻度,摇匀备用 (浓度为1.000 0 mg·mL-1)。
分取芦丁标准溶液1.00、2.00、3.00、4.00、5.00、6.00 mL分别置于10 mL的比色管中,同时作空白。NaNO2-Al(NO3)3显色法在波长500 nm处测定吸光度。
2 结果与分析
2.1 方法的评价
2.1.1 标准曲线
以吸光度为纵坐标,芦丁浓度为横坐标建立标准曲线,在0.100~0.600 mg·mL-1浓度范围内,线性回归方程为 D=1.098 9 C+0.001 5,R2=0.999 7。
2.1.2 精密度
准确吸取标准样品溶液3.0 mL,同一样品溶液1.0 mL各5份,同标准曲线操作和样品测定的操作,测定吸光度值。结果表明,标准品吸光度值的RSD=0.25%,样品吸光度值的RSD=0.50%,说明精密度良好 (表1)。

表1 各样品的吸光度值
2.1.3 稳定性
准确吸取标准样品溶液3.0 mL,同一样品溶液1.0 mL,同标准曲线操作和样品测定的操作,在0、15、30、45、60、90 min测定其吸光度值,结果 (表2)表明,标准品在90 min内稳定,样品在45 min基本内稳定。
2.1.4 样品加标回收率
准确吸取样品溶液1.0 mL,分别加入芦丁标准品 0.25、0.5、1.0 mL,按实验方法测定吸光度,计算黄酮总量及回收率,结果 (表3)表明,该方法测定的结果比较准确,实验结果见表4。
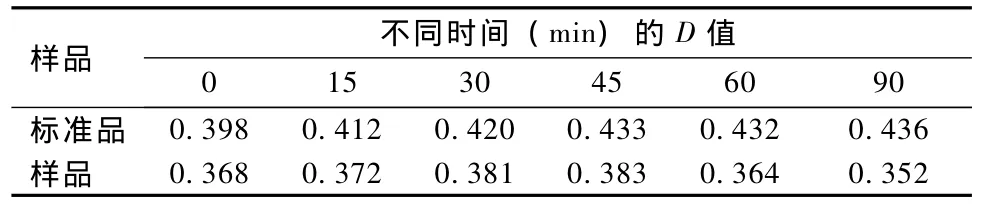
表2 各样品不同时间的吸光度值
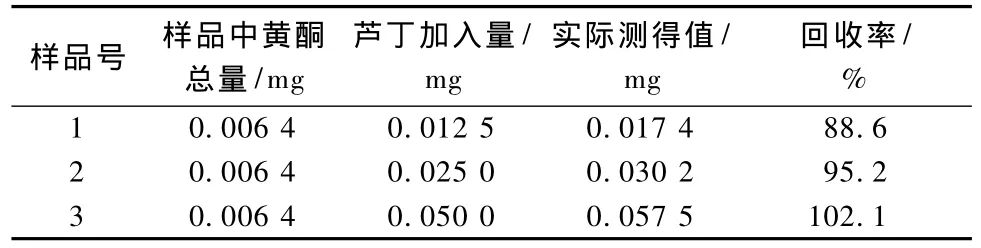
表3 各样品的加标回收率
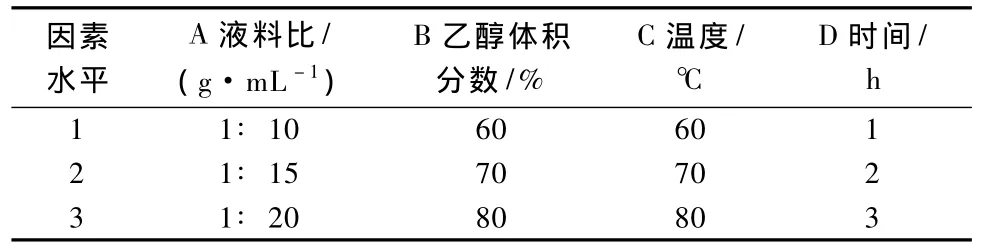
表4 正交试验的因素及水平
2.2 提取条件的选择
2.2.1 取溶剂
据文献报道[8-12],竹叶黄酮一般为黄酮苷元难溶或不溶于水,易溶于醇类、氯仿、乙醚等有机溶剂或碱,根据它的结构特点以及物理和化学性质确定提取溶剂。利用甲醇、50%乙醇、无水乙醇、丙酮、乙酸乙酯等不同溶剂提取 (2.00 g竹粉,30 mL溶剂,提取1 h),结果D值分别为0.490,0.460,0.360,0.300和 0.320。其中甲醇的浸出效果最好,乙醇次之,丙酮和乙酸乙酯较差。这可能与溶剂的分子量小,极性大,容易渗透植物细胞壁等因素有关[13]。对于甲醇和乙醇比较而言,乙醇毒性更小,更安全,价格便宜,也易于回收,因此选用乙醇作浸提溶剂。
2.2.2 提取条件
根据单因素试验结果,选择液料比、乙醇体积分数、提取温度和提取时间等4个因素,分别在各因素最佳条件前后各取1点组成3个水平,以提取物的吸光度为试验指标,进行L9(34)正交试验设计,试验因素水平见表4。
根据表5的值分析可知,最好的试验组合为A2 B2 C3 D1,即最佳提取条件为:液料比1∶15,乙醇体积分数为70%,提取温度为80℃和提取时间为1 h。由极差R值可以看出,对提取效果影响最大的是因素A(液料比),其次是因素B(乙醇体积分数)和因素C(提取温度),最小的是因素D(提取时间)。因此,在进行竹粉黄酮提取时,要对提取液料比和乙醇浓度加以严格控制,同时也要考虑到提取温度和时间。
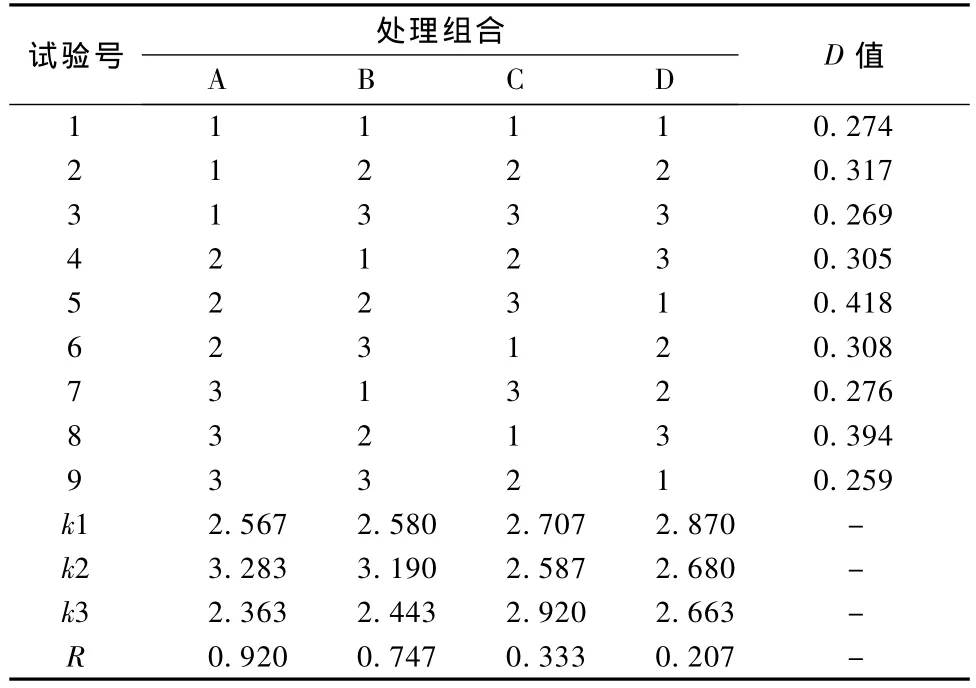
表5 各处理组合的吸光度值
2.3 黄条金刚竹提取物的总黄酮含量
分别采用上述方法对2010年6月1日和2010年8月3日采自浙江农林大学校竹种园同一采样点的黄条金刚竹竹粉样品进行测定。结果如表6所示。竹叶中黄酮总量为 5.9 ~13.1 mg·g-1[14-15]。而我们测定黄条金刚竹竹粉样品含量为4.46~7.19 mg·g-1,由于竹粉样品含较多竹枝条,因此竹粉总黄酮含量比竹叶总黄酮含量略低。此外,从2次间隔2个月的采集样品发现,新生黄条金刚竹竹粉中黄酮含量为6.10 mg·g-1略低与老竹竹粉的6.71%,且8月份黄条金刚竹竹粉总黄酮含量为6.10 mg·g-1,明显高于6月份黄条金刚竹竹粉的4.46%,这与文献报道[15]新生竹叶黄酮含量高的报道不符。我们认为这可能是新生黄条金刚竹竹叶占整竹的比率较小所致。
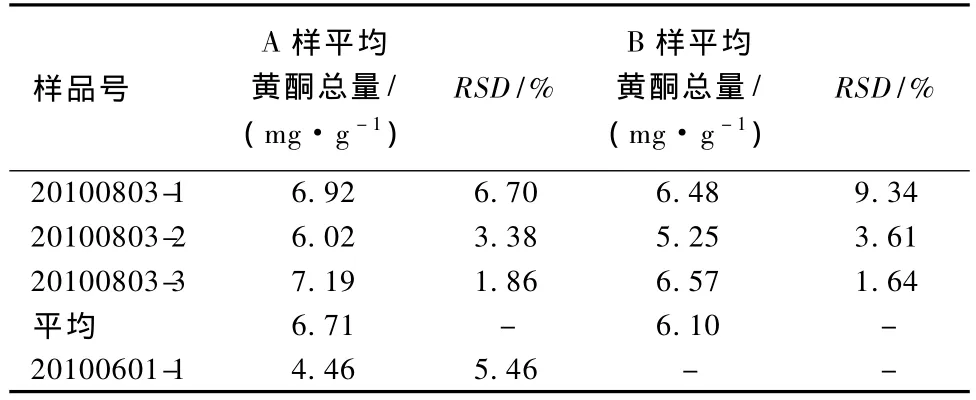
表6 黄条金刚竹竹粉中总黄酮含量
由此可见,黄条金刚竹中具有较高的黄酮含量,由于黄条金刚竹生长速度快,其黄酮资源极具开发利用价值。
3 小结
本实验对黄条金刚竹竹粉中的总黄酮进行了提取条件优化和含量测定,并初步分析黄条金刚竹竹粉中总黄酮含量,为进一步开发和利用黄条金刚竹资源的研究和评价提供了理论依据和检测手段。
[1] 周纯芳.中国观赏竹种简介 [J].竹类研究,1993,7(49):68-87.
[2] 王波,汪奎宏,李琴,等.黄条金刚竹生长规律研究[J].浙江林业科技,2008,28(6):16-19.
[3] 周芳纯,高尚愚.日本竹林生产和利用情况考察报告[J].竹类研究,1984,3(2):5.
[4] 张英.天然功能性添加剂-竹叶提取物 [J].精细与专用化学品,2002,10(7):20-22.
[5] 黄筱雄,蒋元淡,肖毓敏.竹子的综合利用 [J].浙江林业科技,2003,23(4):99-102.
[6] 朱宏莉,韦海洪,宋纪蓉,等.竹叶总黄酮的提取和纯化工艺的研究 [J].食品科学,2005,26(8):158-161.
[7] 李勇,宋慧.竹叶蛋白的分离提取及其副产物的利用[J].食品与发酵工业,2005,31(3):136-138.
[8] 邬建敏.竹叶黄酮化合物总量及芦丁含量的测定 [J].浙江农业大学学报,1998,40:339-343.
[9] 许钢,张虹,胡剑.竹叶中黄酮提取方法的研究 [J].分析化学,2000(7):857-859.
[10] 宋秋烨,陈梅,吴启南.淡竹叶中总黄酮提取工艺研究[J].中国中医药信息杂志,2007,14(3):46-47.
[11] 张英.天然功能性竹叶提取物:竹叶黄酮 [J].中国食品添加剂,2002(3):54-58.
[12] 彭晓春.醇提一酯萃法提取竹叶中的总黄酮 [J].吉首大学学报:自科版,2003,24(2):87-89.
[13] 李坤平,杨国恩,潘天玲,等.正交试验法优化竹叶总黄酮提取工艺研究 [J].广州药学院学报,2004,20(2):102-103.
[14] 冯涛,曹东旭,吕晓玲.竹叶总黄酮含量的测定 [J].中国食品添加剂,2002(6):85-87.
[15] 刘翠,王文久.竹叶资源研究进展及开发利用 [J].林业建设,1999(6):10-14.
