玫瑰红色素的提取方法与工艺学特性研究
2011-05-28张瑞宇
张瑞宇
(重庆工商大学环境与生物工程学院,重庆 400067)
玫瑰花为蔷薇科(Rosaceae)蔷薇属(R.rugosa thunb)多年生灌木—玫瑰的花朵,香浓色艳,堪称世界观赏名花。同时也以多种方式入食入药[1]。而当今,提取自花瓣的玫瑰油早已成为流行全球的高品质香料油[2]。但玫瑰丰富的天然红色素的商业应用却远远落后,近年来,有关玫瑰色素提取与稳定性虽有一些报道,但提取条件很不一致,工艺特性研究不够完善[3-5],不利于生产企业实际应用,影响了玫瑰花资源价值的提升。为此,对玫瑰红色素的提取方法和主要工艺特性进行系统的实验研究,旨在为玫瑰资源的全面高效利用提供基础数据。
1 材料与方法
1.1 材料、试剂与仪器
材料:玫瑰干花瓣购于本地中药材公司,挑选新鲜,色浓味正,均匀一致的作试材。
仪器:岛津UV-2450PC型紫外可见分光光度计;721型分光光度计;Deltu320-s pH计;HH-2恒温水浴锅;电热鼓风干燥箱;电子万用炉;AL104电子天平。
试剂:丙酮、乙醚、乙酸乙酯、正丁醇、乙醇、氯化镁、氯化钙、硫酸亚铁、氯化亚锡、柠檬酸、硫酸锌、过氧化氢、EDTA、异Vc钠,均为分析纯。瓜尔豆胶、PGA、木糖醇、低聚异麦芽糖,丹尼斯克公司提供。苯甲酸钠、山梨酸钾,为食品级。采用去离子水。
1.2 方法
1.2.1 提取剂选择与 λmax的确定
称取8份0.200 g花瓣碎片,分别加入同体积的下述溶剂:常温水、90℃水、0.8%柠檬酸、甲醇、60%乙醇、丙酮、正丁醇、乙醚、乙酸乙酯,32℃搅拌浸提50 min后,选取各溶液中呈色最为鲜明的色素柠檬酸液,定容到50 mL,精密过滤,岛津UV-2450PC型紫外可见分光光度计测定其吸收光谱,确定λmax。
1.2.2 单因子试验
根据玫瑰红色素的溶出特性和多次预试结果,选定柠檬酸液为提取剂,分别对柠檬酸浓度、温度、提取时间和液料比4个主要因子进行研究。浸提完毕立即冷至常温,定容过滤,在λmax下测定其OD值。
1.2.3 正交实验
据单因子实验结果,选择L9(34)正交表和各因素的适当水平进行正交试验,如表1。
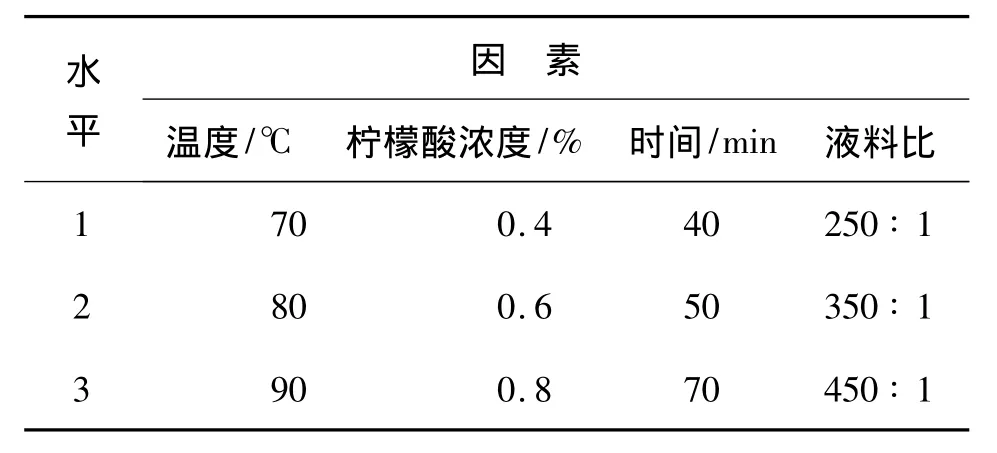
表1 因素水平表
1.2.4 玫瑰红色素工艺学特性研究[7-8]
按优化工艺条件制备玫瑰红色素液,各色素液试样均为50.0 ml。各种添加剂加入后充分搅溶,静置规定时间,在λmax下测定OD值。
(2)对异抗坏血酸钠、苯甲酸钠、山梨酸钾、EDTA-Na的稳定性。将4种物质分别加入色素液,各物质浓度梯度均为 0.001%、0.002 5%、0.005%、0.01%、0.05%、0.1%、0.15%、0.20%。
(3)功能性甜味剂对色素的影响。色素液中分别加入木糖醇、低聚异麦芽糖,设置浓度梯度均为4%、8% 、16% 、20% 、30% 、40% 、50% 。
(4)对 H2O2的稳定性。将 H2O2稀释5 倍,设置添加量梯度为 0.10、0.50、1.0、2.0、3.0、4.0、5.0、6.0(mL).
(5)乳化剂、增稠剂对色素的影响。色素液中分别加入单甘酯、PGA、耐酸CMC和瓜尔豆胶,设置浓度梯度均为 0.01%、0.05%、0.1%、0.15%、0.2%、0.4%、0.6%、0.8%。
(6)对不同光照的稳定性。将全透明容器盛装的色素液分别置于自然强光下和室内散射光中,在58 d中,分次同时取样检测。
2 结果与讨论
2.1 提取剂筛选与波长扫描结果
8种溶剂筛选结果见表1。从表1可知,玫瑰红色素不溶于乙醚、丙酮、正丁醇和乙酸乙酯;中性水溶出能力很差,即使加热也无显效;在甲醇、乙醇中呈现黄色;0.8%柠檬酸水与众不同地呈现出鲜明美丽的玫瑰红色。
色素0.8%柠檬酸提取液的波长扫描图谱见图1。从图1清晰可见,色素液的λmax为518 nm。

图1 色素柠檬酸提取液吸收光谱图

表2 不同溶剂对色素的溶出能力
2.2 单因子实验结果
2.2.1 温度对色素提取的影响
以0.8%柠檬酸作提取剂,液料比250∶1,提取50 min,不同温度下的浸提结果见图2。图2显示,随着温度上升,色素溶出增加,80℃达到峰值,继续升温至100℃,吸光值仍达0.528,表明色素在酸性介质中较为耐热。

图2 不同温度对提取效果的影响
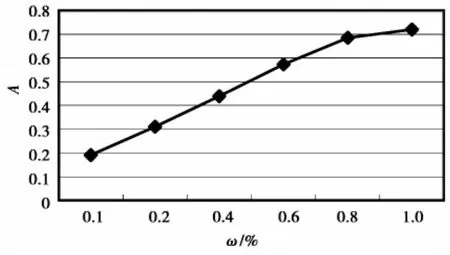
图3 不同柠檬酸浓度对提取效果的影响
2.2.2柠檬酸浓度对色素提取的影响
以不同浓度柠檬酸作提取剂,液料比250∶1,80℃下提取50 min,结果见图3。图3显示,在0.1% ~1.0%的浓度范围内,柠檬酸浓度增加,OD值呈线性增大趋势,但0.8%以后增加已不明显。
2.2.3浸提时间对提取效果的影响
以0.8%柠檬酸作提取剂,液料比250∶1,80℃下提取不同时间,结果见图4。图4表明,浸提时间偏短,色素不能充分溶出;时间偏长,则会因色素长时间受较高温度作用而部分破坏,50~75 min的浸提可以获得较好效果。
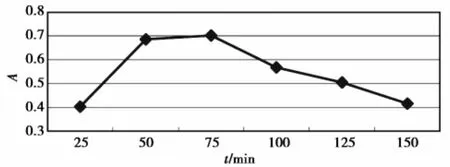
图4 不同时间对色素提取效果的影响

图5 不同提取剂用量对提取效果的影响
2.2.4不同料液比对提取效果的影响
以0.8%柠檬酸作提取剂,80℃下按不同液料比分别提取50 min,结果见图5。图5表明:料液比偏小,影响了部分色素分子向浸提液扩散;而料液比偏大,既不能显著增加色素溶出,同时也不符合工艺经济性原则,液料比在250~450倍范围内可选。
2.3 正交试验结果
正交试验结果见表3。
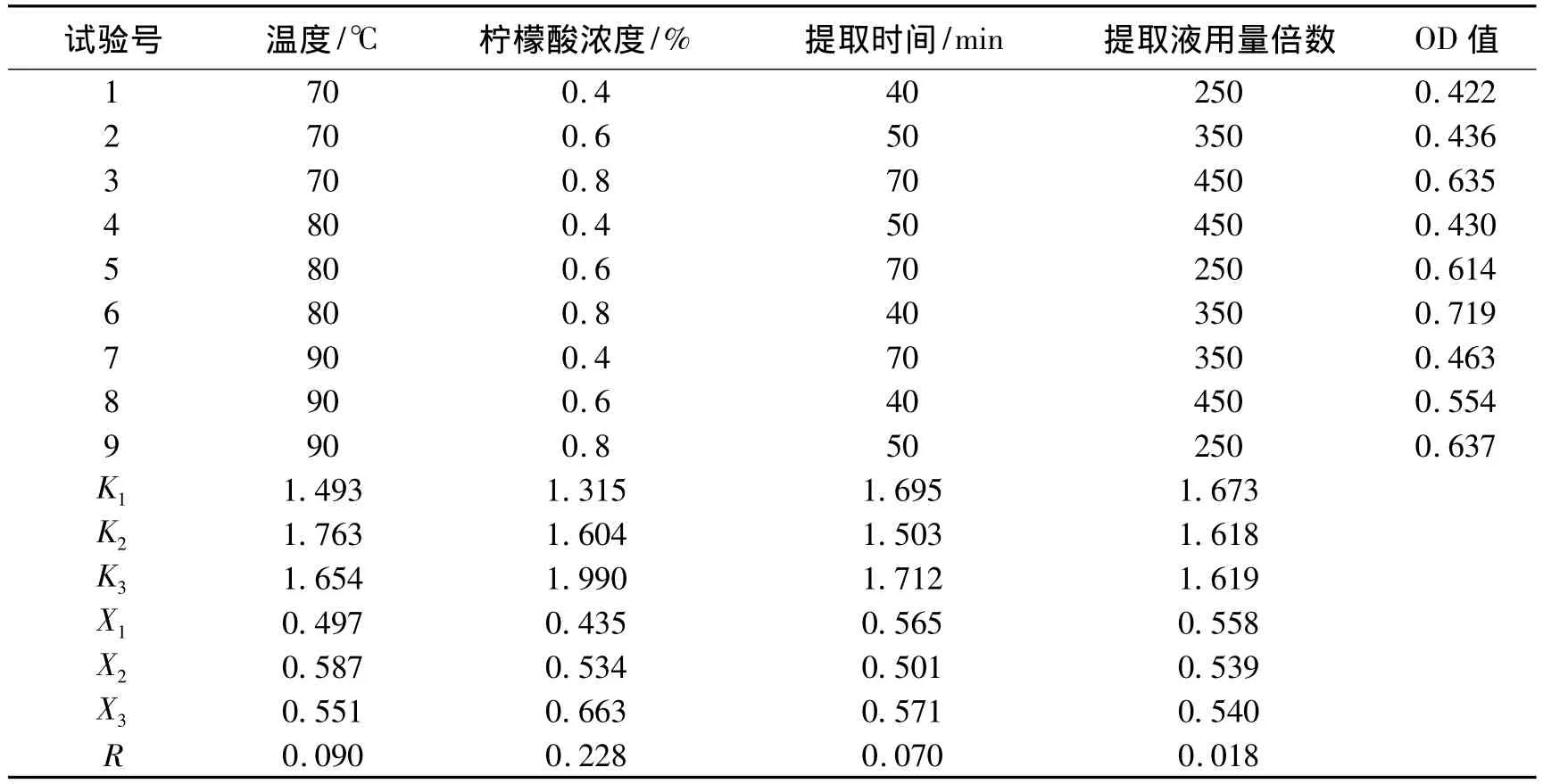
表3 色素提取正交试验结果表
表3可知,在试验条件下,6号提取液色素浓度最大,即按350倍花瓣质量加入0.8%柠檬酸,80℃下提取40 min,提取效果最好。极差分析表明,各因素影响的主次顺序是B>A>C>D,即柠檬酸浓度是影响提取效果的主要因素,方差分析证实了其显著影响,其次是温度、提取时间,液料比影响最小。
2.4 色素工艺学特性研究结果

表4 正交试验结果方差分析
2.4.1 金属离子对色素的影响
不同金属离子对色素的影响见图6。高于0.01%的铁、锡离子加入后,色素液均迅速变色,FeSO4可使溶液呈黑绿色,SnCl2使溶液呈深紫红色,静置后出现沉淀;钙、镁、锌离子对色素的影响不明显,当其浓度超过0.4%后,溶液颜色略有加深,相比之下,钙离子作用稍强。

图6 5种不同浓度金属离子对色素的影响

图7 4种添加剂对色素的影响
2.4.2 异抗坏血酸钠、苯甲酸钠、山梨酸钾、EDTA-Na对色素的影响
4种物质对色素的影响见图7。图7表明,在实验条件下,EDTA-Na对色素无影响;余三种物质浓度超过0.01%后,呈色变浅,山梨酸钾对色素的不利影响略大于苯甲酸钠。
2.4.3 功能性甜味剂对色素的影响
木糖醇、低聚异麦芽糖对色素的影响见图8。图8表明,在实验条件下,30%以下的添加对色素无不利影响。添加量过大,OD值下降,可能与因甜味剂对色素液的稀释作用改变了溶液酸度有关,其它原因尚待进一步研究。
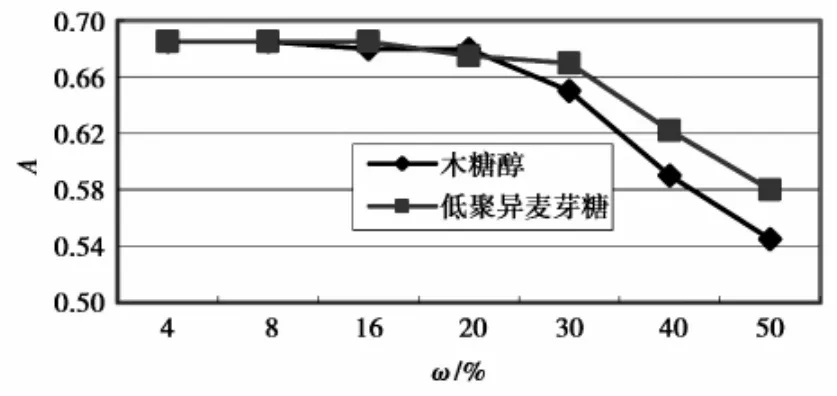
图8 功能性甜味剂对色素的影响
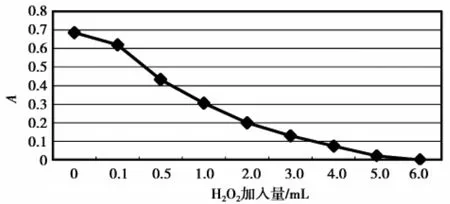
图9 过氧化氢对色素的影响
2.4.4 强氧化剂H2O2对色素的影响
H2O2对色素的影响见图9。图9表明,在实验条件下,随H2O2加入量增加,样液显著褪色,表明色素分子结构被氧化而严重破坏。
2.4.5 几种稳定剂对色素的影响
乳化剂单甘酯不溶于色素提取液;乳化剂PGA、增稠剂耐酸CMC、瓜尔豆胶加入色素液后均可形成均匀的溶胶,并保持原有色调。添加量高于0.1%以后,颜色渐渐变浅。观察至7d时,各试样色泽与稠度稳定不变。
2.4.6 不同光强及光照时间对色素的影响
光照对色素的影响见图10。图10表明,在实验条件下,随着时间推移,色素液吸光值均呈下降趋势。自然强光下,14 d以后下降速度加快,至58 d时,褪色严重;室内散射光下,色素液21 d后褪色加快,但明显缓于直射光引起的色素降解,至58 d时,红色仍明显。
3 结语
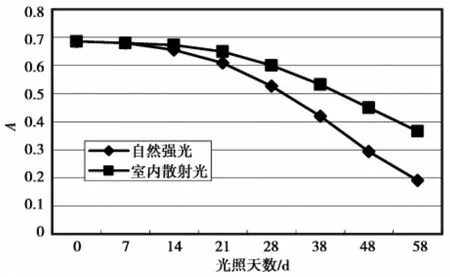
图10 光照条件对色素的影响
柠檬酸液是玫瑰红色素最适合的提取剂,试验中,0.8%柠檬酸80℃下实现高效提取,花瓣几近无色,色素液澄明红亮,可比美于同色调合成色素。提取工艺操作简单,成本低,完全回避了溶剂回收或污染问题,生产企业可直接采用。
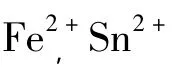
[1]江苏新医学院.中药大词典:上册[M].上海:上海科技出版社,1997
[2]李斌,宣景宏,孟宪军.玫瑰的价值及玫瑰花精油的开发前景[J].北方园,2005(4):58-59
[3]库尔班江·巴拉提.玫瑰花色素的提取及其稳定性研究[J].新疆师范大学学报,2006,25(1):52-55
[4]王喜萍,刘波,姜晓坤.天然玫瑰花红色素的提取及稳定性研究[J].食品与机械,2002(6):25-27
[5]杨万政,陈慧英,李道远.玫瑰花红色素的提取与稳定性研究[J].中央民族大学学报:自然科学版,2003,12(1):64-68
[6]王桃云,万承永,王飞.我国天然植物色素研究与开发初探[J].浙江林业科技,2001,21(2):71-74
[7]章建浩,陈松.食用玫瑰茄红色素的稳定性研究[J].食品科技,2001(1):49-7
[8]张希琴.草莓色素的提取及稳定性研究[J].青岛大学学报,2001,14(1):66-67
