结核分枝杆菌中的泛素样蛋白-蛋白酶体系统研究进展
2011-05-28刘翠华黄红娜王琪郑焙文朱宝利
刘翠华 黄红娜 王琪 郑焙文 朱宝利
(中国科学院微生物研究所 病原微生物与免疫学院重点实验室 北京 100101)
结核分枝杆菌中的泛素样蛋白-蛋白酶体系统研究进展
刘翠华 黄红娜 王琪 郑焙文 朱宝利
(中国科学院微生物研究所 病原微生物与免疫学院重点实验室 北京 100101)
结核分枝杆菌(Mycobacteriu m tuberculosis,Mtb)是引起结核病这一严重威胁全球人类健康的灾难性传染病的病原体。它具有很强的生存能力,可在巨噬细胞中以一种潜伏的状态长期存在;并且其细胞壁厚,抗菌药物难以透过,加之其生长缓慢,抗结核治疗不当易使其产生耐药菌株。近年来由耐药Mtb引起的耐多药结核病(multidrug-resistant TB,MDR-TB)、广泛耐药结核病(extensively drugresistant TB,XDR-TB),以及全耐药结核病(totally drug-resistant TB,TDR-TB)的出现,加之 Mtb与艾滋病病毒双重感染疫情的上升,使得全球结核病防治工作当前面临的形势依然十分严峻[1-2]。与普通的结核病的治疗相比,对这些类型的耐药结核病的治疗更加昂贵和困难,并且其治疗失败率和死亡率也明显增加。因此,寻找新的更有效的抗结核药物作用靶点对于结核病尤其是耐药结核病的治疗已刻不容缓[3-4]。
大量研究表明泛素-蛋白酶体系统(ubiquitinproteasome system,UPS)介导的真核细胞内主要的蛋白质选择性降解途径调控着动植物体内包括细胞增殖、分化、凋亡、DNA复制和修复等几乎所有的生命活动,并参与病原体的入侵、致病和机体的免疫应答等过程[5-7]。许多医药研发机构正在研制以UPS为靶标的治疗癌症、糖尿病、心血管疾病、炎症和退行性疾病等的新型药物。例如,Millennium Pharmaceuticals公司研发的一种蛋白酶体抑制剂Velcade(bortezomib)已获得美国食品与药品管理局的批准,被用于治疗耐药的多发性骨髓瘤[4]。与真核类似的蛋白酶体虽然早就在细菌和古生物中被发现,但在很长时期内,泛素(Ub)和类泛素(ubiquitin-likes,UBLs)却没有成功地在原核生物中被确认,因此人们曾认为它们不存在于原核生物中。直到最近研究者才在结核分枝杆菌中发现了与真核生物中的泛素类似的原核生物泛素样蛋白(prokaryotic ubiquitin-like protein,Pup)[8-9]。研究表明,虽然结核分枝杆菌中的Pup-蛋白酶体系统(Pup-proteasome system,PPS)与真核生物中的UPS存在某些细微的差别,但在整体结构和功能上具有高度的相似性。Mtb中的PPS也主要负责介导蛋白质的选择性降解,并对Mtb的毒力及其引起的宿主免疫应答等过程起重要调控作用[10-12]。因此,基于PPS在Mtb致病过程中的重要作用,加之其与真核UPS之间存在某些差异,使得其可能成为新的抗结核治疗的理想靶标,笔者就PPS的研究进展及其在抗结核治疗药物研发中的价值等作一综述。
1 Pup的结构
Mtb中的Pup是成对的蛋白质,紫外圆二色光谱(CD)和核磁共振光谱(NMR)组合的多样化结构预测证实Pup有64个氨基酸,是一种C-末端区域呈螺旋状的内部结构混乱的蛋白质[13-14]。Pup含有独特的区域与Pupulation酶(Pupulation enzymes)相互作用并引发底物蛋白的蛋白酶体降解,其螺旋状C-末端介导其与底物蛋白质的连接,而其氨基末端则对于其降解功能的发挥是必需的[15]。虽然Pup与真核生物中不同的泛素样蛋白质只享有很低的序列相似性,但其3D结构却显示它具有高度保守的典型泛素样折叠结构。此外,1H-15N NOE(Nuclear Overhauser Effect)数据和CSI(Chemical Shift Index)分析显示Pup的C-末端有1个二维结构的残基,这些特征使得Pup与其他泛素样蛋白超家族得以区分开来[14]。尽管Pup与泛素在序列和对蛋白底物的靶向连接过程等方面存在某些差异,但两者在介导蛋白底物的蛋白酶体靶向降解方面发挥着类似的作用[8-9]。
2 Mtb蛋白酶体的结构
Mtb的蛋白酶体为750 kDa,其结构与真核生物的蛋白酶体相似,也呈桶状结构,包含由α亚基形成的2个7元外环和由β亚基形成的2个7元内环。蛋白水解发生在β亚基N-末端的苏氨酸上。真核生物蛋白酶体含有7种α亚基和7种β亚基,其中只有 3 种β亚基(β1、β2、β5)显示蛋白水解活性。相比较而言,原核生物蛋白酶体则通常包括1种或2种类型的α和β亚基,其中Mtb蛋白酶体的β亚基为单一类型,并且14个β亚基中的每一个均提供1个N末端苏氨酸的活性位点[16]。Mtb蛋白酶体核心颗粒的冷冻电镜技术显示其具有1个闭合的尾部,与负染色电镜技术所显示的密度测定结果是一致的。α-亚基N-末端八倍体的存在进一步提示Mtb蛋白酶体含有1个门控式结构[17]。真核生物蛋白酶体的核心颗粒可通过7个α亚基的不同氨基末端肽关闭其蛋白底物的入口,而Mtb蛋白酶体的晶体结构则提示其核心颗粒的门控是被7个相同的肽通过3种不同的构象紧紧密封的[18]。
3 结核分枝杆菌中的PPS介导的蛋白质降解过程
真核生物中的泛素-蛋白酶体通路介导的底物蛋白的降解主要由底物泛素化和蛋白酶体降解2个步骤组成。在底物泛素化过程中,Ub在ATP供能的条件下依次通过泛素活化酶(E1)、泛素载体蛋白(E2s),以及泛素连接酶(E3s)等的一系列催化步骤而与底物蛋白结合。具多聚泛素链修饰的蛋白质最终被送到由多个亚单位组成的庞大的26S蛋白酶体中降解成小肽段,同时多聚泛素链被去泛素化酶(deubiquitinating enzymes,DUBs)从底物上水解下来并解聚为单个Ub分子而被重新利用[5]。
Mtb中的PPS介导的蛋白质降解过程如图1所示。与真核生物中的泛素化过程类似,Mtb中的Pup通过pupylation反应后使底物蛋白被标记上Pup并随之被蛋白酶体降解[19]。pupylation过程虽然类似于泛素化,但其酶学反应过程与泛素化过程不尽相同。pupylation过程独特的方面主要包括:Pup活化的机制及其与底物的连接过程、Pup与赖氨酸连接有关的反应过程,以及此过程中对蛋白酶体附属因子 A(proteasome accessory factor A,PafA)的依赖性等[15,20]。pupylation过程包括1个独立的脱酰胺作用和1个接合反应,分别通过Pup的脱酰胺酶(deamidase of pup,Dop)和Pup连接酶PafA来催化。与Ub不同的是,Pup侧链末端的谷氨酰胺在连接作用之前首先被Dop脱去酰胺基后变成谷氨酸(此过程需要与ATP的结合但不是其水解作用)[21],然后在PafA的催化下谷氨酸的1个羧基通过异肽键连接到底物赖氨酸上[22]。与底物的赖氨酸相连接的可能是α-羧基也可能是γ-羧基(此过程需要ATP的水解作用)[10]。最后,Mtb蛋白酶体的ATP酶(Mycobacteriumproteasomal ATPase,Mpa)负责将底物运载到蛋白酶体内使其降解[13]。Pup羧基末端的螺旋部分会直接以1∶6的比例与Mpa氨基末端卷曲螺旋区域相互作用[15]。
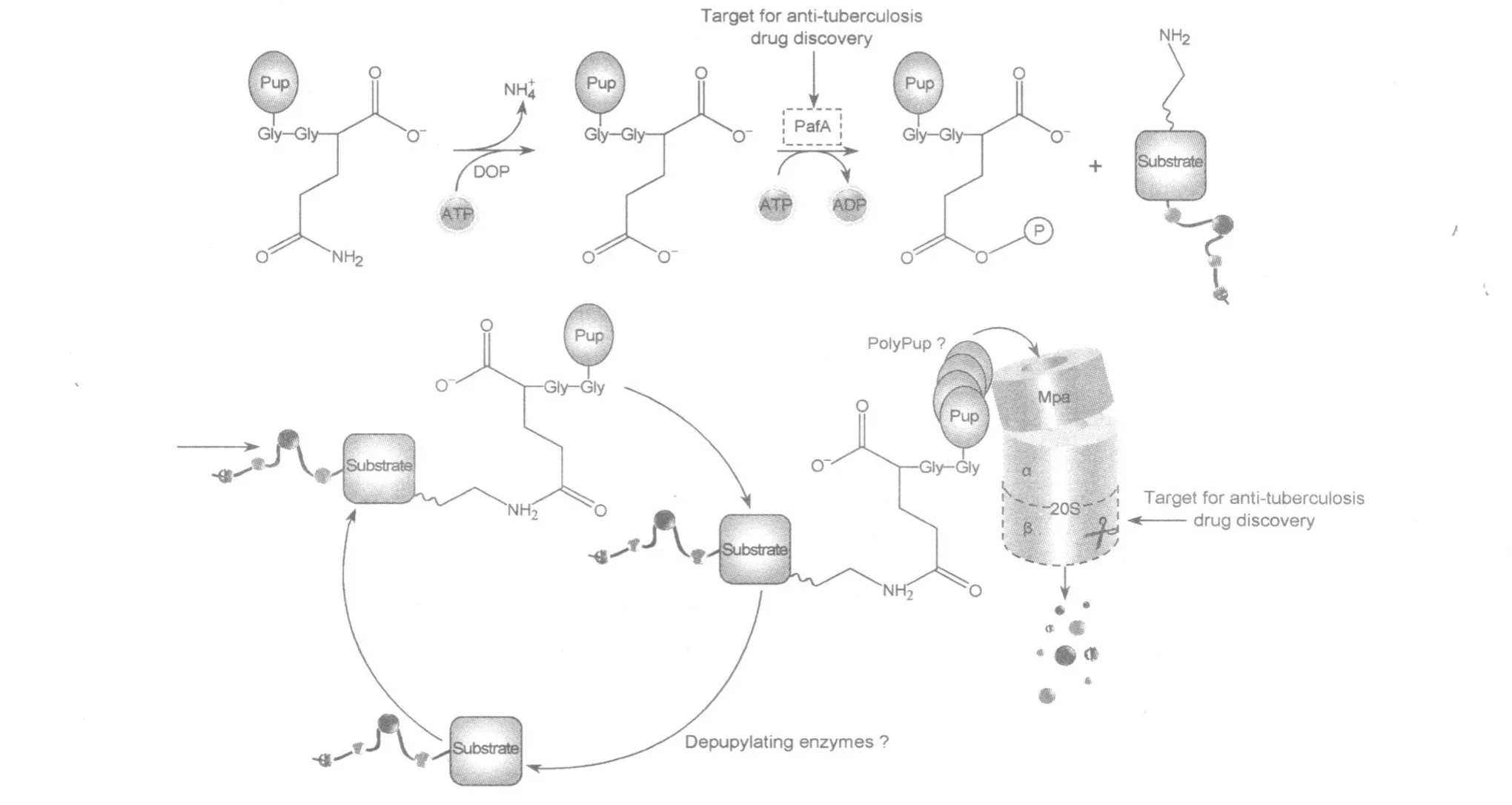
图1 M tb中的PPS介导的蛋白质降解过程

表1 Mtb菌中的PPS与真核生物中的UPS系统的特征比较
真核生物中被鉴定的蛋白酶体底物已不计其数。迄今为止,研究者也已在Mtb中鉴定了至少7个蛋白酶体底物,包括FabD、PanB、Mpa、PhoH2、Icl、MtrA 和 Inol[23]。此外,Pearce等[20]的研究结果表明PafA的突变会导致Mtb中底物蛋白pupylation过程的中断,但Mtb中的PafA与真核生物中的E1、E2s或 E3s都没有同源性,提示PafA的活性与典型的UBLs是不一样的。Imkamp等[24]的研究表明Pup特异性的脱酰胺酶Dop的缺失也可阻断分枝杆菌中底物蛋白的pupylation过程。Cerda-Malra等[22]还进一步发现Dop不仅在Pup的脱酰胺作用中是必需的,而且对于Mtb维持pupylation蛋白质野生型的稳态水平也是必需的。此外,他们的研究还表明Dop与PafA均与Mtb的毒力发挥密切相关。Wang等[25]的研究表明Mtb中的Mpa与真核生物中的调节颗粒ATP酶具有同源性,并参与结合、去折叠,以及递送待降解底物至蛋白酶体中心等过程。Mtb中的PPS与真核生物中的UPS的特征比较结果详见表1[16]。
4 Mtb中的PPS在抗结核治疗药物研发中的应用价值
Mtb中的PPS不仅是Mtb在宿主体内生存和复制必需的,也是非复制阶段持续存留在宿主体内的决定因素[26]。此外,Mtb中的蛋白酶体对于Mtb毒力的发挥也是必需的。例如,Pieters等[27]的研究表明Mtb中的蛋白酶体可以保护微生物免受吞噬溶酶体中产生的氮氧化物及其衍生物的损伤作用。Gandotra等[28]发现Mtb中的蛋白酶体还参与Mtb对小鼠的致病过程。因此,介于Mtb中的PPS在Mtb的生理功能及其致病过程中的重要性,研究者纷纷探寻真核生物 UPS与Mtb中的PPS的差异,并基于两者的差异寻找抗结核药物治疗的靶点。最近已有研究结果表明,与哺乳动物的蛋白酶体相比,分枝杆菌的蛋白酶体表现出不同的底物选择性,这为今后基于分枝杆菌中蛋白酶体的特定活性位点的药物研发打下了重要基础[16]。此外,Mtb中的PPS所特有的翻译后修饰酶PafA也有望成为抗结核治疗的有效靶点[15,20]。
5 今后的研究方向
虽然将Mtb中的PPS作为抗结核治疗的靶点具有良好的应用前景,但仍有很多问题有待进一步深入研究:(1)真核生物中的泛素连接酶有三大类且数量繁多,使得泛素化具有高度选择性和特异性,而在Mtb中的PPS系统中仅发现1种Pup连接酶PafA,因此仍未明确单一的PafA是如何将Mtb中众多的蛋白质底物特异地靶向于蛋白酶体的[8,15];(2)目前尚未明确Pup是否像泛素一样形成聚Pup链后被底物识别;(3)由于目前尚未发现与去泛素酶类似的Pup解离酶,因此仍不清楚Pup在被异肽键连接于底物时,是否会像真核生物的泛素一样被解离下来再循环利用[11];(4)此外,仍不确定是否Pup修饰对于Mtb中蛋白质的蛋白酶体靶向降解是必需的。综上所述,Mtb中PPS的发现开启了以蛋白质降解的调控为特征的抗结核药物研发的大门,随着研究的深入以及上述问题的进一步阐明,以PPS为靶标的抗结核新药的研发将会为结核病包括耐药结核病的治疗提供新的有效途径。
[1]World Health Organization.Anti-tuberculosis drug resistance in the world:fourth global report[R].World Health Organization report 2008.WHO/HTM/TB/2008:394.
[2]Migliori GB,De Iaco G,Besozzi G,Centis R,Cirillo DM.First tuberculosis cases in Italy resistant to all tested drugs[J].Euro Surveill,2007,12(5):E070517.1.
[3]中国防痨协会.耐药结核病化学治疗指南(2009)[J].中国防痨杂志,2010,32(4):181-198.
[4]Cheng Y,Pieters J.Novel proteasome inhibitors as potential drugs to combat tuberculosis[J].J Mol Cell Biol,2010,2(4):173-175.
[5]Goldberg AL.Protein deg radation and protection against misfolded or damaged proteins[J].Nature,2003,426(6968):895-899.
[6]赵天锁,任贺,郝继辉.泛素-蛋白酶体通路的研究进展[J].山东医药,2009,49(32):113-114.
[7]陈建华,汤正好.泛素-蛋白酶体系统与免疫系统的关系[J].国际免疫学杂志,2010,33(4):286-289.
[8]Darwin KH.Prokaryotic ubiquitin-like protein(Pup),proteasomes and pathogenesis[J].Nat Rev Microbiol,2009,7(7):485-491.
[9]Burns KE,Liu WT,Boshoff HI,Dorrestein PC,Barry CE 3rd.Proteasomal protein degradation in My cobacteria is dependent upon a prokary otic ubiquitin-like protein[J].J Biol Chem,2009,284(5):3069-3075.
[10]Kraut DA,Matouschek A.Pup grows up:in vitrocharacterization of the deg radation of pupylated proteins[J].EM BO J,2010,29(7):1163-1164.
[11]Festa RA,M cAllister F,Pearce M J,Mintseris J,Burns K E,Gygi SP,Darwin KH.Prokay rotic ubiquitin-like protein(Pup)proteome ofMycobacterium tuberculosis[corrected][J].PLoS One,2010,5(1):e8589.
[12]Cerda-Maira F,Darwin K H.T heMycobacterium tuberculosisproteasome:more than just a barrel-shaped protease[J].Microbes Infect,2009,11(14/15):1150-1155.
[13]Sutter M,Striebel F,Damberger FF,Allain FH,Weber-Ban E.A distinct structural region of the prokaryotic ubiquitin-like protein(Pup)is recognized by the N-terminal domain of the proteasomal A TPase M pa[J].FEBS Lett,2009,583(19):3151-3157.
[14]Liao S,Shang Q,Zhang X,Zhang J,Xu C,Tu X.Pup,a prokary otic ubiquitin-like protein,is an intrinsically disordered protein[J].Biochem J,2009,422(2):207-215.
[15]Burns KE,Pearce M J,Darwin KH.Prokaryotic ubiquitin-like protein provides a two-part degron to Mycobacterium proteasome substrates[J].J Bacteriol,2010,192(11):2933-2935.
[16]Lin G,Tsu C,Dick L,Zhou XK,Nathan C.Distinct specificities ofMycobacterium tuberculosisand mammalian proteasomes for N-acetyl tripeptide substrates[J].J Biol Chem,2008,283(49):34423-34431.
[17]Hu G,Lin G,Wang M,Dick L,Xu RM,Nathan C,Li H.Structure of theMycobacterium tuberculosisproteasome and mechanism of inhibition by a peptidyl boronate[J].Mol Microbiol,2006,59(5):1417-1428.
[18]Li D,Li H,Wang T,Pan H,Lin G,Li H.Structural basis for the assembly and gate closure mechanisms of theMycobacterium tuberculosis20S proteasome[J].EMBO J,2010,29(12):2037-2047.
[19]Mukherjee S,Orth K.Micrabiology.A protein pupylation paradigm[J].Science,2008,322(5904):1062-1063.
[20]Pearce MJ,Mintseris J,Ferreyra J,Gygi SP,Darwin KM.Ubiquitin-like protein involved in the proteasome pathway ofMycobacterium tuberculosis[J].Science,2008,322(14):1104-1107.
[21]Striebel F,Imkamp F,Sutter M,Steiner M,Mamedov A,Weber-Ban E.Bacterial ubiquitin-like modifier Pup is deamidated and conjugated to substrates by distinct but homologous enzymes[J].Nat Struct Mol Biol,2009,16(6):647-651.
[22]Cerda-Maira FA,Pearce MJ,Fuortes M,Bishai WR,Hubbard SR,Darwin KH.Molecular analysis of the prokaryotic ubiquitin-like protein(Pup)conjugation pathway inMycobacterium tuberculosis[J].MolMicrobiol,2010,77(5):1123-1135.
[23]Pearce M J,Arora P,Festa RA,Butler-Wu SM,Gokhale RS,Darwin KH.Identification of substrates of theMycobacterium tuberculosisproteasome[J].EMBO J,2006,25(22):5423-5432.
[24]Imkamp F,Rosenberger T,Striebel F,Keller PM,Amstutz B,Sander P,Weber-Ban E.Deletion of dop in Mycobacterium smegmatis abolishes pupy lation of protein substratesin vivo[J].Mol Microbiol,2010,75(3):744-754.
[25]Wang T,Li H,Lin G,T ang C,Li D,Nathan C,Darwin K H,Li H.Structural insights on theMycobacterium tuberc ulosisproteasomal ATPase Mpa[J].Structure,2009,17(10):1377-1385.
[26]Salgame P.PUPylation provides the punch asMycobacterium tuberculosisbattles the host macrophage[J].Cell Host Microbe,2008,4(5):415-416.
[27]Pieters J,Ploegh H.Microbiology.Chemical warfare and mycobacterialdefense[J].Science,2003,302(5652):1900-1902.
[28]Gandotra S,Schnappinger D,Monteleone M,Hillen W,Ehrt S.In vivogene silencing identifies theMycobacterium tuberculosisproteasome as essential fo r the bacteria to persist in mice[J].Nat Med,2007,13(12):1515-1520.
刘翠华(liucuihua@im.ac.cn)
国家自然科学基金青年科学基金(30700975);中国科学院知识创新项目(KSCX2-EW-J-6和KSCX2-YW-R-164)
2010-10-13)
(本文编辑:郭萌 薛爱华)
