藏药八味秦皮丸中秦皮甲素、秦皮乙素和麝香酮的定量测定
2011-05-26张苏阳陈佳正李晓英韩泳平
张苏阳, 陈佳正, 李晓英, 韩泳平
(西南民族大学少数民族药物研究所,四川成都 610041)
八味秦皮丸由秦皮、针铁矿、草莓、多刺绿绒蒿、寒水石(制)、美丽风毛菊、朱砂、麝香等组成,为藏药常用处方,具有接骨、消炎、止痛的功效,用于骨折、骨髓炎[1]。其现行质量标准中仅有理化和薄层鉴别,缺乏指标性成分的定量测定,难以有效地综合评价其内在质量。秦皮为本方中主药,现代研究证明,秦皮中的主要有效成分秦皮甲素和秦皮乙素[2-4]具有明显的抗炎镇痛作用[5]。麝香对非特异性炎症亦具有显著抗炎效果[6-8]。本实验以方中主药秦皮中的秦皮甲素和秦皮乙素以及麝香中的麝香酮为指标成分,分别建立基于HPLC和GC的定量测定法,以控制制剂质量,取得了较为满意的结果。
1 仪器与试药
Waters 2695型高效液相色谱仪,2996 PDA检测器;Agilent 7890A气相色谱仪,氢火焰离子化检测器(FID);METTLER TOLEDO AE240电子分析天平[梅特勒-托利多仪器(上海)有限公司];KQ-250B型超声波清洗器(昆山市超声仪器有限公司)。
八味秦皮丸(自制,0.25 g每丸),秦皮甲素对照品(购于中国药品生物制品检定所 批号0740-200104,供定量测定用),秦皮乙素对照品(购于中国药品生物制品检定所 批号110741-200506,供定量测定用),麝香酮对照品(购于中国药品生物制品检定所 批号110719-200511,供定量测定用)。甲醇和乙醇为色谱纯,水为重蒸水,其余试剂均为分析纯。
2 方法与结果
2.1 色谱条件
HPLC条件:色谱柱为依利特C18柱(4.6 mm×250 mm);流动相甲醇-0.1%磷酸溶液(27∶73);体积流量1.0 mL/min;柱温 室温;检测波长344.4 nm。
GC条件:采用HP-5毛细管柱(5%-二苯基聚硅氧烷共聚物色谱柱)30 m ×0.25 mm ×0.25 μm;载气为氮气(99.99%);检测器温度为250℃;进样口温度为220℃;分流比为40∶1;程序升温150℃开始以10℃/min速度升温至170℃保持4 min,然后以15℃/min速度升温至230℃保持5 min。
2.2 溶液的制备
2.2.1 对照品溶液的制备 精密称取秦皮甲素对照品10.01 mg、秦皮乙素对照品10.02 mg,置50 mL量瓶中,分别加甲醇溶解并稀释至刻度,摇匀。精密量取秦皮甲素5 mL、秦皮乙素3 mL,置10 mL量瓶中,加甲醇至刻度,摇匀,即得秦皮甲素和秦皮乙素的混合对照品溶液[9](含秦皮甲素0.100 1 mg/mL,秦皮乙素60.1 μg/mL)。精密称取麝香酮对照品15.20 mg置于100 mL量瓶中,加无水乙醇溶解并稀释至刻度,摇匀,即得麝香酮对照品溶液(0.152 0 mg/mL)。
2.2.2 样品溶液的制备 精密称取本品1.25 g,置50 mL蒸馏瓶中,精密加入甲醇25 mL,密塞,称定质量,水浴上加热回流0.5 h,放冷,称定质量,用甲醇补足减失的质量,摇匀,滤过,取续滤液作为HPLC测定样品溶液。精密称取本品5.04 g,加入无水乙醇15 mL,密塞,振摇,放置1h,滤过,取续滤液作为GC测定样品溶液。
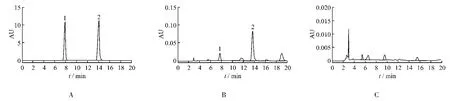
图1 HPLC色谱图A.秦皮甲素和秦皮乙素混合对照品 B.样品 C.缺秦皮阴性样品 1.秦皮甲素 2.秦皮乙素Fig.1 HPLC chromatogramsA.reference substances of aesculin and aesculetin B.sample C.negative sample without Fraxini Cortex 1.aesculin 2.aesuletin
2.2.3 阴性对照溶液的制备 取缺秦皮阴性样品1.25 g,按照HPLC测定样品溶液的制备方法制备缺秦皮的阴性溶液。取缺麝香阴性样品5.23 g,按照GC测定样品溶液的制备方法制备缺麝香的阴性溶液。
2.3 系统适应性实验
按2.2项下操作,分别取秦皮甲素和秦皮乙素混合对照品溶液、样品溶液及阴性对照溶液各10 μL,注入液相色谱仪,按色谱条件进行分析,结果在与对照品峰保留时间一致的位置上,样品溶液的秦皮甲素和秦皮乙素峰峰形良好,理论板数按秦皮乙素计算不低于5 000,秦皮甲素和秦皮乙素与相邻峰的分离度均大于1.5,阴性对照无干扰峰。色谱图见图1。
按2.2项下操作,分别取麝香酮对照品溶液、样品溶液及阴性对照溶液各1 μL,注入气相色谱仪,按色谱条件进行分析,结果在与对照品峰保留时间一致的位置上,样品溶液的麝香酮峰峰形良好,理论板数以麝香酮峰计不低于3 000,与相邻组分能够达到完全分离,阴性对照无干扰峰。色谱图见图2。
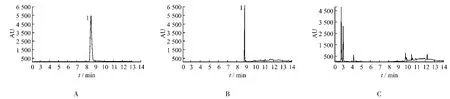
图2 GC色谱图A.麝香酮对照品 B.样品 C.缺麝香酮阴性样品 1.麝香酮Fig.2 GC chromatogramsA.reference substance of muscone B.sample C.negative sample without moschus 1.muscone
2.4 线性关系考察
按2.2.1项下操作,精密量取秦皮甲素和秦皮乙素的混合对照品溶液 2、4、6、8、15、25 μL 注入高效液相色谱仪,记录色谱图。
按2.2.1项下操作,精密量取麝香酮对照品溶液1、2、4、6、10 mL 分别置于 10 mL 量瓶中,加无水乙醇稀释至刻度,摇匀,分别取1 μL注入气相色谱仪,记录色谱图。
分别以峰面积为纵坐标,进样体积为横坐标,将峰面积与进样体积进行线性回归,得各组分的回归方程,见表1。结果表明该方法在较大范围内线性关系良好。
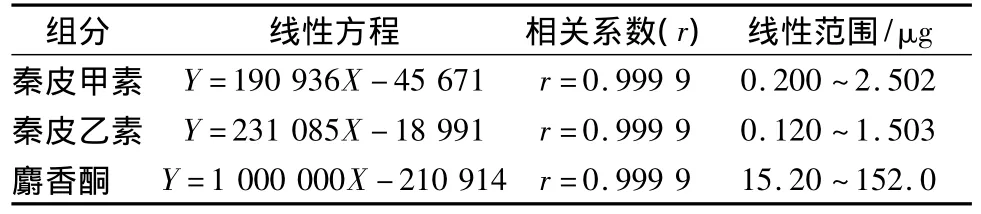
表1 线性关系考察Tab.1 Linear correlation
2.5 精密度试验
按2.2.1项下操作,精密量取秦皮甲素和秦皮乙素混合对照品溶液10 μL,重复进样5次,测得秦皮甲素峰面积的RSD为0.80%,秦皮乙素峰面积的RSD为0.47%。结果表明精密度良好。
按2.2.1项下操作,精密量取麝香酮对照品溶液1 μL,重复进样5次,测得麝香酮峰面积的RSD为0.68%。结果表明精密度良好。
2.6 重复性试验
取同一批样品,精密称取5份,按2.2.2项下方法制备样品溶液,分别在高效液相色谱仪上进样10 μL,记录峰面积,计算质量分数。结果秦皮甲素的平均质量分数为0.399 3 mg/g,RSD 为0.86%;秦皮乙素的平均质量分数为0.972 1 mg/g,RSD为1.21%,表明重现性良好。
取同一批样品,精密称取5份,按2.2.2项下方法制备样品溶液,分别在气相色谱仪上进样1 μL,记录峰面积,计算质量分数。结果麝香酮的平均质量分数为 95.837 4 μg/g,RSD 为 0.93%,表明重复性良好。
2.7 稳定性试验
取样品溶液,室温放置,分别在 0、2、4、8、12 h取样10 μL在高效液相色谱仪上进样,记录色谱图中秦皮甲素和秦皮乙素峰面积,计算其RSD分别为0.55%、0.30%。结果表明样品溶液在12 h内稳定,满足测定要求。
取样品溶液,室温放置,分别在 0、2、4、8、12 h取样1 μL在气相色谱仪上进样,记录色谱图中麝香酮峰面积,计算其RSD为0.84%。结果表明样品溶液在12 h内稳定,满足测定要求。
2.8 加样回收试验
精密称取已测定秦皮甲素和秦皮乙素量的样品约0.5 g,6份,分为3组分别精密加入对照品溶液秦皮甲素(0.201 6 mg/mL)+秦皮乙素(0.204 8 mg/mL)0.8 mL+2 mL、1 mL+1.5 mL、1.2 mL+3 mL,按上述样品制备方法和色谱条件,制备加样回收样品溶液并注入高效液相色谱仪进行测定分析,计算回收率。结果见表2。
精密称取已测定麝香酮量的样品约2 g,6份,每两份各分别精密加入麝香酮对照品溶液(0.152 0 mg/mL)1 mL、1.3 mL、1.5 mL,按上述样品制备方法和色谱条件,制备加样回收样品溶液并注入气相色谱仪进行测定分析,计算回收率。结果见表2。
2.9 样品测定
取3批次样品,按上述制备和测定方法进行进样测定,每份平行测定3次,按标准曲线法分别计算秦皮甲素、秦皮乙素以及麝香酮的质量分数,结果见表3。
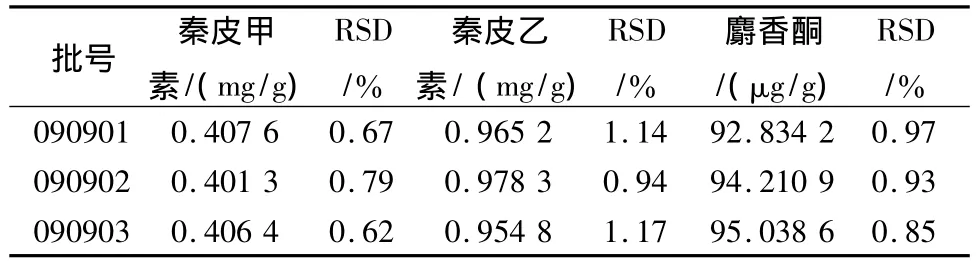
表3 样品测定结果(n=3)Tab.3 Determination result of samples(n=3)
3 讨论
曾参照文献[10]选用甲醇-水作为秦皮甲素和秦皮乙素HPLC测定法流动相,但秦皮甲素有杂质峰干扰且秦皮乙素有拖尾现象,故选用文中流动相,能得到较理想的分离效果。对秦皮甲素和秦皮乙素对照品溶液进行光谱扫描,秦皮甲素的最大吸收波长在334 nm处,秦皮乙素在344.4 nm处。综合考虑发现在344.4 nm处秦皮甲素和秦皮乙素的峰形均较好且无干扰,故选取344.4 nm作为检测波长。
麝香酮是麝香的主要活性成分之一,在参考文献[11-13]方法的基础上,选用文中GC条件对麝香酮进行测定,结果较为理想。《中国药典》一部“麝香”项下药材所指为天然麝香且规定含麝香酮不能低于2.0%。本制剂中所用麝香为人工麝香,经测定,其质量分数均值为2.3%,符合药典要求。
实验结果表明,HPLC法同时测定八味秦皮丸中秦皮甲素和秦皮乙素以及GC法测定八味秦皮丸中麝香酮的方法简便、准确、重现性良好,能够为本品的质量控制提供方法学基础。
[1]中华人民共和国卫生部药品标准[S].藏药第一册.1995:241.
[2]肖培根.新编中药志[M].北京:化学工业出版社,2002:633-642.
[3]刘丽梅,陈 琳,王瑞海,等.秦皮化学成分的研究[J].中草药,2001,32(12):1073-1074.
[4]刘丽梅,王瑞海,陈 琳,等.秦皮化学成分的研究[J].中草药,2003,34(10):889-890.
[5]方莲花,吕 扬,杜冠华.秦皮的药理作用研究进展[J].中国中药杂志,2008,33(23):2732-2736.
[6]朱秀媛,徐桂芳,程雨时,等.麝香的药理研究Ⅱ.麝香及其有效成分的抗炎作用[J].药学学报,1988,23(6):406-410.
[7]孙 荣,王任卿,于 晓,等.麝香的化学与药理研究进展[J].齐鲁药事,2005,24(5):296-297.
[8]柳雪枚,李虹奇,肖 宣,等.天然麝香抗炎蛋白质的研究I.Mu-a-1的分离纯化及其部分性质的鉴定[J].动物学报,1992,38(3):302-308.
[9]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:254.
[10]季 申,王 柯.HPLC法测定秦皮中秦皮甲素、秦皮乙素的含量[J].中成药,1997,19(10):40-41.
[11]冉 萍,喻 强,罗 佳.气相色谱法测定小儿醒脑片中麝香酮的含量[J].儿科药学杂志,2005,11(2):52-53.
[12]唐洪梅,黄樱华,李得堂,等.气相色谱法测定人工麝香中麝香酮的含量[J].中国实验方剂学杂志,2007,13(9):4-5.
[13]周 锐,王 辉.气相色谱法测定麝香祛痛搽剂中麝香酮的研究[J].时珍国医国药,2010,21(7):1813-1814.
