盐制对杜仲化学成分含量变化的影响
2011-05-26刘可鑫刘攀峰张萌萌
刘可鑫, 周 翎, 刘攀峰, 张萌萌, 曹 洋, 许 枬*
(1.辽宁中医药大学,辽宁 大连 116600;2.大连海港医院,辽宁 大连 116012;3.抚顺市农业特产学校,辽宁抚顺 113123)
杜仲为杜仲科杜仲属植物杜仲Eucommia ulmoides Oliv.的干燥树皮,是我国名贵滋补药材[1],临床以炮制应用为主[2]。杜仲的历代炮制方法有盐制、姜制、蜜制等,现以盐制为主[3],根据“入盐走肾”的炮制理论,认为其盐制的炮制作用是增强补肝肾,强筋骨的功效[3]。由于杜仲炮制历来以“断丝”为度[4],有人提出切制也可断丝,没有必要盐制的看法,也有人一味追求“断丝”,甚至将杜仲炮制成杜仲炭(断丝完全)。显然“断丝”的本质已经成为杜仲盐制必须解决的重要问题。因此,有必要深入研究杜仲盐制“断丝”所引起的化学变化,为其炮制原理研究奠定基础。
我们的前期研究发现,杜仲在不同的温度条件下盐制,化学成分变化显著[5]:盐制后(温度超过140℃),杜仲中环烯醚萜类成分含量显著减少的同时,炮制品薄层色谱中,在与生品相同的位置上,Rf值约0.6的粉色斑点和Rf值约0.8的黄绿色斑点含量明显增加。据此可以说明,盐制后杜仲中有些化学成分的含量增加。分析上述情况,我们认为炮制温度所产生的盐制杜仲化学成分的差异可能会造成其疗效的迥异。为深入探讨盐制“断丝”的物质基础,本实验在前期研究的基础上,系统地分离了盐制后杜仲的增加成分,并结合色谱分析揭示盐制前后杜仲化学成分的变化,为杜仲的盐制工艺研究和炮制品质量标准研究提供科学依据。
1 仪器与试药
1.1 仪器 上海沪南科学仪器联营厂2022A型数显电热恒温干燥箱;核磁共振谱用Burker Avance 600型核磁共振光谱仪;Angilent 1100 series高效液相色谱仪(美国安捷伦公司);柱层析与薄层层析用硅胶均为青岛海洋化工厂产品。
1.2 药材 杜仲药材购自北京同仁堂,产地贵州。经辽宁中医药大学中药鉴定教研室王冰教授鉴定为杜仲科植物杜仲Eucommia ulmoidesOliv.的干燥树皮。
2 杜仲炮制后增量成分的分离
2.1 提取与分离 为更好地控制炮制温度,本实验取生杜仲丝,以2%盐水润透,平铺在不锈钢方盘内,放入烘箱,60℃烘干。再将上述处理好的杜仲丝在160℃加热至断丝,制成盐制杜仲。
取上述制成的盐杜仲10 kg,粉碎,用95%乙醇渗漉提取1周,提取液回收乙醇,浓缩,得浸膏1 100 g。取所得浸膏800 g,加水制成混悬液,分别用氯仿、乙酸乙酯、正丁醇依次萃取。采用薄层色谱检查,结果表明,炮制后的增加成分主要集中在氯仿萃取物中,因此对氯仿萃取物进行分离。取氯仿层浸膏416.8 g,用甲醇溶解,按样品与硅胶1:1.5的比例,取600 g硅胶拌样,挥干溶剂待用。以样品与硅胶1:2.5的比例,湿法装硅胶柱,硅胶用量为1 000 g。将样品干法上于硅胶柱顶端,以石油醚-丙酮(100:1,50:1,20:1,10:1,5:1,2:1,1:1)为洗脱剂,进行梯度洗脱。每300 mL为一个流分,收集洗脱成分。采用薄层色谱法,将各流份与生杜仲丝、盐制杜仲进行对照分析,跟踪检查炮制后含量增加的成分,发现石油醚-丙酮(10:1)部分的Fr.7含有炮制后含量增加的黄绿色斑点,采用相同的分析方法确定石油醚-丙酮(10:1)部分的Fr.8含有炮制后含量增加的粉红色斑点。将Fr.7经反复硅胶柱层析,再经Sephadex LH-20柱层析纯化,得到化合物1。将Fr.8采用硅胶柱层析,以石油醚-乙酸乙酯(2:1→1:1)进行梯度洗脱,其中石油醚-乙酸乙酯(2:1)洗脱的流份,经HPLC制备,得到化合物2和化合物3;石油醚-乙酸乙酯(1:1)洗脱的流份,经HPLC制备,得到化合物4和化合物5。
2.2 结构鉴定
化合物1:淡黄色油状物,三氯化铁试剂显铁红色,5%香草醛浓硫酸试剂显灰绿色。1H-NMR(600 MHz,CD3OD-d4)δ:9.51(1H,d,J=7.8 Hz,CHO),7.50(1H,d,J=15.6 Hz,H-7),7.10(1H,dd,J=1.8,8.14 Hz,H-6),7.18(1H,d,J=1.8 Hz,H-2),6.81(1H,d,J=8.1 Hz,H-5),6.60(1H,dd,J=7.8,15.6 Hz,H-8),3.85(3H,s,OMe)。13C-NMR(150 MHz,CD3OD-d4)δ:126.1(C-1),110.6(C-2),150.2(C-3),148.0(C-4),125.2(C-5),123.8(C-6),154.8(C-7),115.2(C-8),194.8(CHO),55.0(OMe)。上述光谱数据与文献[6]报道的阿魏醛基本一致,故鉴定化合物1为阿魏醛。
化合物2:白色针状结晶,5%香草醛浓硫酸试剂显紫红色。1H-NMR(600 MHz,CD3OD-d4)δ:6.93(1H,d,J=1.8 Hz,H-2′),6.78(1H,d,J=1.8,8.4 Hz,H-6″),6.75(1H,d,J=8.1 Hz,H-5′),3.10(2H,m,H-1,5),4.67(2H,J=4.2 Hz,d,H-2,6),4.20(4H,m,H-4,8),3.83(3H,s,OMe)。13C-NMR(150 MHz,CD3OD-d4)δ:53.9(C-1,5),71.1(C-4,8),86.0(C-2,6),132.3(C-1′,1″),109.5(C-2′,2″),147.6(C-3′,3″),145.8(C-4′,4″),114.6(C-5′,5″),118.6(C-6′,6″),54.9(OMe)。上述光谱数据与文献[7]报道的松脂素数据基本一致,故鉴定化合物2为松脂素。
化合物3:白色针状结晶,5%香草醛浓硫酸试剂显紫红色。1H-NMR(600 MHz,CD3OD-d4)δ:6.75~6.94(6H,m,arom),4.40(1H,d,J=7.2 Hz,H-6),4.84(1H,d,J=6 Hz,H-2),3.84(3H,s,OMe)。13C-NMR(150 MHz,CD3OD-d4)δ:54.3(C-1),49.9(C-5),69.2(C-4),70.5(C-8),88.0(C-2),82.1(C-6),132.4(C-1′),129.9(C-1″),109.4(C-2′),109.0(C-2″),147.4(C-3′),147.7(C-3″),145.2(C-4′),146.0(C-4″),114.6(C-5′,5″),118.8(C-6′),119.9(C-6″),55.0(OMe)。上述光谱数据与文献[8]报道的表松脂素数据基本一致,故鉴定化合物3为表松脂素。
化合物4:白色粉末,5%香草醛浓硫酸试剂显紫红色。1H-NMR(600 MHz,CD3OD-d4)δ:3.12 ~3.29(2H,m,H-1,5),3.84 ~4.25(4H,m,H-4,8),4.69(2H,d,J=4.2 Hz,H-2,6),6.64 ~ 6.94(5H,m,arom),3.83(3H,s,OMe)。13C-NMR(150 MHz,CD3OD-d4)δ:55.3(C-1),55.5(C-5),72.6(C-4),72.7(C-8),87.4(C-2),87.6(C-6),133.1(C-1′),133.7(C-1″),104.5(C-2′),110.9(C-2″),149.3(C-3′),149.1(C-3″),136.2(C-4′),147.3(C-4″),149.3(C-5′),116.0(C-5″),104.5(C-6′),120.0(C-6″),56.4(OMe),56.7(OMe)。上述光谱数据与文献[9]报道的中脂素数据基本一致,故鉴定化合物4为中脂素。
化合物5:白色粉末5%香草醛浓硫酸试剂显紫红色。1H-NMR(600 MHz,CD3OD-d4)δ:3.29(2H,m,H-1,5),4.12(4H,m,H-4,8),4.83(1H,d,J=6 Hz,H-2),4.41(1H,d,J=7.2 Hz,H-6),6.65 ~ 6.96(5H,m,arom),3.84(3H,s,OMe)。13C-NMR(150 MHz,CD3OD-d4)δ:55.6(C-1),55.8(C-5),70.6(C-4),70.5(C-8),83.5(C-2),83.6(C-6),131.3(C-1′),133.8(C-1″),104.0(C-2′),110.5(C-2″),149.2(C-3′),148.8(C-3″),134.7(C-4′),146.6(C-4″),149.2(C-5′),116.0(C-5″),104.0(C-6′),119.4(C-6″),56.4(OMe),56.8(OMe)。上述光谱数据与文献[9]报道(-)-medioresinol数据基本一致,故鉴定化合物5为(-)-medioresinol。
3 杜仲炮制后成分变化研究
3.1 TLC色谱鉴别 由于以前实验已经采用薄层色谱法分析了炮制后含量降低的成分[5],因此本实验只分析炮制后含量增加的成分。将分离得到的5个化合物与杜仲160℃盐制品的供试品点于同一薄层板上,以环己烷-氯仿-丙酮-甲醇(1:7:2:1.5)为展开剂,展开,喷以5%香草醛硫酸试液,加热,显色,结果见图1。
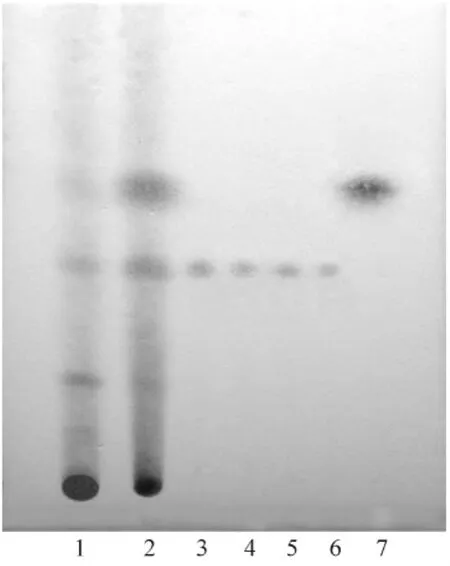
图1 杜仲生品和炮制品的薄层图谱Fig.1 TLC analysis of Eucommiae Cortex and processed Eucommiae Cortex with salt
由图1可见,阿魏醛是炮制后含量明显增加的化学成分。由于松脂素、表松脂素、中脂素、(-)-medioresinol的结构极其相似,且松脂素与表松脂素、中脂素与(-)-medioresinol分别互为立体异构体,所以该4个单体化合物在薄层图谱中分离度很小,Rf值几乎相同,不能很好的确认成分变化情况。但根据其Rf值,基本可以确认所分离的化学成分中有炮制后含量增加的成分。
3.2 HPLC分析 色谱条件:色谱柱Kromasil-C18(4.6 mm ×250 mm,5 μm);以乙腈为流动相 A,以0.1%磷酸水为流动相B,梯度洗脱(0 min 8:92;10 min 15: 95;25 min,15: 85;35 min,17:83;50 min,23:77;70 min,33:67)。流速:1.0 mL/min;检测波长:230 nm;进样量:10 μL。柱温:25 ℃。
供试品溶液的制备:取生杜仲丝及160℃制备盐杜仲粉末各1 g,精密称定,置100 mL锥形瓶中,精密加入甲醇50 mL,密塞,称定重量,超声40 min。冷却后称定重量,补足减失的重量。滤过,精密移取50 mL置蒸发皿中蒸干,残渣加甲醇使溶解,定容至5 mL量瓶中,摇匀,微孔滤膜滤过,取续滤液,即得。
对照品溶液的制备:取阿魏醛,松脂素,表松脂素,中脂素,(-)-medioresinol,京尼平苷酸,绿原酸,松脂醇二葡萄糖苷,中脂素二葡萄糖苷,丁香脂素二葡萄糖苷各5 mg,精密称定,置10 mL量瓶中,加甲醇使溶解,并定容至刻度,摇匀,即得。
生品与炮制品的HPLC指纹图谱分析:采用上述色谱条件,建立杜仲生品和盐制品(160℃)HPLC指纹图谱,以分离得到的阿魏醛,松脂素,表松脂素,中脂素,(-)-medioresinol以及前期研究分离得到的京尼平苷酸,绿原酸,松脂醇二葡萄糖苷,中脂素二葡萄糖苷,丁香脂素二葡萄糖苷为对照品,对杜仲生品和炮制品的HPLC指纹图谱的色谱峰进行标定。结果见图2。

图2 杜仲生品、炮制品HPLC指纹图谱比较Fig.2 Comparative fingerprint of Eucommiae Cortex and processed Eucommiae Cortex with salt
由图2可见,与(-)-medioresinol,中脂素,松脂素,表松脂素和阿魏醛分别对应的 19,20,21,22,23号峰均有所增高,与京尼平苷酸,绿原酸,松脂醇二葡萄糖苷,中脂素二葡萄糖苷,丁香脂素二葡萄糖苷所对应的1,3,8,9,10号峰均有所减低,具体峰面积值变化见表1。

表1 杜仲盐制前后成分色谱峰的保留时间和峰面积Table 1 Retention time and peak area of substances’peaks of Eucommiae Cortex and processed Eucommiae Cortex with salt
由表1可见,不同化学成分盐制前后色谱峰面积变化较大,其中京尼平苷酸、绿原酸、松脂素二葡萄糖苷、中脂素二葡萄糖苷、丁香脂醇二葡萄糖苷的色谱峰面积盐制后降低,而(-)-medioresinol、中脂素、松脂素、表松脂素、阿魏醛的色谱峰面积盐制后则升高。
4 讨论
经柱色谱分离,从盐制杜仲中得到阿魏醛、(-)-medioresinol、中脂素、松脂素、表松脂素等5个杜仲炮制后含量增加的化学成分。根据薄层色谱以及HPLC色谱分析,证实所分离得到的5个化合物确为杜仲盐制后含量增加的成分,其中4个成分为木脂素类的苷元,1个成分为简单苯丙素类成分。由此说明盐制温度对杜仲中的木脂素类成分影响显著。我们前期研究发现,杜仲盐制后环烯醚萜类成分含量减少[5];本研究又发现,炮制后杜仲中木脂素类成分的苷元含量增加,说明盐制过程不仅对杜仲中环烯醚萜类化学成分的影响较大,对木脂素类成分的影响也十分显著。因此杜仲盐制工艺研究中要十分注重控制炮制温度。
化学成分是功效的物质基础,又是性味、归经的物质基础,因此要深入揭示杜仲的炮制原理和炮制作用,需要在化学成分研究的基础上,对盐制杜仲药效作用的机理进行深入探讨,结合化学成分和功效的差异及二者的相关性来阐释杜仲的炮制原理,为杜仲的炮制工艺研究和炮制品质量控制标准的建立提供科学依据。
以往的研究报道[10],杜仲中含有大量的木脂素二葡萄糖苷,如中脂素二葡萄糖苷,松脂醇二葡萄糖苷,丁香脂素二葡萄糖苷……,杜仲炮制后木脂素类成分的苷元显著增加,可能是由于在炮制过程中,木脂素二葡萄糖苷的糖苷键断裂,使木脂素二葡萄糖苷降解成相应的苷元所致。
TLC虽然具有操作简单,分析速度快,不同显色剂可以协助识别化学成分的优点,但由于其分离效率相对较低,有些结构相近或极性相似的化学成分在薄层色谱中分离效果不理想,因此炮制前后化学成分变化研究应采用多种色谱结合,综合分析,揭示炮制前后化学成分变化情况。另外,本实验采用杜仲生品和160℃盐制品的对比分析考察炮制前后成分含量变化,虽然不能全面反应温度对成分变化的影响,但结合薄层分析和HPLC分析,依然可以确认炮制温度对杜仲化学成分的影响非常显著。
[1]张康健,张 檀.中国神树— 杜仲[M].北京:经济管理出版社,1997,1-26.
[2]李 川,江文君.杜仲炮制历史沿革研究[J].中药材,1990,13(1):26-30.
[3]董立莎,刘珊珊,陈晓昱,等.杜仲炮制沿革考[J].中药材,2007,30(9):1175-1178.
[4]夏和生.杜仲炮制研究概述[J].云南中医学院学报,1992,15(3):11-13.
[5]曹 宇,贾天柱,许 枬.炮制对杜仲化学成分的影响[J].中成药,2009,31(6):900-902.
[6]李宏轩.蕤仁的化学成分研究[D].沈阳:阳药科大学.2006.
[7]Deyama T.The constituents of Eucommia ulmoides Oliv.I.Isolation of(+)-MedioresinolDi-O-β-D-glucopyranoside[J].ChemPharm Bull,1983,31(9):2993-29.
[8]Deyama T,Ikawa T,Kitagawa S,et al.The constituents of Eucommia ulmoides Oliv.V.Isolation of dihydroxydehydrodiconiferyl alcohol isomers and phenolic compounds[J].Chem Pharm Bull,1987,35(5):1785-1789.
[9]Deyama T,Ikawa T,Nishibe S.The constituents of Eucommia ulmoides Oliv.II.Isolation and Structures of Three new Lignan Glycosides[J].Chem Pharm Bull,1985,33(9):3651-3657.
[10]赵玉英,耿 权,程铁民.杜仲化学成分研究概况[J].天然产物研究与开发,1995,7(3):46-51.
