HPLC法测定裸花紫珠片中毛蕊花糖苷及连翘酯苷的含量
2011-05-26陈德金祝晨蔯林朝展赵钟祥张翠仙
陈德金, 祝晨蔯, 林朝展, 赵钟祥, 张翠仙
(广州中医药大学中药学院,广中尖峰天然产物共建实验室,广东广州 510006)
裸花紫珠片为裸花紫珠Callicarpa nudifloraHook.et Arn;经水提浓缩成膏后加辅料制成的薄膜衣片,具有消炎解毒、收敛止血之功效,用于治疗呼吸道及消化道出血、细菌感染所引起的炎症等[1]。现行中国药品标准中,裸花紫珠片的质量是通过FeCl3试液鉴别酚羟基及NaNO2和Al(NO)3溶液鉴别黄酮的化学显色反应来控制的,这种方法极易出现假阳性反应,缺乏专属性。近年来,有文献[2]报道用分光光度法测定了裸花紫珠片中总黄酮的含量,但该法存在灵敏度低、干扰因素多、专属性较差等问题,不利于对该产品进行全面和有效的质量控制。紫珠属化学成分研究表明[3-7],苯乙醇苷类成分是该属植物的主要成分类群之一,本课题组自裸花紫珠甲醇提取物的正丁醇萃取部位中分离得到6个苯乙醇苷类化合物,其中以毛蕊花糖苷及连翘酯苷含量最高。现代药理研究表明[8-10],毛蕊花糖苷和连翘酯苷具有抗血栓、降血脂、抗氧化和调节非特异性免疫反应等多方面的作用。为有效地控制裸花紫珠片的内在质量,本实验采用HPLC法对裸花紫珠片中的毛蕊花糖苷及连翘酯苷的含量进行测定,以期为该成药的质量标准再提高提供理论依据。
1 仪器和试药
1.1 仪器 大连伊利特P230型液相色谱仪、EC2000色谱工作站;sartorius电子分析天平(北京赛多利斯仪器系统有限公司)。
1.2 试药 毛蕊花糖苷及连翘酯苷对照品为自制,经归一化法检测,纯度在98%以上;裸花紫珠片为市售品(海南九芝堂药业有限公司,批号:801530、801580、900850);D101型大孔吸附树脂(天津南开大学化工厂);液相所用甲醇为色谱纯,水为超纯水,其余所用试剂均为分析纯。
2 方法与结果
2.1 色谱条件 色谱柱:Kromasil C18(4.6 mm×250 mm,5 μm);流动相:甲醇-0.1% 醋酸水溶液(40:60);流速:1.0 mL/min;检测波长:334 nm;进样量:10 μL;理论塔板数按毛蕊花糖苷计算应不低于10 000,按连翘酯苷计算应不低于8 000;毛蕊花糖苷及连翘酯苷的保留时间分别为11.45 min和9.14 min,与其他组分分离良好。对照品和供试品的色谱图见图1。
2.2 供试品溶液的制备 取本品5片,除去糖衣,研细,取约0.25 g,精密称定,置圆底烧瓶中,加蒸馏水40 mL,加热煎煮1 h,滤过,用适量蒸馏水洗涤烧瓶,洗液一并过滤,滤液置分液漏斗中,用适量蒸馏水洗涤滤器,洗液并入分液漏斗,依次用3倍量、2倍量、2倍量的水饱和正丁醇连续萃取3次,每次静置至分层明显,合并正丁醇液,蒸干,残渣用2~3 mL蒸馏水溶解,加于大孔树脂柱(5 g,20 mm×150 mm,湿法装柱),先用100 mL蒸馏水洗脱,弃去水液,再用300 mL 50%甲醇-水洗脱,收集洗液,蒸干,残渣加适量甲醇溶解并定容至10 mL,摇匀,用微孔滤膜(0.45 μm)滤过,取续滤液作为供试品溶液。
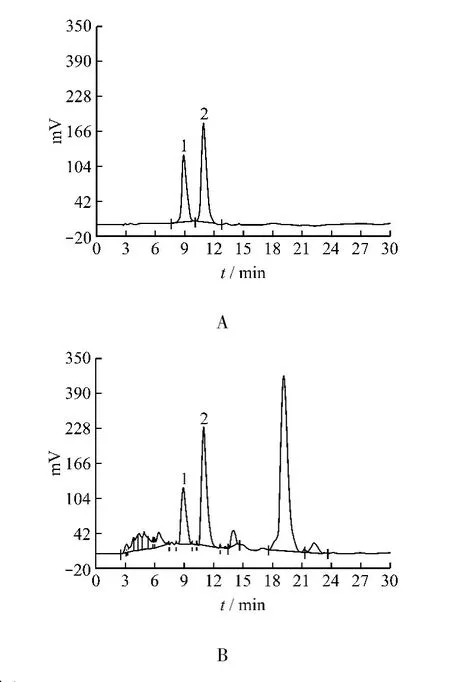
图1 毛蕊花糖苷及连翘酯苷对照品(A)与供试品溶液(B)的高效液相色谱图Fig.1 Chromatograms of control solution(A)and sample solution(B)
2.3 线性关系考察 精密称取对照品毛蕊花糖苷0.004 8 g、连翘酯苷0.005 4 g,置同一10 mL量瓶中,加甲醇至刻度,摇匀,得混合对照品溶液。分别精密吸取混合对照品溶液 1、2、4、8、10、15、20 μL,依选定的色谱条件进样测定,以峰面积(Y)对进样量(X)进行线性回归,回归方程分别为:毛蕊花糖苷Y=1 233.6X-401.06,r=0.999 4,线性范围0.48~9.6 μg;连翘酯苷Y=702.22X- 208.82,r=0.999 7,线性范围0.54 ~10.80 μg。
2.4 最低检测限 在上述色谱条件下,按信噪比大于10/3时,对最低检出限进行测定,结果表明毛蕊花糖苷与连翘酯苷的最低检测限分别为0.96 ng、1.08 ng。
2.5 精密度试验 精密吸取同一供试品溶液10 μL,依法连续进样5次,测定峰面积积分值,结果毛蕊花糖苷平均峰面积为6 569.58,RSD为1.29%;连翘酯苷的平均峰面积为3 851.23,RSD为0.66%,表明仪器精密度良好。
2.6 重复性试验 取同一批号的供试品,照2.2项下平行制备5份,依法测定,结果毛蕊花糖苷的平均含量为11.9 mg/片,RSD为2.44%;连翘酯苷的平均含量为10.3 mg/片,RSD为1.38%,表明分析方法的重现性良好。
2.7 稳定性试验 分别于0、1、2、4、8、12 h精密吸取同一供试品溶液10 μL,进样测定,结果毛蕊花糖苷12 h内的平均峰面积为6 560.30,RSD为1.21%;连翘酯苷的平均峰面积为3 826.56,RSD为1.69%,表明供试品溶液在室温下12 h内稳定性良好。
2.8 加样回收试验 精密称取已知含量的供试品6份,分别精密加入一定量的毛蕊花糖苷及连翘酯苷对照品,照2.2项下制备回收率试验液,依法测定,并计算回收率,结果见表1、表2。

表1 毛蕊花糖苷回收率试验结果(n=6)Table 1 The recovery test of verbascoside

表2 连翘酯苷回收率试验结果(n=6)Table 2 The recovery test of forsythiaside
2.9 样品测定 取3批样品,照2.2项下制备供试品溶液,依法进样测定,结果见表3。
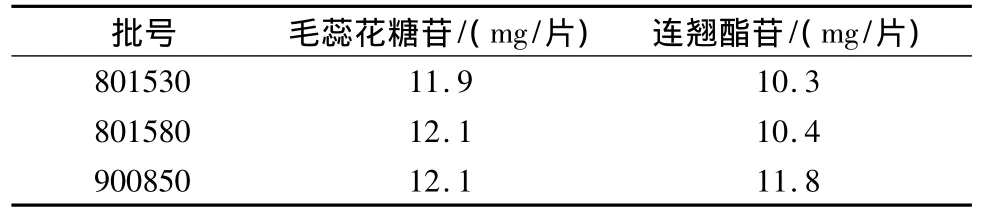
表3 样品测定结果(n=3)Table 3 The results of content assay for forsythiaside and verbascoside in Luohua Zizhu Tablets
3 讨论
有关裸花紫珠片的质量分析,仅有对其中总黄酮的含量测定,有关苯乙醇苷类成分的研究尚未有研究报道。根据文献[11-12]报道,笔者尝试以熊果酸及齐墩果酸为指标控制产品质量,但供试品溶液中无法检测出这两个成分,提示萜类化合物在本品中的含量极低。这可能是由于本品的水提制备工艺无法提出熊果酸等低极性成分造成的。然而,从本实验室对裸花紫珠、广东紫珠、枇杷叶紫珠、全缘叶紫珠等多种紫珠属植物的研究中发现,毛蕊花糖苷及连翘酯苷等苯乙醇苷类化合物作为止血、抗炎、抗氧化的有效成分广泛存在于紫珠属植物中。因此,同时对毛蕊花糖苷及连翘酯苷这两个指标进行测定,建立以苯乙醇苷类为裸花紫珠片的质量控制体系,更能真实客观地反映其内在质量。
通过对毛蕊花糖苷及连翘酯苷的紫外全波长扫描,可知两个对照品的紫外最大吸收均在334 nm。因此,本实验采用334 nm作为毛蕊花糖苷及连翘酯苷的检测波长,以保证两个化合物在HPLC中有较高的响应值及灵敏度。
本品水煎液成分复杂,分别用乙酸乙酯与正丁醇萃取后有交叉,不利于毛蕊花糖苷及连翘酯苷含量的准确测定,因而选用正丁醇直接萃取。试验亦对水饱和正丁醇萃取次数及用量进行了探讨,结果发现3倍量、2倍量、2倍量水饱和正丁醇连续萃取3次便能对毛蕊花糖苷及连翘酯苷萃取完全。
为降低测定时杂质峰的干扰,试验选用大孔树脂对毛蕊花糖苷及连翘酯苷进行富集纯化[13]。上柱采用的是20 mm×150 mm规格的小柱,大孔树脂用量少(约5 g),可以多次再生重复使用,有效节约了资源。同时也对大孔树脂上样量进行了考察,结果发现0.25 g样品粉末较为合适,0.5 g时已开始出现超载现象。大孔树脂上样后,先用蒸馏水洗脱,洗脱液每10 mL一瓶,采用硫酸苯酚法[14-16]测定了其中多糖的含量,结果多糖主要集中在前50 mL洗液中,100 mL蒸馏水已基本将多糖洗脱完全。另外,还采用梯度洗脱的方法对洗脱液进行了探讨,结果30%甲醇水溶液未能洗下毛蕊花糖苷及连翘酯苷,而300 mL50%甲醇水溶液便可将其洗脱完全。
[1]中国药典[S].一部.1977:621-623.
[2]宋永强,谌乐刚.分光光度法测定裸花紫珠片中总黄酮含量[J].海南医学,2005,16(6):152.
[3]Yamasaki T,Masuoka C,Toshihiro N,et al.A new phenylethanoid glycoside from the fruits of Callicarpa japonica Thunb.var.luxurians Rehd[J].J Nat Med,2007,6(1):318-322.
[4]Koo A K,Sung S H,Park J H,et al.In vitro neuroprotective activities of phenylethanoid glycosides from Callicarpa dichotoma[J].Planta Med,2005,71(8):778-780.
[5]Lu Chunhua,Shen Yuemao.Water-soluble constituents from Callicarpa pedunculata[J].Chin J Nat Med,2008,6(3):176-178.
[6]林朝展,柴 玲,蔡昭喜,等.枇杷叶紫珠中苯乙醇苷类成分研究[J].中药新药与临床药理,2010,21(3):276-279.
[7]颜冬兰,刘珊珊,宁云山.紫珠属植物化学、药理及临床应用研究进展[J].中成药,2008,30(9):1361-1363.
[8]王艳晶,杨义芳,高 岱.紫珠属植物的化学成分及生物活性研究进展[J].中草药,2008,39(1):133-138.
[9]王 健,贾凌云,何立华.紫珠属植物的研究进展[J].中国医药导航,2009,6(5):9-10.
[10]靖 会,佐建锋,李教社.苯乙醇苷类化合物的药理研究进展[J].时珍国医国药,2006,17(3):440-441.
[11]王祝年,韩 壮.裸花紫珠的化学成分的研究[J].热带亚热带植物学报,2007,15(4):359.
[12]张艳秋,洪金波,刘文林.HPLC法测定裸花紫珠中齐墩果酸与熊果酸含量[J].海南医学院学报,2009,15(1):5-7.
[13]靖 会,李教社,杨银京.大孔吸附树脂分离纯化连翘叶中苯乙醇苷类成分的工艺研究[J].中药材,2010,33(9):1487-1490.
[14]马 力,徐楚鸿,黄 煜,等.硫酸苯酚法测定金菊花中多糖的含量[J].医药导报,2008,27(12):1511.
[15]钟方晓,任海华,李 岩.多糖含量测定方法比较[J].时珍国医国药,2007,18(8):1916-1917.
[16]江蔚新,朱广伟,李 睿.丁香叶与丁香花中多糖含量比较[J]. 中成药,2007,29(8):附3-附4.
