维药香青兰滴丸质量标准的研究
2011-05-26何承辉邢建国王新春王云飞
何承辉, 邢建国, 王新春, 于 宁, 王云飞
(1.新疆维吾尔自治区药物研究所,新疆 乌鲁木齐 830004;2.石河子大学医学院一附院,新疆 石河子 832008;3.石河子大学药学院,新疆石河子 832002)
香青兰[1]滴丸是由香青兰单味药材制成的中药新制剂,具有补益心脑,活血化淤,通络开窍等功能,是治疗冠心病、心绞痛、心肌缺血等疾病的有效药物[2]。处方被收载于维吾尔古典医籍《阿里卡农》中,至今已有800多年的历史[1]。田蓟苷为香青兰中含量较高的主要药效成分之一[3-6]。为了有效控制制剂质量,本试验建立了定量测定有效成分田蓟苷及木犀草素的高效液相色谱法和定性鉴别田蓟苷的薄层色谱法,结果所建立的方法准确、可靠、专属性强,可有效控制香青兰滴丸的质量,为香青兰滴丸质量标准的研究提供了实验依据。
1 仪器与试剂
SPD-10AVP型高效液相色谱仪(日本岛津);BP211D型十万分之一电子天平(sartorius);Millipore simplicity-185超纯水器(美国密理博公司);KQ-100DE型数控超声波清洗器(昆山市超声仪器有限公司);紫外分析摄影仪(武汉药科新技术开发公司)。田蓟苷对照品(批号:20070408,新疆药物研究所制备,纯度>98%),木犀草素对照品(批号111520-200504)由中国药品生物制品检定所提供。乙腈为色谱纯,其他试剂为分析纯,水为超纯水。香青兰滴丸新疆药物研究所制备。
2 方法与结果
2.1 香青兰定性鉴别 取本品0.5 g,研细,加甲醇10 mL,超声处理10 min,离心,取上清液作为供试品溶液。另取缺香青兰阴性样品,同供试品溶液的制备方法制成阴性对照品溶液。另取香青兰药材5 g,加入40%乙醇100 mL,回流提取3 h,离心,取上清液作为药材溶液。另取田蓟苷对照品适量,加入甲醇制成每1 mL含0.3 mg的田蓟苷溶液,作为对照品溶液。照薄层色谱法试验[7],分别吸取上述3种溶液各3μL,点于同一硅胶HF254薄层板上,分别以三氯甲烷-甲醇(8.5∶1.5)和甲苯-甲酸甲酯-甲酸(5∶4∶2)为展开剂,展开,取出,晾干,置紫外光灯(254 nm)下检视。结果,供试品色谱在与对照品色谱相应的位置上显相同颜色的斑点;阴性对照无干扰。见图1和图2。
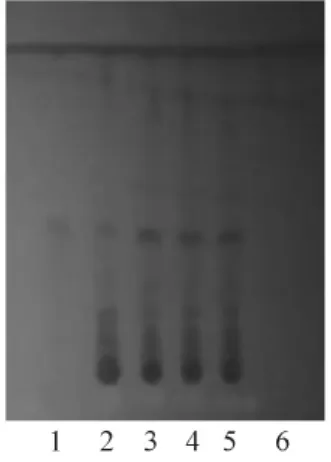
图1 香青兰TLC鉴别(三 氯 甲 烷-甲 醇(8.5∶1.5)为展开剂)
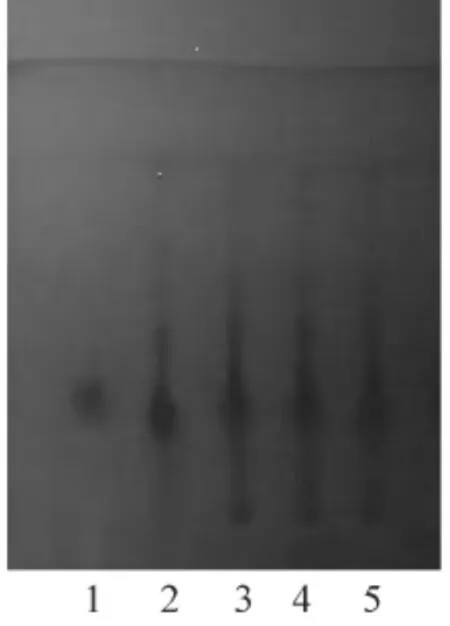
1.田蓟苷对照品 2.香青兰药材 3-5.3批样品 6.阴性对照
2.2 田蓟苷的含量测定[8-9]
2.2.1 色谱条件 色谱柱:Shim-pack VP-ODS(4.6 mm ×250 mm,5 μm);流动相:乙腈-0.5% 甲酸(20∶80);检测波长:324 nm;流速:1.0 mL/min;柱温为35℃,进样量:10 μL。理论塔板数按田蓟苷计不应低于3 000。色谱图见图3。

图3 田蓟苷HPLC图
2.2.2 标准曲线的制备 取田蓟苷对照品约10 mg,精密称定,置50 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得202 μg/mL的田蓟苷对照品贮备液。精密吸取对照品贮备液0.5、1.0、2.0、3.0及5.0 mL,分别置10 mL量瓶中,加甲醇稀释至刻度,摇匀。按上述色谱条件分别进行测定,以对照品浓度(C)为横坐标,峰面积(A)为纵坐标,绘制标准曲线,得田蓟苷线性方程:A=509 212C(r=0.999 8),田蓟苷在10.1~101.0 μg/mL范围内与峰面积线性关系良好。
2.2.3 供试品溶液的制备 取本品适量,研细,取约0.1 g,精密称定,置50 mL量瓶中,加甲醇约25 mL,超声提取30 min,冷却后用甲醇稀释至刻度,摇匀,静置,滤过,取续滤液,即得。
2.2.4 阴性样品 取按处方比例及制法制备的不含香青兰药材的滴丸约0.1 g,按2.2.3项下供试品溶液的制备方法制备阴性对照溶液,依法测定,结果阴性对照无干扰。
2.2.5 精密度考察 精密吸取同一份田蓟苷对照品溶液,按2.2.1项下色谱条件重复进样6次,测定,计算田蓟苷峰面积值的RSD为0.65%,标明精密度良好。
2.2.6 稳定性考察 精密吸取同一份供试品溶液10 μL,每隔2 h按2.2.1项下色谱条件测定,共测定6次,计算供试品溶液中田蓟苷峰面积值的RSD为1.08%,表明供试品溶液在12 h内稳定。
2.2.7 重复性考察 取同一批号的香青兰滴丸的细粉5份,各约0.1 g,按供试品溶液的制备项下处理,按2.2.1项下色谱条件进行含量测定,计算供试品溶液中田蓟苷峰面积值的RSD为0.65%。
2.2.8 加样回收率试验 取供试品细粉9份,每份约0.05 g(含田蓟苷约1.4 mg),精密称定,分别置50 mL量瓶中,分别精密加入田蓟苷对照品溶液,照2.2.3项下供试品溶液的制备方法处理,制备高、中、低3浓度的供试溶液,测定,计算回收率,结果见表1。平均回收率为98.95%,RSD为2.21%。

表1 田蓟苷加样回收率实验结果
2.2.9 样品含量测定 分别取3批香青兰滴丸样品,按供试品溶液制备方法处理,按上述色谱条件下测定,外标法求得香青兰滴丸样品中田蓟苷的含量。结果见表2。每丸含田蓟苷的平均值为0.805 6 mg(n=9)。
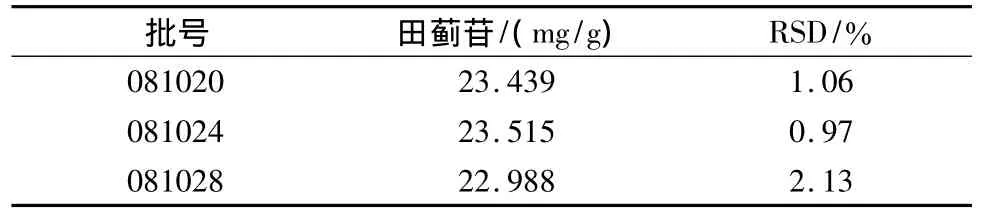
表2 3批样品测定结果(n=3)
2.3 木犀草素的含量测定[10-11]
2.3.1 色谱条件 色谱柱:Shim-pack VP-ODS(4.6 mm ×250 mm,5 μm);流动相:甲醇-0.4% 磷酸(47:53);检测波长:350 nm;流速:1.0 mL/min;柱温为35℃,进样量:10 μL。理论塔板数按木犀草素计不应低于2 500。色谱图见图4。
图4 木犀草素HPLC图
2.3.2 标准曲线的制备 取木犀草素对照品约25 mg,精密称定,置25 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,制成988 μg/mL的木犀草素对照品贮备液。分别精密木犀草素对照品贮备液0.1、0.3、0.5、0.7及1.0 mL,分别置10 mL量瓶中,加甲醇稀释至刻度,摇匀,即得。精密吸取10 μL,注入液相色谱仪,按上述色谱条件分别进行测定。以对照品浓度(C)为横坐标,峰面积(A)为纵坐标绘制标准曲线,得木犀草素线性方程为:A=40 215C(r=0.999 8),木犀草素在9.88~98.8 μg/mL范围内与峰面积线性关系良好。
2.3.3 供试品溶液的制备 取香青兰滴丸适量,研细,取细粉约0.1 g,精密称定,置25 mL量瓶中,加甲醇约15 mL,超声提取20 min,冷却后用甲醇稀释至刻度,摇匀,静置,滤过,取续滤液,即得。
2.3.4 阴性样品 取不含香青兰药材制备的滴丸约0.1 g,按2.3.3项下供试品溶液制备方法制备香青兰阴性对照溶液,依法测定,结果阴性样品无干扰。
2.3.5 精密度考察 精密吸取同一份木犀草素对照品溶液10 μL,连续进样6次,按2.3.1项下色谱条件测定,计算木犀草素峰面积值的 RSD为0.48%,表明方法精密度良好。
2.3.6 稳定性考察 精密吸取供试品溶液10 μL,每隔2 h按2.3.1项下色谱条件测定,共测定6次,结果供试品中木犀草素峰面积值RSD为1.21%,表明供试液12 h内稳定。
2.3.7 重复性考察 取供试品细粉5份,各约0.1 g,照2.3.3项下供试品溶液制备方法处理,按2.3.1项下色谱条件进行测定,结果供试品木犀草素峰面积值RSD为0.75%。
2.3.8 加样回收率试验 取供试品细粉9份,每份约0.03 g(含木犀草素约0.2 mg),各精密称定,分别置25 mL量瓶中,各精密加入木犀草素对照品溶液,照2.3.3项下供试品溶液的制备项下处理,使成高、中、低3浓度供试液,按2.3.1项下色谱条件进行测定,测定,计算回收率,结果见表3。平均回收率为99.10%,RSD为0.56%。
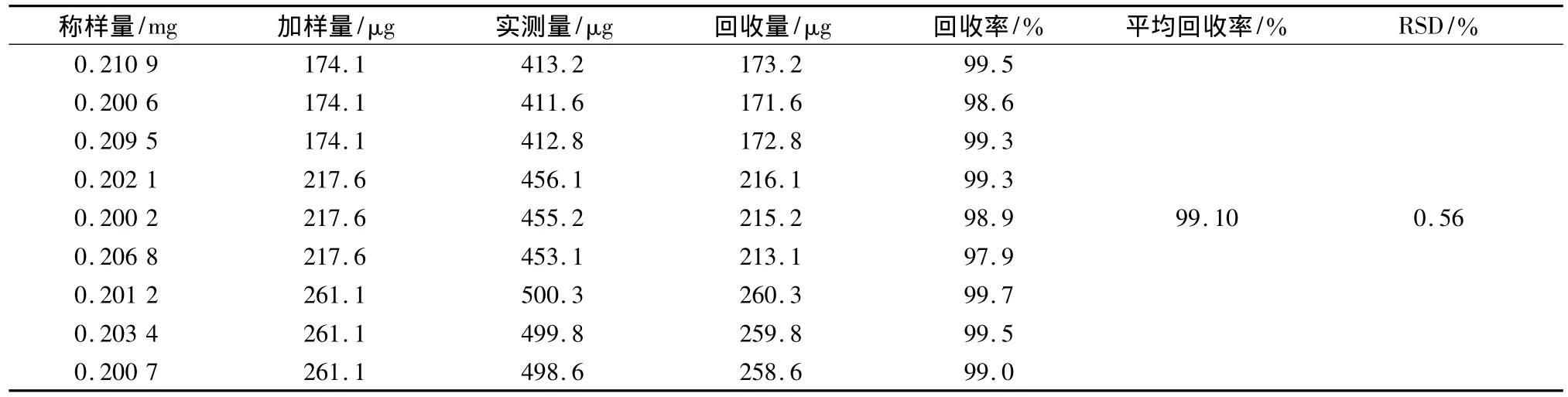
表3 木犀草素加样回收率实验结果
2.3.9 样品含量测定 取3批香青兰滴丸样品,按2.3.3项下供试品溶液制备方法处理,在2.3.1项下色谱条件测定,外标法计算每批样品中木犀草素的含量及RSD。结果见表4。每丸含木犀草素的平均值为0.24 mg(n=9)。
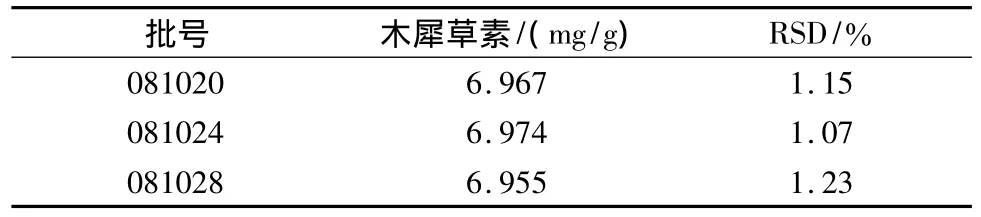
表4 3批样品测定结果(n=3)
4 讨论
4.1 展开剂的选择 在香青兰的TLC鉴别研究过程中,分别考察了甲苯-乙酸乙酯-甲酸(4∶2∶0.1)、甲苯-乙酸乙酯-甲酸(5 ∶4 ∶2)、氯仿-甲醇(9∶1)、氯仿-甲醇(8.5∶1.5)等展开系统,结果表明,氯仿-甲醇(8.5∶1.5)的Rf值较合适,效果较好。
4.2 流动相的选择 有关HPLC测定田蓟苷含量的文献尚未见报道,在流动相考察过程中,先后比较了甲醇-水、乙腈-水、甲醇-磷酸、乙腈-磷酸等多种流动相,结果,以乙腈-0.5%甲酸(20∶80)为流动相,田蓟苷的分离效果和峰形均为最佳,由此确定了本研究含量测定的流动相。
4.3 样品处理方法的选择 在样品处理方法的研究中,主要比较了超声、回流两种提取方法对田蓟苷和木犀草素提取率的影响,结果两种提取方法对田蓟苷和木犀草素的提取率相当,考虑超声提取方法方便简单的特点,最终样品处理方法选择为超声提取法,超声提取时间考察结果表明田蓟苷提取0.5 h,木犀草素提取20 min为宜。
[1]刘勇民,沙吾提-伊克木.维吾尔药志[M].上册,乌鲁术齐:新疆人民出版社,1985:329.
[2]洪秀芳,魏 妤,王晓雯,等.香青兰冲剂治疗冠心病心绞痛疗效分析[J].新疆中医药,1999,17(2):38.
[3]Nam Ki-Hoan,Choi Jae-Hoon,SEO Yun-Jeong,et al.Inhibitory effects of tilianin on the expression of inducible nitric oxide synthase in low density lipoprotein receptor deficiency mice[J].Exp Mol Med,2006,38(4):445-452.
[4]冯长根,李 琼.香青兰化学成分与药理活性研究综述[J].中成药,2003,25(2):154.
[5]王建芬,徐 宇,李 芳,等.HPLC测定香青兰药材中的黄酮类成分[J].华西药学杂志,2007,22(3):348.
[6]吴寿金,赵 泰.现代中药化学成分[M].北京:中国医药科技出版社,2002:238.
[7]中国药典[S].一部.2005:附录31.
[8]麦路德木.麦麦吐逊,李 敏,胡君萍,等.益心巴迪然吉布亚(香青兰)颗粒中总黄酮含量测定[J].新疆医科大学学报,2009,32(5):568-569.
[9]宋 睿,金传山,周亚伟.香青兰中总黄酮和单体的含量测定[J].中国实验方剂学杂志,2010,16(12):71.
[10]邢建国,魏改芹,何承辉.香青兰滴丸制备工艺研究[J].中草药,2008,39(17):1173-1176.
[11]魏改芹,邢建国,何承辉.HPD100大孔吸附树脂分离纯化香青兰中木犀草素的研究[J].中成药,2008,30(11):1608-1611.
