蝎素组分Ⅲ对 Jurkat细胞NF-кB通路的调节作用
2011-05-26赵永新宋向凤郭继强
赵永新, 宋向凤, 郭继强, 王 辉
(新乡医学院免疫学研究中心,河南新乡 453003)
蝎毒在中医治疗上,镇痛、抗惊厥、免疫调节、抗肿瘤等方面的实践已取得了很好的效果[1]。其中起主要药理作用的蝎毒组分Ⅲ是从河南马氏钳蝎毒中分离出的一种成分,对多种肿瘤细胞及细胞系有显著的细胞杀伤和细胞毒性作用[2-3]。研究资料表明蝎素具备细胞毒性作用的同时,还有重要的生物应答调节剂的作用,可显著增强小鼠的免疫功能,促进T淋巴细胞的转化和 TNF-a的分泌,使用药量显著减少并可增强其它抗肿瘤药物的效应。但关于蝎素对细胞免疫调节影响研究较少,SCVⅢ对T淋巴细胞免疫调节的机制尚不清楚。本研究以Jurkat细胞作为研究对象,观察 SVCⅢ对Jurkat细胞IKK1、IкBa mRNA表达的影响,以及对 Jurkat细胞中 NF-кB活化的影响,并探讨SVCⅢ参与细胞免疫调控的可能机制。
1 材料和方法
1.1 材料 T淋巴细胞系Jurkat购自美国ATCC公司,TfxTM-50质粒由美国NIH栾好江博士惠赠。转染试剂TfxTM-50 Reagent、逆转录酶MMLV购自Promega公司产品,总RNA抽提试剂盒Rneasy Mini kit购自QIAGEN公司 ,SVC-Ⅲ由新乡医学院分析测试研究室提供。
1.2 方法
1.2.1 细胞培养 Jurkat细胞复苏后用含10%胎牛血清的RPMI1640培养基进行培养,细胞呈悬浮生长,聚集成团状为生长良好,每2~3 d换1次培养液。
1.2.2 瞬时转染与荧光素酶相对活性测定 按照TfxTM-50 Reagent(Promega)产品说明书进行操作。将质粒 NF-кB-Luc 和内对照 β-Gal转染 Jurkat细胞,转染5 h后加入终浓度为0、0.1 ng/mL、1.0 ng/mL、10 ng/mL和 100 ng/mL的 SVC-Ⅲ。48 h后将细胞收集于1.5 ml EP管,用0.01 mol/L pH7.2的PBS洗2次,加入200 μL裂解液,室温放置15 min,涡旋振荡混匀,12 000 r/min 4℃ 离心10 min,收取20 μL上清细胞裂解液放置于测定管中,加入100 μL荧光素酶反应底物,在荧光分析仪上测定荧光强度,检测时间为20 s。实验重复3次。
1.2.3 RT-PCR扩增IKK1、IкBa 将生长状态良好的Jurkat细胞离心收集,调整细胞浓度为5×106个/mL,分装于24孔培养板中,1 mL/孔,加入到终浓度为 0、0.1 ng/mL、1.0 ng/mL、10 ng/mL 和 100 ng/mL的SVC-Ⅲ。48 h后用QIAGEN总RNA抽提试剂盒提取Jurkat细胞总RNA,按说明进行操作。扩增所用基因引物:IKK1:上游:5′-GCAGAGAGGAGGACCTGTTG-3′,下游:5′-ACTGCTTCAGCCCACACTTT-3′,扩增产物为 438 bp;IкBa:上游:5′-AACCTGCAGCAGACTCCACT-3′,下 游:5′-ACACCAGGTCAGGATTTTGC-3′,扩增产物为 376bp;内参GAPDH:上游:5′-TTAGCACCCCTGGCCAAGG-3′,下游:5′-CTTACTCCTTGGAGGCCATG-3′,扩增产物为550bp。PCR反应条件为:95℃变性30 s,55℃退火30 s,72℃延伸30,循环36次,最后在72℃延伸5 min。同管在扩增到 24、28、32、36 循环时,分别取10 μL备用。取5 μL扩增产物电泳,用凝胶成像系统扫描。实验重复3次。
2 结果
2.1 NF-κB荧光素酶报告基因转染实验结果SVCⅢ浓度的逐渐增加(0.1 ng/mL、1.0 ng/mL)对Jurkat细胞 NF-κB的作用逐渐增强。浓度增加到1.0 ng/mL时,SVCⅢ对NF-κB的作用最强。随着SVCⅢ浓度的增加到一定浓度(10 ng/mL、100 ng/mL),SVCⅢ对 Jurkat细胞 NF-κB 的作用减弱。
2.2 Jurkat细胞株中IKK1和IкBa mRNA的检测SVC-Ⅲ浓度的逐渐增加(0.1 ng/mL、1.0 ng/mL)对Jurkat细胞的IKK1和IкBa的表达作用逐渐增强。浓度增加到1.0 ng/mL时,SVCⅢ对IKK1和IкBa的mRNA的表达作用最强。随着SVCⅢ浓度的增加到一定浓度(10 ng/mL、100 ng/mL),SVCⅢ对Jurkat细胞IKK1和IкBa的表达作用减弱。各组中随着循环的增加 IKK1、IкBa的mRNA表达是逐渐增强的。无SVCⅢ刺激,IкBa的表达强于IKK1;SVCⅢ(0.1、1.0、10、100 ng/mL)刺激组,IKK1 的表达强于 IкBa。见图 1 ~2。
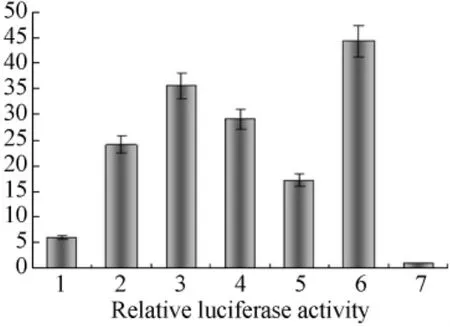
图1 NF-κB荧光素酶报告基因转染实验结果Fig.1 NF-κB fluorescent element enzyme gene transfection experimental results

图2 不同浓度SVCⅢ刺激Jurkat细胞 IKK1、IкBa和GAPDH在24、28、32和36循环mRNA的表达Fig.2 The expression of different concentration SVCⅢstimulate IKK1,IкBa and GAPDH of 24,28,32 and 36 mRNA cycle in Jurkat cell
3 讨论
近年来,蝎素作为生物应答调节剂调节免疫系统功能的研究已引起广泛重视,我们以前的研究显示SVCⅢ能够促进T淋巴细胞的转化和肿瘤坏死因子的分泌[4],能以剂量依赖的方式调节Jurkat细胞中信号分子ZAP-70和LAT的表达[5]。蝎毒多肽提取物可以改善荷瘤机体细胞免疫功能的抑制状态,增强其识别、杀伤突变细胞的能力,发挥抗肿瘤作用,肿瘤抑制率可达 55.21%[3]。
关于蝎素对细胞免疫功能的影响研究较少,SVC-Ⅲ对T淋巴细胞免疫功能的机制尚不完全清楚。Jurkat E6-1细胞是人类T淋巴肿瘤细胞的细胞株,在功能上与人类 T淋巴细胞有很多共同的特点,T淋巴瘤的激活与凋亡有很多种因素,在免疫调节中具有十分重要的作用机制,已广泛用于实验室研究。本研究以Jurkat E6-1细胞作为研究对象,观察不同浓度的SVC-Ⅲ对Jurkat细胞NF-кB信号通路的影响,以探讨SVC-Ⅲ抗肿瘤的作用,为抗肿瘤治疗寻求更加有效的方法。并探讨SVC-Ⅲ参与细胞免疫调控的可能机制。
本研究发现低剂量 SVC-Ⅲ(0.1 ng/mL、1.0 ng/mL)对Jurkat细胞 NF-кB活性及调空蛋白 IкBa及相关激酶IKK1mRNA的表达有一定促进作用,特别是在浓度为1.0 ng/mL时作用最强(P<0.01),而随着浓度增高作用开始逐渐减弱。NF-кB是一种细胞核转录因子,在调控免疫细胞的激活、淋巴细胞的发育、细胞凋亡、肿瘤形成、病毒复制、炎症反应及多种自身免疫性疾病方面发挥重要作用[6-8]。正常情况下NF-κB与NF-κB的内源性抑制因子主要是IκB抑制蛋白结合,以失活的形式存在胞浆中,当细胞接受刺激,IκB裂解,暴露出 NF-κB亚基上核定位序列和具有基因转录活性的反式激活域,NF-κB从胞浆移位入胞核,发挥基因转录调控的作用。IкBa 是细胞内 NF-κB 的主要抑制因子,细胞内 IкBa的水平、IкBa受信号刺激后能否正常磷酸化进而降解对 NF-κB 活化起关键作用[9-10],而 IкBa 的磷酸化受IκB激酶(IKK)的调节。IKK1可使 NF-кB抑制蛋白IкB被磷酸化,通过泛素降解途径使 IкB由NF-кB 二聚体上解聚,从而激活了 NF-кB,进而调控靶基因的转录。一些体内外的实验研究表明,NF-кB在乳腺癌中异常激活,抑制乳腺癌细胞NF-кB的活性可引起肿瘤细胞的凋亡,从而抑制乳腺癌细胞生长[11]。从本实验中可以看出高剂量的可以通过IKK1 抑制 IкBa 的磷酸化,IкBa 不能从 NF-кB 二聚体上解聚,NF-κB未能被激活,不能调控靶基因的转录。SVC-Ⅲ通过抑制NF-кB活性的作用,可以阻断NF-κB信号通路抑制细胞增殖,使肿瘤细胞的生长受到抑制。
以上研究结果表明高浓度SVC-Ⅲ可抑制Jurkat细胞IкBa蛋白的磷酸化,抑制NF-κB途径的激活,从而阻断NF-κB 信号通路IKK1、IкBa表达,进而诱导细胞周期阻滞、抑制肿瘤细胞增殖。可见对NF-κB的深入研究为抗肿瘤治疗提供了新的、更为有效的作用靶点,为临床癌症病人的治疗提供了一种有效的治疗手段。
[1]李 育,王明艳.中药抗肿瘤的分子机理[J].中国中医药信息杂志,2005,12(1):95-96.
[2]王兆朋,张维东,张 捷,等.蝎毒多肽提取物对非激素依赖性前列腺癌细胞增殖抑制作用的实验研究[J].中国药理学通报,2006,22(8):938-942.
[3]张维东,张月英,王朝霞,等.蝎毒多肽提取物对肿瘤生长和细胞免疫功能的影响[J].山东大学学报:医学版,2007,45(3):286-289.
[4]王 辉,董 珂,孙书明,等.蝎毒SVC-Ⅲ对荷瘤小鼠淋巴细胞转化及TNF-α水平的影响[J].细胞与分子免疫学杂志,2002,18(5):505-506.
[5]宋向凤,郭继强,白国强,等.蝎素组分Ⅲ对Jurkat细胞CCR5表达的影响[J].中国免疫学杂志,2009,25(3):221-222.
[6]Boersma M C,Meffert M K.Novel roles for the NF-kappaB signaling pathway in regulating neuronal function [J].Sci Signal,2008,1(6):7.
[7]Crisostomo P R,Wang Y,Markel T A,et al.Human mesenchymal stem cells stimulated by NF-alpha,LPS,or ypoxia produce growth factors by an NF-kappa B but not JNK-dependent mechanism[J].Am J Physiol Cell Physiol,2008,294(3):82-90.
[8]Arimilli S,Johnson J B,Alexander-Miller M A,et al.TLR-4 and-6 agonists reverse apoptosis and promote maturation of simian virus 5-infected human dendritic cells through NFkB-dependent pathways[J].Virology,2007,65(1):86-93.
[9]Liu YH.Epithelial to mesenchymal transition in renal fibrogenesis:pathologic significance,molecular and therapeutic intervention [J].Jam Soc Nephrol,2004,15(1):1-8.
[10]Dolcet X,Llobet D,Pallares J,et al.NF-κB indevelopment and progression of human cancer[J].Virchows Arch,2005,446(10):268-275.
[11]Ahmed KM,Cao N,Li JJ.HER-2 and NF-kappaB as the targets for therapy-resistant breast cancer[J].Anticancer Res,2006,26(6B):4235-4243.
