HPLC法测定附子与其炮制品中双酯型生物碱
2011-05-25朱日然李启艳朱宗敏
朱日然, 李启艳, 朱宗敏, 黄 超
(1.山东中医药大学附属医院,山东济南 250012;2.山东省药品检验所,山东 济南 250010;3.山东中医药大学,山东 济南 250355)
HPLC法测定附子与其炮制品中双酯型生物碱
朱日然1, 李启艳2, 朱宗敏1, 黄 超3
(1.山东中医药大学附属医院,山东济南 250012;2.山东省药品检验所,山东 济南 250010;3.山东中医药大学,山东 济南 250355)
目的 通过测定附子及熟附片(干片蒸制)、黑顺片、熟附片(鲜片蒸制)、盐附子、炮附片中次乌头碱、乌头碱、新乌头碱的量,揭示炮制减毒的科学内涵。方法 样品采用10%氨水浸润,乙醚超声提取的方法;色谱柱为Agilent Zorbax SB-C18柱(4.6 mm ×150 mm,5 μm);流动相为乙腈-0.2%冰醋酸(浓氨水调节 pH 为7.29)(28 ∶72);检测波长235 nm;结果 与生附子相比,次乌头碱、乌头碱、新乌头碱在清水黑顺片、盐附子等炮制品中的量大大降低;结论 本实验从化学的角度阐释了附子炮制减毒的科学依据。
附子;炮制品;双酯型生物碱;高效液相色谱法
附子为毛茛科植物乌头Aconitum carmichaeliDebx子根的加工品,具有回阳救逆,补火助阳,逐风寒湿邪的功效。附子的化学成分主要为剧毒的二萜双酯类生物碱,包括次乌头碱(hypaeonitine)、乌头碱(aconitine)、新乌头碱(mesaconitine)、塔拉弟胺(tatatisameine)、川乌碱甲(Chuan-wu-base A)等成分。为了减其毒性,提高临床疗效,通常対附子进行炮制,其炮制品包括黑顺片、盐附子、炮附片等。本实验采用高效液相法对附子与其炮制品中双酯型生物碱的量进行测定,以考察附子中双酯型生物碱在炮制过程中的变化及辅料的对其影响[1-4]。
1 仪器与试药
SK 5200H型超声波提取机(中国科导超声仪器有限公司制造);R-205型旋转蒸发仪(上海申顺生物科技有限公司);HH-2型数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司);PHS-3C型pH值测定仪(上海康仪仪器有限公司);安捷伦1200型高效液相色谱仪(美国安捷伦)。
乌头碱(110720-200208)、新乌头碱(110799-200404)、次乌头碱(110798-200404)对照品均购自中国药品生物制品检定所,乙腈为色谱纯,其他试剂均为分析纯。生附子购自山东省中药饮片厂,熟附片(干片蒸制)、清水黑顺片、熟附片(鲜片蒸制)、盐附子、无胆炮附片均为山东省中医药大学附属医院实验室炮制。附子经山东省中医院张学顺教授鉴定为毛茛科植物乌头Aeonitum carmichaeliDeb的子根加工品。
2 方法
2.1 色谱条件[5-7]Agilent Zorbax SB-C18柱(4.6 mm ×150 mm,5 μm);流动相为乙腈-0.2% 冰醋酸(浓氨水调节 pH为7.29)(28∶72),体积流量1 mL/min;检测波长235 nm。理论板数按乌头碱峰计算应不低于3 000。采用此色谱条件,供试品及对照品色谱分离度良好,见图1。

图1 HPLC色谱图Fig.1 HPLC chromatograms
2.2 方法与结果
2.2.1 供试品溶液的制备 取生附子样品粉末(过40目筛)2 g,精密称定,置具塞锥形瓶中,加10%氨水3 mL,浸润,精密加入乙醚50 mL,超声提取30 min,滤过,并用15 mL乙醚分3次冲洗药渣,合并滤液,置50℃水浴挥干乙醚,用0.01%盐酸-甲醇溶解并转移至10 mL量瓶中,定容至刻度,摇匀,即得。
2.2.2 线性关系的考察 分别精密称取在60℃减压干燥4 h的乌头碱、新乌头碱、次乌头碱对照品适量,加0.01%盐酸-甲醇制成各含乌头碱0.027 36 mg/mL、次乌头碱0.128 3 mg/mL、新乌头碱0.123 2 mg/mL的混合溶液,作为对照品溶液。
分别精密吸取上述对照品溶液各 1、2、4、8、16、20 μL,注入液相色谱仪,分别测定峰面积积分值。分别以乌头碱、新乌头碱、次乌头碱对照品的进样量为横坐标,峰面积积分值为纵坐标,进行线性回归,得乌头碱回归方程y=867.53x-0.452 5,相关系数r=0.999 9,新乌头碱回归方程y=1 056x-10.898,相关系数r=0.999 8,次乌头碱回归方程y=856.84x-7.577,相关系数r=0.999 9。表明乌头碱进样量在0.027 36 ~0.547 2 μg 之间、新乌头碱进样量在 0.128 3 ~2.566 4 μg之间、次乌头碱进样量在0.123 2~2.464 μg之间,与峰面积积分值呈良好的线性关系。
2.2.3 精密度实验 精密吸取上述对照品溶液8 μL,注入液相色谱仪,连续进样5次,按上述测定方法进行测定,结果乌头碱的RSD为0.65%、新乌头碱的RSD为0.71%、次乌头碱的RSD为0.38%,表明仪器精密度良好。
2.2.4 稳定性试验 精密吸取上述供试品溶液10 μL,每隔2 h进样一次,测定双酯型生物碱的峰面积积分值,共考察8 h,以观察样品溶液在检测过程中待测成分的稳定性,结果乌头碱峰面积的RSD为0.66%、新乌头碱峰面积的RSD为0.42%、次乌头碱峰面积的RSD为0.78%,表明供试品溶液在8 h内稳定性良好,能够满足测定需要。
2.2.5 重复性试验 取陕西产生附子样品粉末(过40目筛)2 g,共取5份,按上述测定方法进行测定,分别计算乌头碱、新乌头碱及次乌头碱的量,结果乌头碱的平均质量分数(n=5)为0.171 8 mg/g,RSD为1.05%;新乌头碱的平均质量分数(n=5)为0.518 1 mg/g,RSD 为1.56%;次乌头碱的平均质量分数(n=5)为 0.212 6 mg/g,RSD 为 1.74%;表明测定方法的重复性良好。
2.2.6 回收率试验 对照品贮备液的制备 分别精密称取在60℃减压干燥4 h的乌头碱、新乌头碱、次乌头碱对照品适量,置10 mL量瓶中,加0.01%盐酸-甲醇溶解并定容至刻度,摇匀,即得(乌头碱浓度为 0.172 5 mg/mL,次乌头碱浓度为0.507 5 mg/mL,新乌头碱浓度为 0.211 7 mg/mL)。
取陕西产生附子样品粉末(过40目筛)1 g,共取5份,精密称定,置具塞锥形瓶中,每份分别加入上述对照品贮备液各1 mL,按2.2.1项下方法制得供试品溶液。照上述测定方法进行测定,计算回收率,结果见表1~3。结果表明,本方法的回收率良好。
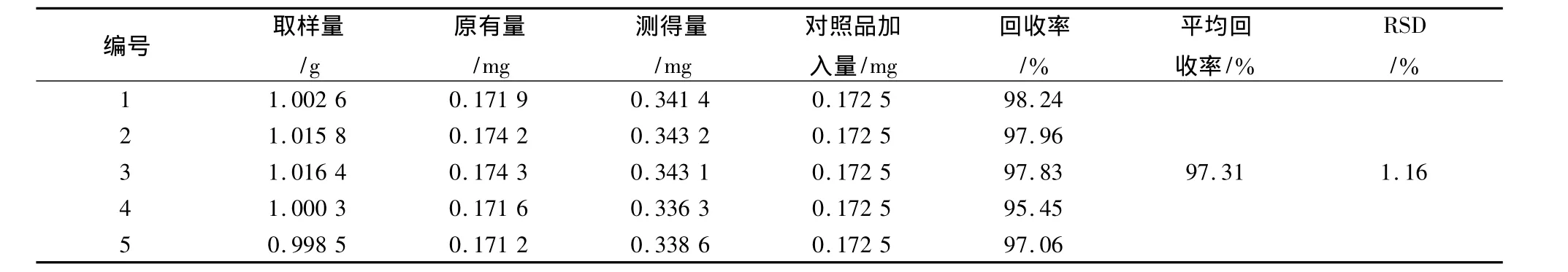
表1 乌头碱加样回收率试验结果Tab.1 The recovry results of aconitine
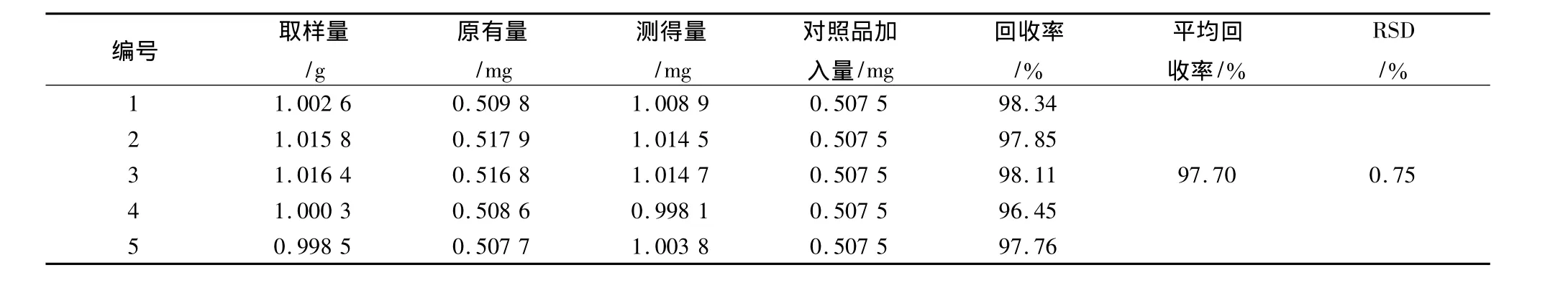
表2 次乌头碱加样回收率试验结果Tab.2 The recovry results of mesaconitine
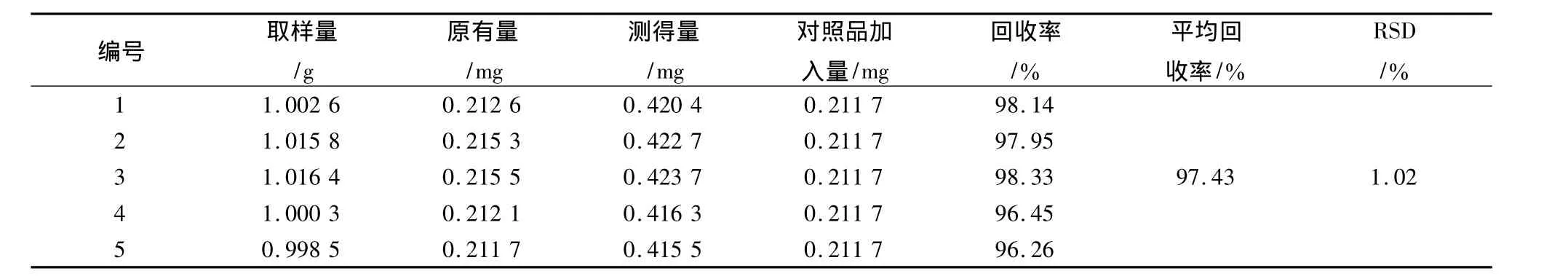
表3 新乌头碱加样回收率试验结果Tab.3 The recovry results of aconitine hypaconitine
3 样品的测定
取待测样品粉末(过40目筛)2 g,按2.2.1项下方法制得供试品溶液。进样10 μL,测定结果见表4。
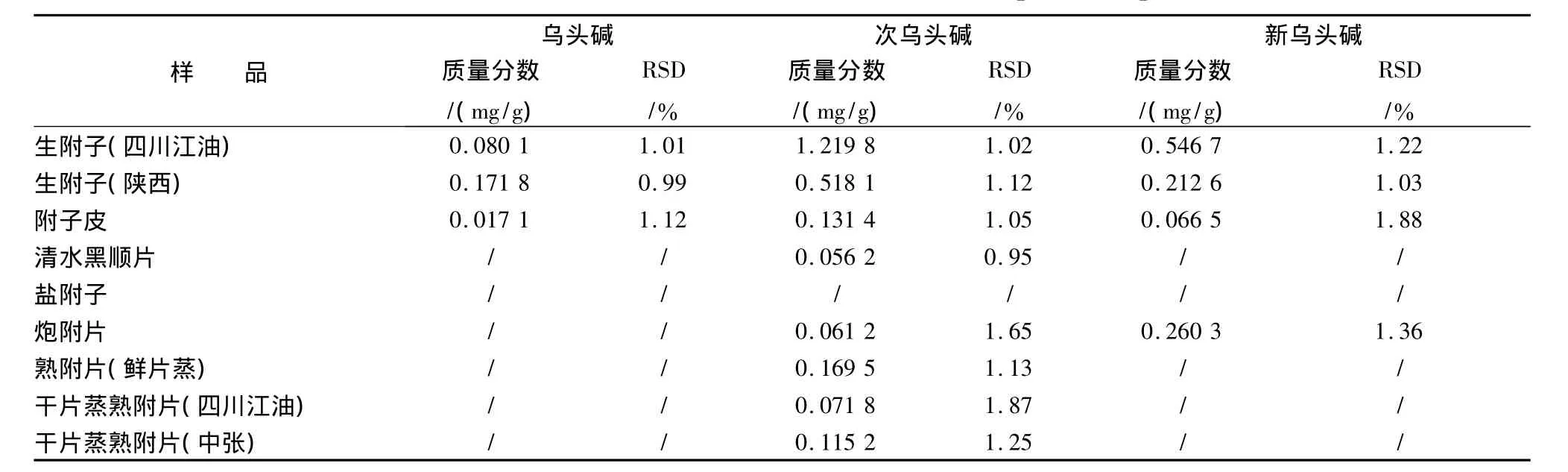
表4 9种附子及炮制品的测定结果(n=3)Tab.4 Determination of 9 kinds of Aconitum carmichaeli and its processed products
4 讨论
4.1 最大吸收波长的考察 取乌头碱、新乌头碱、次乌头碱对照品溶液,在200~400 nm期间进行扫描,结果3种溶液均在235 nm处有吸收峰,故选用235 nm 作为检测波长[8-9]。
4.2 提取方法的考察 根据附子的性质,采用氨水浸润,乙醚超声法进行提取。考察了影响提取的主要因素包括氨水用量、乙醚用量、超声时间,并以乌头碱、次乌头碱、新乌头碱总量为指标,采用L9(34)正交试验优选最佳提取工艺,即加10%氨水2 mL,浸润,再精密加入乙醚 50 mL,超声提取 30 min[10-12]。
4.3 由上述测定结果可知:四川江油产生附子的次乌头碱、新乌头碱量远高于陕西产生附子,而乌头碱量却明显低于陕西生附子。附子的几种炮制品中,盐附子的3种双酯型生物碱基本检测不到,黑顺片、熟附片(鲜片蒸)、熟附片(干片蒸)仅能检测到少量的次乌头碱,而炮附片除次乌头碱外仍能检测到较高量的新乌头碱,说明经过炮制后,盐附子的毒性已经大大降低,黑顺片、熟附片(鲜片蒸)、熟附片(干片蒸)中仅有微量的毒性成分,而炮附片中主要毒性成分的含量仍较高。附子皮中的双酯型生物碱量较生附子有所降低但明显高于炮制品。
4.4 本实验从化学的角度阐释了附子炮制减毒的科学依据。通过比较生附子及其炮制品中3种主要类型生物碱相对量的变化规律,结果表明附子炮制品中乌头碱几乎全部破坏,而新乌头碱和次乌头碱的量大大降低,从而达到减毒的目的。
[1]张 荣,方 庆.川乌加压炮制对乌头类生物碱含量的影响研究[J].中医药学刊,2003,10(5):20-22.
[2]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:化学工业出版社,2010:203.
[3]朱林平,李志强,李 侠.附子、半夏配伍研究[J].中成药,2007,29(12):1817-1818.
[4]王 勇,刘志强,宋凤瑞.附子配伍原则的电喷雾质谱研究[J].药学学报,2003,38(6):451-454.
[5]程碧桃,梁锦添.高效液相色谱法测定血伤宁中的乌头碱含量[J].广西大学学报(自然科学版),1998,15(4):35-37.
[6]王 瑞,孙毅坤,王 耘,等.高效液相色谱法测定附子及其炮制品中三种双醋型生物碱[J].现代医学生物进展,2007,7(7):1078-1080.
[7]越 皓,皮子凤,宋凤瑞,等.附子不同配伍药对中生物碱成分的电喷雾质谱分析[J].药学学报,2007,42(2):201-205.
[8]刘秀秀,晁若冰.HPLC控制参附注射液及附子中3种双酯型生物碱[J].中国中药杂志,2007,32(2):153-155.
[9]刘 芳,于向红,李 飞,等.HPLC测定附子及其炮制品中3种双酯型生物碱的含量[J].中国中药杂志,2006,31(14):1160-1164.
[10]彭 波,杨华元,刘世瑞.反相离子对高效液相色谱法测定川乌和附片中乌头类生物碱的方法研究[J].药物分析杂志,1995,15(6):13-16.
[11]陈巧玲.川乌、草乌、附子及其复方制剂中乌头类生物碱的含量测定研究概况[J].华西药学杂志,1999,14(2):114-116.
[12]杨 云.附子理中口服液中乌头类生物碱的含量测定[J].中国实验方剂学杂志,1997,3(3):43-46.
Analysis of diester diterpenoid alkaloids(DDAs)inAconitum carmichaeliand its processed products by HPLC
ZHU Ri-ran1, LI Qi-yan2, ZHU Zong-min1, HUANG Chao3
(1.Hospital Affiliated to Shandong University of Traditional Chinese Medicine,Jinan 250012,China;2.Shandong Provincial Institute for Drug Control,Jinan 250010,China;3.Shandong University of Traditional Chinese Medicine,Jinan 250355,China)
Aconitum carmichaeli;processed product;diester diterpenoid alkaloids(DDAs);HPLC
R284.1
A
1001-1528(2011)08-1375-04
2011-01-12
朱日然(1979—),本科,主要从事中药材质量及中药制剂开发的工作。Tel:(0531)81216522,E-mail:zhuriran@sina.com
