野生与组培金线莲有效成分的比较及RAPD分析
2011-05-25顾慧芬庄意丽梅其春
顾慧芬, 庄意丽, 梅其春
(1.上海市中药研究所,上海 201401;2.复旦大学生命科学学院,上海 200433)
野生与组培金线莲有效成分的比较及RAPD分析
顾慧芬1, 庄意丽1, 梅其春2
(1.上海市中药研究所,上海 201401;2.复旦大学生命科学学院,上海 200433)
目的 研究人工栽培金线莲替代金线莲野生资源的可行性。方法 比较金线莲组培苗与野生金线莲药材中多糖、氨基酸及总黄酮的量,采用随机扩增多态性DNA(RAPD)技术对金线莲组培苗及野生药材进行了基因组DNA多态性分析。结果 多糖和总黄酮的比较表明,金线莲组培苗与野生品(台湾)的多糖和总酮量相近;总氨基酸比较表明,金线莲组培苗中总氨基酸达9.17%,高于野生品的总氨基酸量;通过随机扩增多态性DNA(RAPD)技术,从中筛选出了能用于鉴别金线莲组培苗的特异性引物。结论 初步证明通过组织培养获得的金线莲组培苗可以代替其野生品,它是解决金线莲资源紧缺的有效途径之一。
金线莲;组培苗;多糖;氨基酸;总黄酮;RAPD
金线莲是一种名贵珍稀中药,具有清热解毒、固肾平肝、降血糖等功效[1-2],为兰科 Orchidaceae 开唇兰属Anoectochilus植物花叶开唇兰Anoectochilus roxburghii(Wall.)L.的全草。该植物主要分布在台湾、福建、广西、云南等地。由于其营养体繁殖缓慢,种胚发育不全,在自然状态下难以繁殖,造成野生金线莲的自然资源储量日渐减少,已成为濒危的药用植物。近年来,国内对名贵药材的组织培养进行大量研究[3-4],成功地利用组织培养技术对金线莲进行无性快速繁育,解决了该植物资源匮乏的问题。然而,有关利用组织培养得到的金线莲其有效成分等方面的研究则少见报道。
为了保护濒危野生的金线莲资源,开发组培金线莲的药用价值,本研究在应用植物组培技术高效快速繁殖金线莲基础上,对组培金线莲及野生金线莲的主要活性成分如多糖、氨基酸和总黄酮进行了对比研究[5-9],并进行了 RAPD 分析[10-12],为金线莲的产业化扩繁及工业化生产提供实验基础和科学依据。
1 材料
野生金线莲为多年生全草,由云南省屏边县科委提供。实验用金线莲组培苗高8~10 cm,由上海市中药研究所于2002年7月进行无性快速繁殖培养。外植体为野生金线莲(台湾),培养基为MS附加 NAA(α-萘乙酸)、IBA(吲哚丁酸)、ZT(玉米素),经诱导形成的组培苗再进行无激素继代培养,每月继代一次。培养条件为:温度(25±1)℃,光照强度:1 500 lx,每天光照12 h。所有实验材料的凭证标本均存放在上海市中药研究所。分光光度计为岛津2401。
2 方法
2.1 金线莲组培苗与野生药材多糖测定
2.1.1 对照液制备 精密称取105℃干燥至恒质量的葡聚糖标准品10.02 mg,至100 mL量瓶加蒸馏水至刻度,备用。
2.1.2 供试液制备 精密称取剪碎后干燥的野生金线莲(台湾、云南、广西)与金线莲组培苗各2.0 g,置500 mL圆底烧瓶,加70%乙醇100 mL于沸水浴回流40 min,趁热过滤,用80%乙醇冲洗滤液3次,每次10 mL,滤渣连滤纸置于烧瓶中加水60 mL提取2次,第1次1 h,第2次30 min,热滤,用热水冲洗3次,每次10 mL,滤液浓缩至10 mL,精吸1 mL,定容至200 mL,加活性炭脱色,过滤,滤液待用。
2.1.3 标准曲线的制作 准确称取标准葡聚糖(或葡萄糖)10 mg于100 mL量瓶中,加蒸馏水至刻度。分别吸取1.0、3.0、5.0、7.0、9.0 mL,各以蒸馏水补至10 mL。吸取2.0 mL,加入5%苯酚1.0 mL及浓硫酸10 mL,摇匀冷却,于485 nm测光密度,以2.0 mL水按同样操作为空白,横坐标为多糖毫克数,纵坐标为光密度值,绘制标准曲线。得线性方程:Y=8.225 8X+0.005 1,相关系数r=0.999 6。
2.1.4 多糖测定 取上述对照液和供试液各2.0 mL,分别置15 mL磨口试管中,各加5%苯酚溶液1 mL与硫酸10 mL,混匀,放置30 min。另取蒸馏水1 mL,同样操作,作为空白。按分光光度法在485 nm波长处分别测定吸收度,测得多糖量。
2.2 金线莲组培苗与原药材氨基酸测定
取野生金线莲(台湾、广西)与金线莲组培苗各适量,对人体必需的18种氨基酸按国家标准GB/T5009.124-2003方法进行测定。
2.3 金线莲组培苗与野生药材总黄酮测定
2.3.1 对照液制备 精密称取105℃干燥至恒质量的芦丁标准品21.87 mg于100 mL量瓶中,加70%乙醇至刻度备用。
2.3.2 供试液制备 精密称取干燥的野生金线莲(台湾、云南、广西)与金线莲组培苗粉末各1 g,置50 mL三角烧瓶,加70%乙醇25 mL,称定重量,超声波提取30 min,冷却至室温,以70%乙醇补足损失的量,过滤,取续滤液1 mL,定容至10 mL量瓶,备用。
2.3.3 标准曲线的制作 准确称取标准品芦丁21.87 mg于100 mL量瓶中,加70%乙醇至刻度,再稀释 1 倍,分别吸取 1.0、2.0、4.0、6.0、8.0 mL,各以70%乙醇补至10 mL,吸取5.0 mL分别加入0.1 mol/L三氯化铝3 mL和1 mol/L醋酸钾5 mL,混匀,显色40 min,于420 nm波长处分别测定吸收度,以5.0 mL水按同样显色操作为空白,横坐标为芦丁的量(mg),纵坐标为光密度值,绘制标准曲线。得线性方程:Y=12.645X+0.021 5,相关系数r=0.999 963。
2.3.4 总黄酮测定 取上述对照液和供试液各5.0 mL,分别置15 mL磨口试管中,各加0.1 mol/L三氯化铝3 mL和1 mol/L醋酸钾5 mL,混匀,显色40 min。另取蒸馏水5.0 mL,同样操作,作为空白。按分光光度法在420 nm波长处分别测定吸收度,测得总黄酮量。
2.4 金线莲组培苗与野生药材RAPD分析
2.4.1 DNA的提取 分别取野生金线莲(台湾、云南、广西)与金线莲组培苗茎叶0.5 g于研钵中,剪碎后倒入液氮研成细粉,加入600 μL预热至60℃的 CTAB 抽提缓冲液(100 mmol/L pH8.0 Tris-HCl,5 mmol/L EDTA,1.4 mol/L NaCl,2%2-巯基乙醇,2%PVP),60℃水浴作用60 min并不时振荡混合。取出后加入2/3体积的三氯甲烷-异戊醇(24∶1),轻柔颠倒5 min,放入4℃冰箱静置10~30 min;14 000 r/min离心10 min,定量吸取上清液,加入2/3体积的-20℃异丙醇,缓缓混匀数次,放入-20℃冰箱沉淀30 min至过夜;取出,15 000 r/min离心10 min,倾去上清液,以洗涤缓冲液洗涤沉淀2次。再用75%乙醇洗涤2次,挥干乙醇;加入400 μL TE溶解沉淀,加入1/10体积的NaAc,再加入2体积-20℃无水乙醇重沉淀1 h至过夜;取出15 000 r离心10 min,倾去上清,用75%乙醇洗涤2次,30℃烘箱烘干乙醇,加入100 μL TE溶解。提取后的DNA样品各取8 μL上样于1%的琼脂糖凝胶进行电泳检测。取部分为实验用,其余置于-20℃保存。
2.4.2 引物筛选 实验筛选了35个随机引物,其中14个引物扩增显示有多态性条带,且具有良好的种间特异性;实验最终选择扩增多态性好,并具有种内特异性的引物,对野生金线莲(台湾、广西、云南)与金线莲组培苗进行分析。
2.4.3 PCR的扩增和电泳检测 PCR扩增:扩增总体积 25 μL,其中无菌水15.78 μL,10 × PCR buff-
er 2.5 μL,dNTP 0.2 mmol/L,Mg2+2 mmol/L,引物0.3 μmol/L,Taq 酶 0.5 U,DNA 模板 4 μL(抽提原液稀释 10倍)。在 ThermojeT PCR仪(比利时EquiBio)上进行扩增。扩增程序如下:90℃变性3 min,36℃复性1 min,72℃延伸2 min;90℃ 1 min,36℃ 1 min,72℃延伸2 min,40个循环;最后72℃延伸7 min。取扩增产物8 μL在1.5%的琼脂糖凝胶中电泳检测,由北京亚力恩机电技术研究所生产的YLN 2000凝胶影像分析系统照相。所有的反应均进行两次或两次以上,且只有具有重复性(重复两次或以上)的多态性条带被用作实验结果并进行分析。
3 结果与分析
3.1 金线莲组培苗与野生药材多糖比较 通过对野生金线莲(台湾、云南、广西)与金线莲组培苗有效成分多糖进行比较,发现组培苗植株多糖量与野生植株(台湾)多糖量接近,分别为 18.68%、19.18%,野生品(广西)较低,仅6.70%,见表1。
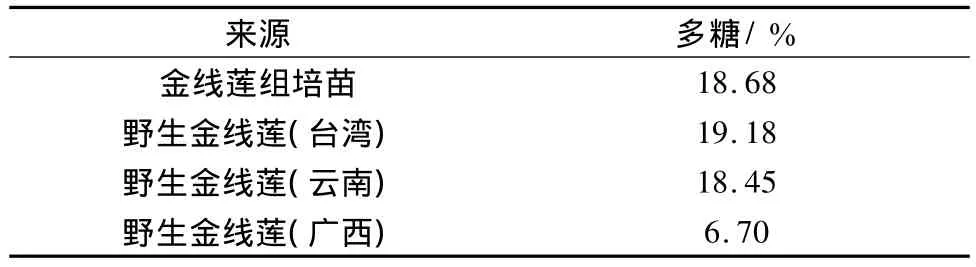
表1 不同来源金线莲总多糖量比较Tab.1 Comparative analysis of total polysaccharides in Anoectochilus roxburghii from different sources
3.2 金线莲组培苗与野生药材氨基酸比较 野生金线莲(台湾、广西)与金线莲组培苗的氨基酸测试结果见表2。比较显示,从组成成分来看,金线莲组培苗与其他不同来源金线莲野生药材中18种氨基酸及它们的量相近,其中以门冬氨基酸量最高,金线莲组培苗,台湾金线莲,广西金线莲的总氨基酸质量分数分别为9.17%、6.25%、6.30%。
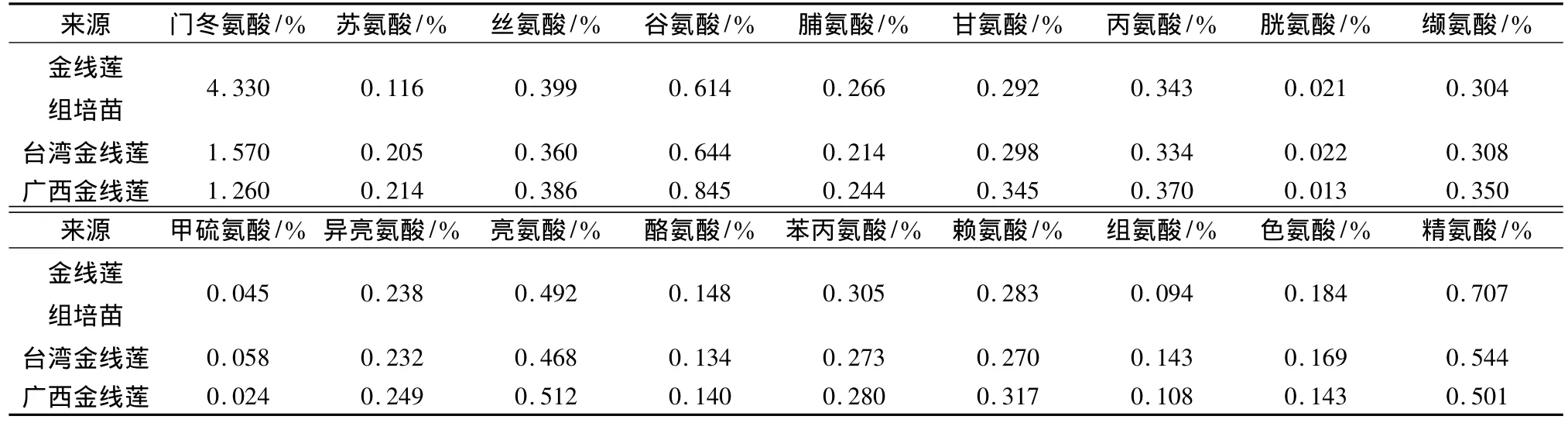
表2 不同来源金线莲氨基酸比较Tab.2 Comparative analysis of amino acids in Anoectochilus roxburghii from different sources
3.3 金线莲组培苗与野生药材黄酮比较 通过对金线莲组培苗与野生金线莲(台湾、云南、广西)有效成分总黄酮进行比较,发现组培苗植株总黄酮量与野生植株总黄酮量接近,见表3。
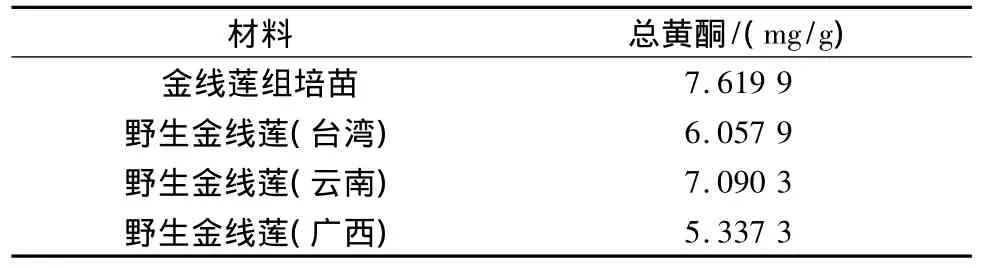
表3 不同来源金线莲总黄酮比较Tab.3 Comparative analysis of total flavonoid in Anoectochilus roxburghii from different sources
3.4 金线莲组培苗与原药材RAPD分析 采用CTAB法,提取了组培金线莲与野生金线莲的总基因组,从35个10-Mer随机引物中,筛选出8个有效引物,共检出85个不同的多态性条带,获得了清晰稳定重现性好的基因组DNA多态性指纹图谱,每个引物产生的标记数在5~19之间,具有良好的种内特异性。
3.5 DNA多态性分析 对35个随机引物进行筛选,选择出8个扩增效果、重复性均较好的引物进行拍照.从扩增的结果来看,不同的产地之间存在着明显的多态性,初步证明运用RAPD方法可以区分不同产地的金线莲。以引物 S-120(5′-GGGAGACATC-3′)的扩增结果为例,其扩增结果如图1所示。图1上显示金线莲组培苗的扩增多态性条带与野生金线莲(台湾)基本一致,由此可判断组培金线莲来源于野生金线莲(台湾),应为同一物种。

图1 用引物S-120扩增得到的RAPD图谱Fig.1 The RAPD patterns amplified by primer S-120
4 讨论
金线莲组培苗所含的总多糖、18种氨基酸的量(门冬氨酸例外)及总黄酮与野生金线莲(台湾)相近,这表明,在金线莲的野生种源储量日渐减少,已成为濒危的药用植物的情况下,采取组织培养方式解决中药金线莲药源问题是可行的。
RAPD分析显示金线莲组培苗的扩增多态性条带与野生金线莲(台湾)基本一致,说明采用RAPD方法可以鉴定出金线莲组培苗的来源。研究结果为药用植物组培苗的可持续开发和利用提供了科学的保证。同时,这一技术路线和方法的建立,为我国珍贵、稀有、濒危的地道药材的鉴定提供了一种新思路。
研究结果还表明,通过组织培养技术培养的金线莲,也具有较高的药用价值,不像人们认为的野生金线莲的有效成分远远优于人工培养金线莲的观点,甚至人工培养的金线莲在某些有效成分方面还具有一定的优越性。在目前金线莲药源紧缺的情况下,采用组织培养技术进行人工培养金线莲具有较好的应用前景。
[1]鲁成巍,冉景丞.金线莲研究进展及保护利用研究[J].农技服务,2010,27(8):1040-1042.
[2]王 航.金线莲有效成分的降血糖作用及其机制的研究[J].海峡药学,2009,21(12):46-48.
[3]王 勇.金线莲组织培养新体系建立及优化[J].北方园艺,2010,(13):178-179.
[4]吴艺东.金线莲组织培养及栽培技术研究[J].安徽农学通报,2009,15(15):46-46.
[5]胡国海,李洪潮,解成骏.云南文山人工种植金线莲中的微量元素含量测定[J].安徽农业科学,2010,(14):7294-7295.
[6]刘润东,郭文杰,林忠宁,等.金线莲组织培养及营养成分的分析研究[J].广西农业科学,2006,37(5):506-509.
[7]何铁光,苏 江,王灿琴,等.铁皮石斛不同来源材料多糖和氨基酸含量的比较[J].广西农业科学,2007,38(1):32-34.
[8]关 璟,王春兰,郭顺星,等.建金线莲总黄酮提取工艺的研究[J].中国药学杂志,2008,43(21):1615-1617.
[9]张志信,张 铁,赵保发,等.山野生金线莲总黄酮及多糖含量测定[J]. 时珍国医国药,2009,20(6):1362-1364.
[10]顾慧芬,庄意丽,梅其春,等.铁皮石斛试管苗的RAPD分析及其特异性鉴定引物设计[J].复旦学报,2007,46:(3)401-405.
[11]胡珊梅,张启国,周涵韬,等.RAPD法在金线莲的鉴别研究中的应用[J].中草药,2002,33(10):949-950.
[12]胡珊梅,张启国,袁文杰,等.珍稀中草药金线莲的RAPD研究[J].中草药,2000,31(12):944-946.
Comparison of effective components and RAPD between wild and tissue culture seedlings ofAnoectochilus roxburghii
GU Hui-fen1, ZHUANG Yi-1i1, MEI Qi-chun2
(1.Shanghai Institute of Chinese Materia Medica,Shanghai 201401,China;2.School of Life Sciences,Fudan University,Shanghai 200433,China)
AIMTo call for the feasibility study into the scheme for replacing wildAnoectochilus roxburghiiby the tissue culture seedlings.METHODSThe contents of ploysaccharides,amino acid and total flavonoids between wild and tissue culture seedlings ofAnoectochilus roxburghiiwere compared,and the random amplified polymorphic DNA(RAPD)was used to analyze both genetic relationship.RESULTSThe contents of ploysaccharides and total flavonoids in the tissue culture seedlings were similar to the wild species from Taiwan district,but the content of total flavonoids of the tissue culture seedlings reached 9.17%,was higher than that in the wild species.A specific primer selected to identify the original species of the tissue culture seedlings was found in the RAPD analyses.CONCLUSIONThe study preliminarily proved that replacing wildAnoectochilus roxburghiiby the tissue culture seedlings is feasible and it is possible to solve the shortage of wild resources in this species.
Anoectochilus roxburghii;tissue culture seedlings;polysaccharides;amino acid;total flavonoids;RAPD
R284.1
A
1001-1528(2011)08-1364-04
2010-01-25
上海市科委项目(02DZ19171)
顾慧芬(1960—),女,高级工程师,从事植物药资源及植物药分子研究。Tel:(021)37565589,E-mail:ghuif@126.com
