H-和L-铁蛋白在脑膜炎中抑制由于自由铁增高造成的脑损伤
2011-05-25任昊翟效月
任昊,翟效月
(中国医科大学基础医学院组织胚胎学教研室,沈阳 110001)
本实验室的前期实验表明,铁螯合剂去铁敏(desferoxamine,DFO)对大鼠实验性肺炎链球菌性脑膜炎具有保护作用[1]。作为一种可变价的过渡金属元素,铁也能够通过芬顿化学反应促进高活性羟自由基的形成而引起组织氧化损伤[2]。
铁蛋白(ferritin)是由重(H-)和轻(L-)链亚基构成的高分子蛋白,可存储高达4 500分子铁[3]。在不同的细胞类型中H-和L-铁蛋白比例不同。H-铁蛋白能够在应激的状态下迅速被合成,而L-铁蛋白负责机体内铁的长期储备。由铁蛋白结合的铁不能再参与生物化学反应,也就阻止了铁介导的自由基形成。在某些条件下,如在pH值下降,自由铁能够从铁蛋白释放出来,使非结合铁库容量升高,增加氧化损伤的风险[4]。
本研究在大鼠脑膜炎模型中铁稳态的变化和自由铁与铁蛋白的共存关系,分析8-羟基鸟苷酸等氧化损伤指标。揭示肺炎链球菌性脑膜炎的病理改变(特别是大脑过氧化损伤)和大脑皮质中自由铁的增加的关联。
1 材料与方法
1.1 动物模型
生后11 d的Wistar大鼠40只(瑞士伯尔尼大学动物中心),随机分为对照组和实验组(n=20)。5×106/mL肺炎链球菌(血清型3)在硬膜下感染动物,对照组注射等量生理盐水。18 h后对仔鼠进行临床分数评估,未感染鼠弃用(感染率大于95%)。动物用戊巴比妥麻醉,冰磷酸盐缓冲液灌流后解剖大脑立即液氮冷冻保存,用于定量分析。用于形态学研究的大脑用4%福尔马林左心室灌流固定后,常规石蜡包埋。
1.2 脑铁含量测量
自由铁的定量应用Ferene-S方法[5],使用商用试剂盒(DiaSys,Holzhelm,德国)。冰冻大脑皮质在冰Tris缓冲液中(pH值7.4)1∶2.5匀浆,离心。0.25 mL上清液与等量Ferene-S溶液在室温孵育20 min后,在波长595 nm处测定吸光度,按标准曲线计算自由铁含量。血浆及脑脊液的自由铁采用96孔板测量,使用同样比例的样本和试剂。
1.3 铁蛋白的免疫组织化学定位
脱石蜡切片用5%牛血清白蛋白封闭后,在一抗溶液中 37 ℃孵育 1 h(1∶100);H-和 L-型铁蛋白特异性抗体由Dr.James Connor提供(宾夕法尼亚州立大学,美国)。免疫反应使用由金属增强的链霉亲和素法,用化学发光剂二氨基联苯胺(diaminobenizidine,DAB)可视化[6]。
1.4 铁蛋白的免疫印迹定量分析
冷冻的大脑皮质组织按1∶9与蛋白酶抑制剂溶液混合匀浆(Rosche diagnosis,Basel,瑞士),离心后测定上清蛋白浓度。20μg蛋白上样,利用十二烷基硫酸钠聚丙烯酰胺凝胶(13%)电泳分离。分离蛋白被转移到聚偏氟乙烯膜上后在4℃下与抗体进行孵育。H-和L-铁蛋白一抗用1∶500浓度,二抗使用辣根过氧化物酶标记的兔IgG抗体(1∶10 000)。用增强化学荧光剂(enhanced chemiluminescence,ECL)可视化后进行定量分析。
1.5 免疫荧光分析RNA的原位氧化
为了分析RNA原位氧化,切片在单克隆抗体中孵育(15A3,QED,California,美国)。二抗使用 Alexa 488标记的羊抗鼠荧光抗体(1∶500)。为了去除DNA氧化信号,切片首先用DNase处理。为了尽量减少自然氧化干扰信号,脑切片和染色均在氩气Ar534中进行。
1.6 统计分析
数据分析采用Student t检验进行比较。P<0.05为差异有统计学意义。计量指标以x±s表示。
2 结果
2.1 脑膜炎大脑自由铁的改变
在感染后的几个时间点(图1)自由铁水平逐渐提高,相较于未感染对照组,在感染后22 h显著增加约1.5倍。相比之下,血浆及脑脊液在感染后自由铁含量与对照组未见统计学差异[(0.87±0.30)μg/mL与(0.29± 0.12)μg/mL]。这些结果表明,脑膜炎感染相关的自由铁的增加来源于大脑实质而不是血液。

图1 脑皮质自由铁随感染的时程变化Fig.1 Time course of cortical free iron production
2.2 免疫组织化学检测铁蛋白的分布特征和细胞定位
由于铁蛋白由H-和L-两种类型构成,本实验分别调查了他们在肺炎链球菌脑膜炎中的变化(感染后22 h)。H-铁蛋白在未受感染的动物大脑皮质中有中等程度的阳性染色(图2A)。感染引起了H-铁蛋白表达的显著增加,阳性信号主要分布在神经元胞体(图2B,实心箭头),血管(图2B,空心箭头)和皮质的神经小胶质细胞(图2B,三角)。L-型铁蛋白染色在未受感染的皮质相对较低(图2C)。受感染时,L-型铁蛋白染色在小胶质细胞中明显增加(图2D,三角),在血管上染色也略有增加(图2D,箭头)。
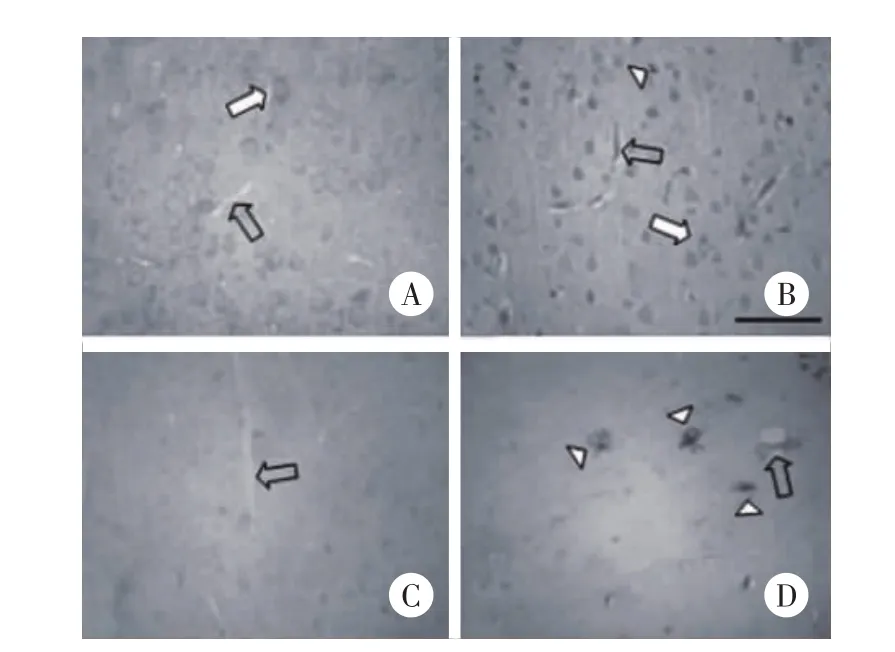
图2 H-和L-铁蛋白在脑膜炎大脑皮质的分布特征 ×400Fig.2 H-and L-ferritin expression pattern and cellular localization in the brain×400
2.3 铁蛋白表达的时程曲线
用Western blot检测的结果表明,伴随着感染的进程,H-和L-铁蛋白表达都上调,并且其时程变化曲线与自由铁增加的变化相吻合。H-型铁蛋白在感染后16 h达到高峰,与对照组比较显著增加达4倍,而L-型铁蛋白在8 h时与对照组比较差异有统计学意义。见图3。

图3 H-和L-铁蛋白含量在脑膜炎过程中的时程变化Fig.3 Time course of H-and L-ferritin protein expression
2.4 RNA氧化指标检测
利用免疫荧光定位分析发现,RNA氧化指标并没有随感染而改变。不论在经过DNase处理的(图4C,D)还是在没经过 DNase处理的(图 4A,B),脑切片中8-OhdG的阳性信号强度都不变。本实验应用DNase是为了去除DNA氧化信号的影响。

图4 未感染组和脑膜炎组大脑皮质内的RNA过氧化分析 ×400Fig.4 Effect of pneumococcal meningitis on cortical RNA oxida tion×400
3 讨论
细菌性脑膜炎仍然是威胁发展中国家婴幼儿生命的疾病之一[7]。本实验室前期的实验证明铁螯合剂去铁敏对细菌性脑膜炎有治疗作用。本研究结果表明脑膜炎伴随着大脑皮质自由铁的产生,该脑铁的增加是脑源性的,与血液和脑脊液无关。H-和L-型铁蛋白的增加可能通过结合大量的自由铁而保护大脑免于过氧化损伤。
已有研究表明,铁蛋白受铁离子的翻译后调控(post-translational regulation)[8],本实验室的结果也证明了这一点。在空间分布上,H-和L-型铁蛋白表达与自由铁在脑中的表达有共存性,即自由铁的增加主要表现在神经元,血管和小胶质细胞上,这与铁蛋白的表达吻合。该实验结果有力说明,增加的自由铁很可能是被增加的铁蛋白吸收而没有参与到自由基反应当中。RNA氧化实验结果进一步证明了这一点。
自由铁的来源有可能是通过血液里的外源性铁移动到大脑内的,但在血液和脑脊液中对自由铁的测量结果没有改变,因而排除了这种可能性。血红素结合的铁是组织内结合铁的另外一种形式,因此脑内自由铁可能来源于血红素铁的释放,即血红素氧合酶(hemoxygenase)分解血红素卟啉环释放出铁[9],该机制是否导致脑内自由铁的增加还有待进一步研究。
[1]Auer M,Pfister LA,Leib SL.Effectsof clinically used antioxidantsin experimental pneumococcal meningitis [J].Infect Dis,2000,182:347-350.
[2]Kakhlon O,Cabantchik Z.The labile iron pool:characterization,measurement,and participation in cellular processes[J].Free Radic Biol Med,2002,33:1037-1046.
[3]Cheepsunthorn P,Palmer C,Connor JR.Cellular distribution of ferritin subunitsin postnatal rat brain[J].Comp Neurol,1998,400:73-86.
[4]Connor JR,Menzies SL,Boyer PJ.Iron and iron management proteins in neurobiology[J].Pediatr Neurol,2001,25,118-129.
[5]Higgins T.Novel chromogen for serum iron determinations[J].Clin Chem,1981,27:1619-1620.
[6]Schaper M,Gergely S,Christen S.Cerebral vasculature is the major target of oxidative protein alterations in bacterial meningitis[J].Neuropathol Exp Neurol,2002,61:605-613.
[7]Cho TA,Venna N.Managementof acute,recurrent,and chronic meningitidesin adults[J].Neurol Clin,2010,28(4):1061-1088.
[8]Salvador GA.Iron in neuronal function and dysfunction[J].Biofactors,2010,36(2):103-110.
[9]Syapin PJ.Regulation of haemeoxygenase-1 for treatment of neuroinflammation and brain disorders[J].Br JPharmacol,2008,155(5):623-640.
