Lewisy抗原及α1,2-岩藻糖转移酶基因在卵巢癌细胞系中的表达
2011-05-25梁秀云林蓓刘娟娟高利利王燕燕刘大我严丽梅张淑兰
梁秀云,林蓓,刘娟娟,高利利,王燕燕,刘大我,严丽梅,张淑兰
(中国医科大学附属盛京医院妇产科,沈阳 110004)
卵巢癌发病率居女性生殖系统恶性肿瘤的第三位,近年有上升趋势。由于卵巢肿瘤发病和进展隐匿,确诊时70%已属晚期,晚期卵巢癌5年生存率仅约30%[1]。卵巢癌浸润、转移、耐药是造成卵巢癌治疗困难的主要原因。岩藻糖基可参与构成某些重要黏附分子的糖链结构,在肿瘤的增殖、黏附及转移机制上起重要作用[2~4]。Lewisy抗原是含有双岩藻糖的寡糖,一些肿瘤标志物的分子结构中如卵巢癌相关标志物CA125和MUC-1也含有Lewis y结构,说明Lewisy抗原与上皮性卵巢癌有关[5]。我们的前期工作中利用基因转染技术建立了α1,2-岩藻糖转移酶(α1,2-fucosyltransferases,α1,2-FT) 基因及Lewis y抗原高表达的卵巢癌细胞RMG-I-H,转染后细胞的恶性生物学行为明显增强[6]。由于Lewisy抗原位于细胞表面,在生物检测和生物治疗方面有着广阔的应用远景。
本研究通过检测α1,2-FT基因FUT1转染前后的人卵巢癌细胞系RMG-I和RMG-I-H、人卵巢癌高转移细胞系HO8910PM及亲本细胞系HO8910、人卵巢癌耐药细胞系COC1/DDP及亲本细胞系COC1中Lewis y抗原及FUT1基因的表达,进一步证明Lewis y抗原与肿瘤的耐药和转移关系,为我们进一步研究Lewis y抗原对卵巢癌细胞增殖的影响及作用机制,为研究卵巢癌的发生发展机制奠定基础,为卵巢癌的早期诊断及靶器官治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞系:人卵巢癌细胞系RMG-I细胞来自人卵巢透明细胞癌组织,由日本近畿大学岩森正男教授惠赠;RMG-I-H 细胞为 α1,2-FT(FUT1)及 Lewis y抗原稳定高表达卵巢癌细胞系,在我们前期研究中已建立[8];人卵巢癌细胞株HO8910PM、HO8910、COC1/DDP和COC1购于中国科学院上海细胞生物研究所。
1.1.2 主要材料与仪器:DMEM培养基、1640培养基、胎牛血清(美国GIBCO公司产品);鼠抗人Lewis y单克隆抗体(英国Abcam公司);TRITC标记的兔抗小鼠IgG抗体(DAKO公司产品);SP试剂盒(福州迈新公司);RT-PCR试剂盒(大连宝生物工程公司);Trizol试剂,PrimeScriptTMRTreagent kit、SYBR誖Premix Ex TaqTM购于大连TaKaRa生物工程公司;引物序列由上海Invitrogen公司合成;其余化学药品均为国产分析纯;台式低温超速离心机3-16K(美国Sigma-Aldrich公司);电泳仪(美国Bio-Rad公司);电泳槽(美国Bio-Rad公司);自动凝胶成像分析仪GDS8000(美国 UVP 公司);PCR 扩增仪(480,2400,9600型)(美国PerkinElmer公司);紫外分光光度仪(UV300,PYE-WNICAM/SPECTRONIC)(上海生物仪器厂);倒置显微镜及照相系统IX70(日本OLYMPUS公司)。
1.2 方法
1.2.1 细胞培养:RMG-I和RMG-I-H细胞在含10%胎牛血清的DMEM培养液中于37℃、5%CO2的培养箱中饱和湿度培养;HO8910PM和HO8910人卵巢癌细胞株接种于含10%小牛血清的RpMI1640培养液中,37℃,5%CO2培养箱中培养;COC1(悬浮生长)培养于37℃,5%CO2,含10%胎牛血清的1640培养液中。COC1/DDP(悬浮生长)顺铂耐药细胞株,应用药物连续作用并逐步提高药量的递增压力选择法,在同样的条件下使其能在0.5 pg/mL顺铂的1640培养液中稳定生长。
1.2.2 细胞总RNA提取:取以上6种细胞(各约1×107个细胞)加1 mLTRIZOL试剂,室温放置5~10 min以裂解细胞,收集裂解液于Eppendorf管,一步法提取细胞总RNA。紫外分光光度计测定RNA浓度和纯度。按照大连TaKaRa生物工程公司RNA逆转录试剂盒说明书合成cDNA。经紫外分光光度计测量cDNA浓度和纯度。证明合成的cDNA适用于下一步的实时PCR分析。
1.2.3 Quantitative RT-PCR检测:利用Quantitative RT-PCR测定以上6种细胞中FUT1基因及内源对照3-磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)基因表达水平。FUT1 PCR引物序列为 F:5′AGGTCATCCCTGAGCTGAAACGG 3′;R:5′CGCCTGCTTCACCACCTTCTTG3′。GAPDH引物序列为 F:5′GGACTTCGAGCAAGAGATGG3′;R:5′ACATCTGCTGGAAGGTGGAC3′。实时荧光定量PCR反应体系包括:SYBR誖Premix Ex TaqTM(2×)5 μl,PCR Forward Primer(5 μmol/L)0.5 μL,PCR Reverse Primer(5μmol/L)0.5μL,cDNA 1μL,dH2O 3 μL。反应条件为:95 °C 变性 20 s,60°C 退火 60 s,共45个循环。应用Light Cycler PCR检测系统(Roche Diagnostics,Mannheim,德国)进行 Real-time PCR 扩增并检测各范本的Ct值。扩增完毕后,进行溶解曲线分析。目的基因表达倍数的改变利用2-ΔΔCT法进行计算。2-ΔΔCT结果>1.4 或者<0.6 被认为是有意义。
1.2.4 RT-PCR检测:各取4μg总RNA逆转录合成cDNA,反应条件为50℃30 min,95℃5 min,5℃5 min。取逆转录产物2.5μL行PCR扩增,反应体系为:10×缓冲液2.5μL,2.5 mmol/L脱氧核苷三磷酸2 μL,5 U/μL 的 Taq聚合酶 0.2μL,上下游引物各 0.5 μL,cDNA 2.5μL,H2O 16.8μL,总体积 25μL;反应条件为:94℃,5 min后,94℃,40 s;退火温度,62℃,1 min;72℃,1 min,最后为 72℃,7 min,35循环。PCR产物在3.5%琼脂糖凝胶中进行电泳后,经电泳凝胶成像分析仪ALPHA IMAGER 5500拍照并分析处理。β-actin 引物序列为 F:5′GGACTT-CGAGCAAGAGATGG3′;R:5′ACATCTGCTGGAAGGTGGAC3′扩增片断长度,404 bp。
1.2.5 免疫细胞化学检测:取RMG-I-H和RMG-I、HO8910PM和HO8910细胞爬片,4%多聚甲醛固定。免疫细胞化学染色方法按SP试剂盒说明书进行。Lewis y单抗 AH6,1∶100稀释;IgM 二抗,1∶100稀释。以细胞质、细胞膜有棕黄色颗粒着色为阳性。实验重复3次。图像分析软件Meta Morph分析结果。
将悬浮细胞COC1/DDP和COC1分别放入离心管中,1 000 r/min离心5 min,用PBS洗2次,用少量的PBS把细胞涂于预先用多聚赖氨酸处理好的载玻片上,玻片待干燥时用4%多聚甲醛固定。其余步骤同上。
1.2.6 免疫细胞荧光检测:细胞爬片和涂片同免疫细胞化学。4%多聚甲醛固定20 min,用PBS洗2次,每次3 min,5%BSA封闭30 min,加入一抗(抗Lewisy 1∶100)。4℃过夜。二抗TRITC标记的兔抗小鼠IgG单抗,1∶50稀释,避光37℃1 h,暗室内40倍镜下拍照。
1.3 统计学处理
应用SPSS17.0统计分析软件,检测数据以x±s表示,两组间比较采用t检验,多组间比较采用方差分析。P<0.05认为差异有统计学意义。
2 结果
2.1 3对细胞系中Lewisy抗原的表达
SP染色结果表明,Lewis y分布于细胞膜和细胞质,Lewis y在 RMG-I、HO8910、COC1 细胞中染色阳性颗粒呈淡黄色,分布弥散,累积光密度分别为(32.18±0.64),(14.96±0.61)和(19.26±0.83)(图 1),在 RMG-I-H、HO8910PM和COC1/DDP细胞中,染色阳性颗粒呈棕黄色或棕褐色,分布广泛,其累积光密度分别为(53.90±4.33),(37.31±0.19)和(28.52±1.45)。均比相应的RMG-I、HO8910、COC1细胞明显增强(P均<0.05)。在相同的瀑布强度下免疫细胞荧光检测结果显示RMG-I-H、HO8910PM和COC1/DDP细胞中荧光强度明显强于RMG-I、HO8910、COC1细胞(图2)。
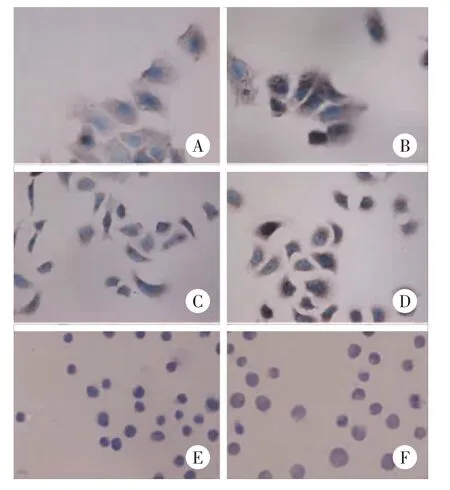
图 1 RMG-I和 RMG-I-H、HO98910和 HO8910PM、COC1和COC1-DDP细胞系中Lewis y的表达×400Fig.1 Lewis y expression in RMG-Iand RMG-I-H,HO98910 and HO8910PM,COC1 and COC1-DDP celllines×400

图 2 RMG-I和RMG-I-H、HO98910和HO8910PM、COC1和COC1-DDP细胞系中Lewis y的表达×400Fig.2 Immunofluorescence microscopy of Lewis y carbohydrate determinants from RMG-I-H and RMG-I,HO98910 and HO8910PM,COC1 and COC1-DDP ovarian carcinoma cells×400
2.2 3对细胞系中FUT1基因的表达
Real-time PCR检测结果证明,RMG-I-H细胞中FUT1的mRNA相对表达量较RMG-I细胞升高了3.07倍(P<0.05),HO8910PM细胞中的相对表达量较HO8910细胞升高了2.13倍(P<0.05),COC1/DDP细胞中相对表达量比COC1细胞升高了2.42倍(P<0.05)(表1)。RT-PCR检测结果显示RMG-I-H、HO8910PM和 COC1/DDP细胞中 FUT1基因的相对表达明显强于RMG-I、HO8910、COC1细胞中FUT1基因的表达(图3)。
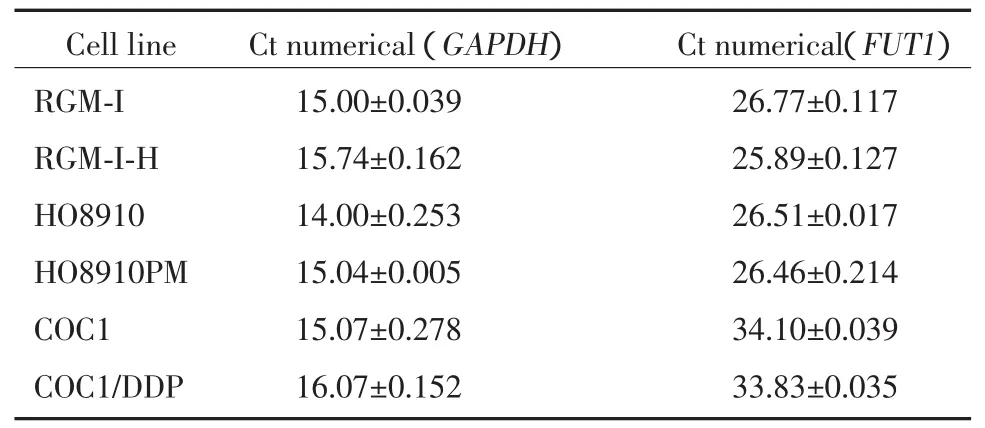
表1 实时定量PCR测定6种细胞中FUT1基因的表达水平Tab.1 Real-time PCR determine the gene expression of FUT1 in these six cells
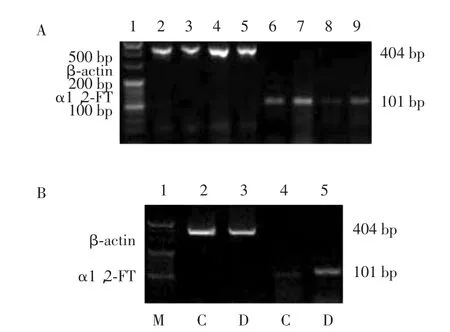
图 3 RMG-I和 RMG-I-H、HO8910和 HO8910PM、COC1和COC1/DDP中FUT1 mRNA的相对表达Fig.3 The mRNA expression of FUT1 in RMG-I and RMG-I-H,HO8910 and HO8910PM,COC1 and COC1/DDP cell lines
3 讨论
近年来,越来越多的研究表明糖复合物上的糖链结构参与调节细胞功能,如信号转导、分子黏附等,与细胞生长、凋亡、运动、分化等重要生命过程密切相关[8~10]。细胞癌变后细胞膜上的糖复合物、特别是糖链部分发生结构和量的变化。卵巢癌主要表现为Ⅱ型糖链的改变,如Lewisy抗原。研究表明75%的上皮性卵巢癌出现Lewis y不同程度的过量表达,且增高的患者预后不良[11,12]。
Lewis y抗原是某些糖蛋白和糖脂的末端寡糖,为双岩藻糖寡糖,其化学结构为[Fuc1→2Gal1→4(Fuc 1→3)GlcNAc],即糖链非还原末端的二糖-半乳糖-N-乙酰氨基葡萄糖(Gal-N-GlcNAc),在其外侧的半乳糖上连接有α1→2岩藻糖(Fuc)及α1→3岩藻糖(Fuc)而形成。研究证实,α1,2-FucT 中FUT1是Lewisy寡糖的特异性合成酶 FUT1[14]。
前期我们利用基因转染技术将FUT1导入人卵巢癌细胞系RMG-I,首次建立了α1,2-FT基因及lewisy稳定高表达的卵巢癌细胞模型RMG-I-H。并且证明在卵巢癌细胞RMG-I-H中,α1,2-FT基因及Lewisy抗原使其增殖、侵袭等恶性细胞生物学能力增加的同时,对卵巢癌化疗中的常用药物卡铂、5-氟尿嘧啶及紫杉醇的耐药性也提高[2,4,6]。基因转染后细胞系RMG-I-H与RMG-I相比,RMG-I-H中的多药耐药相关蛋白1、多药耐药相关蛋白2、蛋白激酶C-α及拓扑异构酶Ⅰ的基因表达均明显上调,在RMG-I-H及其裸鼠移植瘤中P-gp在基因和蛋白水平表达都明显增高[14]。Lewis y抗体能明显抑制体内外细胞的生物学特性的改变[15]。Chhieng等[16]用免疫组化法分别检测了在原发性卵巢癌及转移灶组的Lewisy表达,发现Lewisy抗原的表达在原发灶和转移灶无明显差异。这些结果证实,Lewisy抗原在卵巢癌的恶性生物学行为中扮演重要角色,与卵巢癌细胞耐药和转移能力有关。本实验结果表明,在RMG-I-H中,Lewisy抗原和FUT1基因高表达使其在增殖和耐药及侵袭能力上都比RMG-I增强;而人高转移卵巢癌细胞HO8910PM中,Lewis y抗原及FUT1基因的表达都较其亲本细胞HO8910中的表达量升高,Lewis y抗原升高1.6倍,FUT1基因升高2.13倍(P均<0.05);在人耐药卵巢癌细胞COC1/DDP中,Lewisy抗原及FUT1基因的表达量也较其亲本细胞COC1中的表达量升高,Lewis y抗原升高1.6倍,FUT1基因升高了2.42倍。FUT1基因及lewis y抗原高表达可导致肿瘤细胞增殖和耐药及侵袭能力增强,而在高转移能力及耐药的肿瘤细胞中同样检测到有FUT1基因及Lewis y高表达。不难推断FUT1基因及Lewisy抗原在卵巢癌细胞中的表达比较普遍,可能作为共性参与肿瘤的发生、发展及预后。
[1]刁斌,黄金双,林蓓,等.Ley抗原在卵巢上皮性肿瘤中的表达及意义[J].现代肿瘤学,2008,16(3):335-338.
[2]赵越,林蓓,郝莹莹,等.卵巢癌细胞系RMG-ILewis(y)抗原含量变化对其卡铂耐药性的影响[J].生物化学与生物物理进展,2008,35(10):1175-1182.
[3]Yam LM,Lin B,Zhu LC,et al.Enhancement of the adhesive and spreading potentials of ovarian carcinoma RMG-1 cells due to increased expression of integrin alpha5beta1 with the Lewis Y-structure on transfection of the alpha1,2-fucosyltransferase gene[J].Biochimie,2010,92(7):852-857.
[4]郝莹莹,林蓓,赵越,等.α1,2岩藻糖转移酶基因转染对卵巢癌细胞生物学行为的影响[J].分子细胞生物学报,2008,41(6):435-442.
[5]Yin BW,Finstad CL,Kitamura K,et al.Serological and immunochemical analysis of Lewis y (Ley)biood groud abtugen expression in epithelial ovarian cancer[J].Int JCancer,1996,8:65(4):406-412.
[6]Iwamori M,Tanoka K,Kubushiro K,et al.Alterations in the glycolipid compositon and cellular properties of ovarian carcinoma-derived RMG-1 cells on transfecton of the alpha 1,2-fucosyltransferase gene[J].Cancer Sci,2005,96(1):26-30.
[7]Lin B,Hao YY,Wang DD,et al.Transfection ofα1,2-fucosyltransferase gene increase the antigenic expression of Lewis y in ovarian cancer cell line RMG-I[J].Zhongguo Yi Xue Ke Xue Yuan Xue Bao,2008,30(3):284-289.
[8]Nonaka M,Ma BY,Murai R,et al.Glycosylation-dependent interactions of C-Type lectin DC-SIGN with colorectal tumor-associated lewisglycans impair thefunction and differentiation of monocyte-derived dendritic cells[J].Immunology,2008,180(5):3347-3356.
[9]Pai T,Chen Q.Galactomutarotase and other galactose-related genes arerapidly induced by retinoic acid in human myeloid cells[J].Biochemistry,2007,46(51):15198-15207.
[10]Aamoudse CA,Bax M.Glycan modification of the tumor antigen gp100 targets DC-SIGN to enhance dendritic cell induced antigen presentation to Tcells[J].Int JCancer,2008,122(4):839-846.
[11]Xie X,Boysen M,Clausen OP,et al.Endothelial cell adhesion molecules and cancer progression [J].Curr Med Chem,2007,14(4):377-386.
[12]Kobayashi H,Boelte KC,Lin PC,et al.Endothelial cell adhesion molecules and cancer progression [J].Curr Med Chem,2007,14(4):377-386.
[13]Zhang Y,Wang L,Jia XM,et al.Study of ABOblood group secretor typealpha(1,2)fucosy ltransferase gene polymorphism in Chinese[J].Yi Chuan Xue Bao,2002,29(11):949-952.
[14]刘晴,林蓓,刘娟娟,等.Lewis y抗原对人卵巢癌细胞RMG-I-H部分耐药相关蛋白基因表达的影响[J].中国医学科学院学报,2009,31(4):267-269.
[15]李飞飞,林蓓,郝莹莹,等.lewisy抗体对α1,2岩藻糖转移酶基因转染后卵巢癌细胞的体外抑制作用[J].细胞与分子生物学杂志,2008,24(3):267-269.
[16]Chhieng DC,Rodriguez-Burford C,Talley LI,et al.Expression of CEA,Tag-72,and Lewis-Y antigen in primary andmetastat-ic lesions of ovarian carcinoma[J].Hum Pathol,2003,34(10):1016-1021.
