核桃楸树皮乙醇提取物乙酸乙酯相的质谱分析Δ
2011-05-23张咏莉崔玉强石志强毛建文李红枝林桂芳冀军锋广东药学院广州市50006广州市黄埔区红十字会医院广州市50760广东中山市火炬开发区医院中山市587广东中山市尤利卡天然药物有限公司中山市587
张咏莉,崔玉强,石志强,毛建文,李红枝,林桂芳,冀军锋(.广东药学院,广州市 50006;.广州市黄埔区红十字会医院,广州市 50760;.广东中山市火炬开发区医院,中山市 587;.广东中山市尤利卡天然药物有限公司,中山市 587)
核桃楸(Juglans mandshurica Maxim.)为胡桃科胡桃属植物,属落叶乔木,异名有山核桃(《东北常用中草药手册》)、马核桃(《中国树木分类学》)及楸马核果(《中国药用植物图鉴》)等。核桃楸树皮主要含有胡桃醌和大量的鞣质,以及苷类和多缩戊糖等[1],核桃楸树皮中可能还含有黄酮类、生物碱、酚类、蒽醌及强心苷等物质[2]。近几年,不断有学者从中分离出新的活性成分[3,4],包括一些多酚及苷类成分,并显示出较好的生物学功能[5,6]。笔者通过分级萃取、硅胶柱分离和质谱分析,初步探索了萃取相中活性较高的成分组成,为进一步开发和利用核桃楸树皮的药用成分提供参考。
1 仪器与试药
1.1 仪器
Acquity UPLC-Q-Tof MICRO MS型液相色谱-质谱(GC-MS)联用仪(美国Waters公司);SB-5200DT型超声波清洗机(宁波新芝仪器公司);RE-52CS型真空旋转蒸发仪(上海亚荣生化仪器有限公司);HH-2型数显恒温水浴锅(郑州长城科工贸有限公司);超纯水仪(美国Milli-Q公司);台式高速离心机(德国Sigma公司)。
1.2 试药
供试药材采购自黑龙江省伊里嘎山,为晒干后天然制品,经黑龙江省药材公司刘丽萍药师鉴定为野生核桃楸(J.mandshurica Maxim.)树皮。无水乙醇、甲醇采购自江苏强盛化工有限公司,均为色谱纯;石油醚、乙酸乙酯、正丁醇、氯仿均采购自天津富宇精细化工有限公司,均为分析纯。
2 方法与结果
2.1 方法
2.1.1 萃取 将核桃楸树皮粉碎,取500 g树皮粉末用70%乙醇回流提取3次,第1次6 L回流3 h,后2次5 L回流2 h。合并提取液,减压浓缩,收集浸膏。用5倍水溶解,抽滤,保存滤渣。滤液分别用乙醚、乙酸乙酯、饱和正丁醇萃取,各相萃取10次,每次300 mL,合并各萃取液,旋转蒸发干燥。经过MTT细胞毒性筛查试验,确定乙酸乙酯萃取相抗肿瘤活性较高,故选取乙酸乙酯相进一步细分。
2.1.2 硅胶柱分离 取乙酸乙酯萃取相500 mg,溶于1 mL甲醇中,12000 r·min-1离心去不溶物,得深褐色浓缩液,湿法氯仿装柱,小心上样,保持柱面平整,纯氯仿洗脱,速度控制在每分钟100滴左右,可见一淡黄色条带出现,其后跟随有橙红色条带下移,持续用氯仿洗脱分别合并洗脱液,旋转蒸发浓缩,50℃真空干燥,分别得到供试品Ⅰ、Ⅱ。
2.1.3 MS条件 两供试品均用甲醇溶解,MS设定条件为毛细管电压:3500 V;锥孔电压:20 V;离子能量电压:2.0 V;离子源温度:120℃;脱溶剂温度:350℃;碰撞能量电压:10 V。
2.2 结果
乙酸乙酯萃取相经硅胶柱分离,分别得到2个条带,条带Ⅰ呈淡黄色,条带Ⅱ呈橙红色,分别收集浓缩。从阳离子质谱结果分析,两供试品成分可能较为复杂,供试品I中2个主要成分的质谱分子量在317和437左右;样品Ⅱ中3个主要成分的质谱分子量在303、437和453左右,其中质谱分子量303、317、437的组分在供试品Ⅰ和Ⅱ均有出现,详见图1、图2。
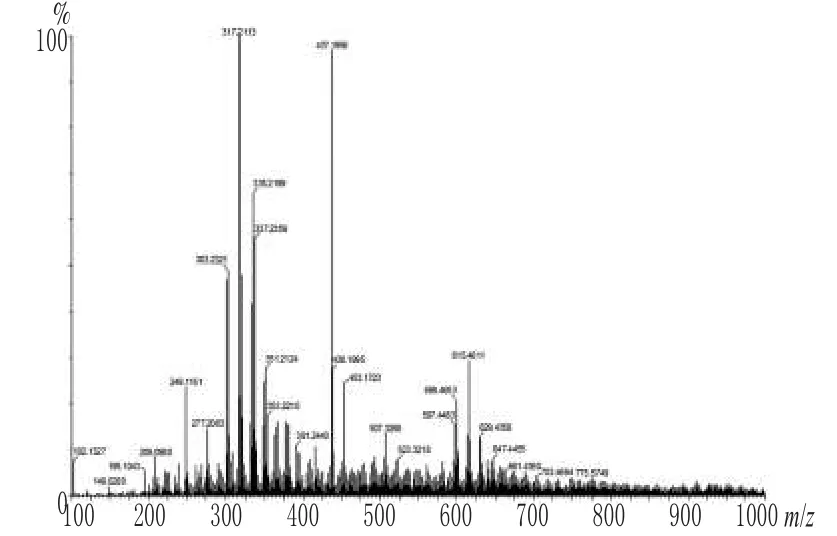
图1 供试品Ⅰ阳离子质谱图Fig 1 Positive ion mass spectrum of sampleⅠ

图2 供试品Ⅱ阳离子质谱图Fig 2 Positive ion mass spectrum of sampleⅡ
3 讨论
由阳离子质谱图可以看出,本次分离的两供试品Ⅰ和Ⅱ中,成分较为复杂,分子质量在303左右处,碎片峰有[M-H]-m/z 301,[M+H]+m/z 303,分子离子M+m/z 302。阮栋梁等[7]通过硅胶柱和葡聚糖凝胶柱层析,从沙棘叶子中分离并鉴定出黄酮类成分,并采用核磁和质谱分析技术对其结构进行了鉴定,并确认为是槲皮素。曾海波等[8]利用色谱技术从枸骨根中分离出1个黄酮类化合物,通过高分辨质谱以及核磁共振技术进行结构分析,表明该化合物是槲皮素。石建辉等[9]从核桃楸树皮中分离出槲皮素,分子式为C15H10O7,分子量302.23。黄酮类化合物质谱图中分子离子峰应为偶数,通常是以主峰的形式出现,而且必须是一个合理的分子量。如,黄酮、异黄酮类化合物分子量以222为基数;黄烷酮和查尔酮类化合物分子量为324;黄酮醇类化合物分子量为238;双氢黄酮类化合物分子量为240等。每加一个-OH就要增加16个质量单位,以此类推。因此,判断分子离子303[M+m/z 302]是黄酮醇类化合物增加了4个-OH。笔者由此推测供试品Ⅰ和Ⅱ中在303左右出峰的物质可能为槲皮素。在318左右处有碎片峰[M-H]-m/z 317,[M+H]+m/z 319,故分子离子为M+m/z 318,按照上述理论,M+m/z 318是黄酮醇类化合物增加了5个-OH。石建辉等[10]在核桃楸树皮乙酸乙酯萃取相中也分离到一种分子量为318的淡黄色粉末成分,通过色谱及核磁方法鉴定为一种黄酮化合物C15H10O8,即杨梅苷。因此,可初步推定此处成分可能为杨梅苷。分子离子为437及453未能查到与现有文献匹配,有可能是该树皮醇提物中的新化合物,且其相差16,可能也为黄酮类化合物,相差一个-OH,其结构式见图3。

图3 2种黄酮类化合物结构式Fig 3 Structural formula of 2 kinds of flarvanoid compound
综上所述,本研究采用醇提及溶剂分级萃取的方法提取核桃楸树皮醇提物中的有效成分,并采用硅胶柱层析法进行分离纯化,质谱法检测成分,对氯仿洗脱下的2个条带供试品进行了分析,推断其可能含有的主要成分为槲皮素和杨梅苷,同时发现2个不明成分,有必要通过更进一步的方法进行分离检测,从中分离得到新的成分。
[1]于海玲.核桃楸的研究进展[J].延边大学医学院学报,2005,28(2):154.
[2]李敬芬,谷艳玲.核桃楸树皮化学成分的研究[J].佳木斯医学院学报,1994,17(6):1.
[3]Machida K,Yogiashi Y,Matsuda S,et al.A new phenolic glycoside syringate from the bark of Juglans mandshurica MAXIM.var.sieboldiana MAKINO[J].J Natur Medic,2009,63(2):220.
[4]Ngoc TM,Hung TM,Thuong PT,et al.Antioxidative activities of galloyl glucopyranosides from the stem-bark of Juglansmandshurica[J].Biosci Biotechnol Biochem,2008,72(8):2158.
[5]崔玉强,张咏莉,林桂芳,等.核桃楸树皮化学成分及药物活性研究进展[J].海峡药学,2010,22(1):3.
[6]王金兰,田孝平,郭洪利,等.山核桃树皮中生理活性成分的研究[J].齐齐哈尔大学学报,2004,20(3):7.
[7]阮栋梁,王 晖,李 和.沙棘叶槲皮素的分离鉴定[J].沙棘,2003,16(1):26.
[8]曾海波,曾荣今,姚 飞.中药枸骨根中槲皮素的提取分离与鉴定[J].湖南工程学院学报,2010,20(2):60.
[9]石建辉,王金辉,袁 征,等.核桃楸皮的化学成分[J].沈阳药科大学学报,2006,23(8):501.
