马来酸桂哌齐特注射液细菌内毒素检查方法的建立
2011-05-23王宗春罗丽萍黄砚青武汉大学人民医院药学部武汉市430060
王宗春,罗丽萍,黄砚青(武汉大学人民医院药学部,武汉市 430060)
马来酸桂哌齐特注射液为无色澄明液体,临床主要用于治疗脑血管疾病(如脑动脉硬化、一过性脑缺血发作、脑血栓形成等)、心血管疾病(如冠心病、心绞痛、心肌梗死等)及外周血管性疾病。静脉用注射剂可以通过热原检查法(家兔法)判断其所含热原的限度是否符合规定,但是该法存在操作烦琐、费时费力及影响因素较多等缺点,而细菌内毒素检查法具有灵敏度高、简便易行及重现性好等优势,已被各国药典所采用。目前尚未有马来酸桂哌齐特注射液细菌内毒素检查的文献报道,笔者参照《中国药典》2010年版(二部)[1]以及《中国药品检验标准操作规范》2005年版[2]细菌内毒素检查法,建立了本品的细菌内毒素检查方法。
1 仪器与试药
1.1 仪器
恒温水浴箱(江苏南通嘉程仪器有限公司);微量取液器(上海金林生化试剂仪器厂,规格:50~250µL);SW-80A型旋涡混合器(上海医科大学仪器厂);细菌内毒素检查用具(厦门鲎试剂实验厂)。
1.2 试药
马来酸桂哌齐特注射液(北京四环制药有限公司,批号:20091210、20100123、20100309,规格:80 mg∶2 mL);细菌内毒素检查用水(BET水,厦门鲎试剂实验厂,批号:091107);细菌内毒素工作标准品(中国药品生物制品检定所,批号:2009-7,规格:每支10 EU);鲎试剂(TAL,厦门鲎试剂实验厂,批号:091149,标示灵敏度:0.5 EU·mL-1;批号:100101,标示灵敏度:0.25 EU·mL-1。湛江安度斯生物有限公司,批号:090325,标示灵敏度:0.5 EU·mL-1;批号:091124,标示灵敏度:0.25 EU·mL-1)。
2 方法与结果
2.1 细菌内毒素限值(L)的确定
细菌内毒素限值L=K/(M·f),式中K为人每1 kg体重每1 h最大可接受的细菌内毒素剂量,注射剂为5 EU·kg-1·h-1;M为人用每1 kg体重每1 h的最大供试品剂量。按照马来酸桂哌齐特注射液说明书中用法用量,每次4支(320 mg),稀释于10%葡萄糖注射液或生理盐水500 mL中,静脉滴注,并明确规定滴注速度为100 mL·h-1(即滴注时间为5.0 h),则M=320/(60×5.0)=1.067 mg·kg-1·h-1(人平均体重按60 kg计)。f为安全系数,由于本品用于心脑血管类疾病,考虑到葡萄糖注射液或生理盐水也可能含有细菌内毒素,为了严格质量标准和计算方便,将安全系数f定为4.7[3]。因此,本品的细菌内毒素限值L=5/(1.067×4.7)=1.0 EU·mg-1。
2.2 样品最小有效稀释浓度(c)的确定
样品最小有效稀释浓度c=λ/L,其中L为细菌内毒素限值,即1.0 EU·mg-1,λ为鲎试剂灵敏度。目前市售的鲎试剂的λ常为 0.5、0.25、0.125、0.06、0.03 EU·mL-1,对应的样品最小有效稀释浓度为0.5、0.25、0.125、0.06、0.03 mg·mL-1。
2.3 TAL灵敏度复核
按《中国药典》2010年版(二部)附录ⅪE“细菌内毒素检查法鲎试剂灵敏度复核项”[1]进行操作,其中阴性对照(NC)管操作方法:向分装有0.1 mL TAL溶液的试管内加入BET水0.1 mL,依法操作,结果见表1(表中“-”表示未形成凝胶或形成的凝胶不坚实、变形并从管壁脱落,即反应呈阴性;“+”表示管内形成凝胶,并且凝胶不变形、不脱落,即反应呈阳性。以下各表同)。
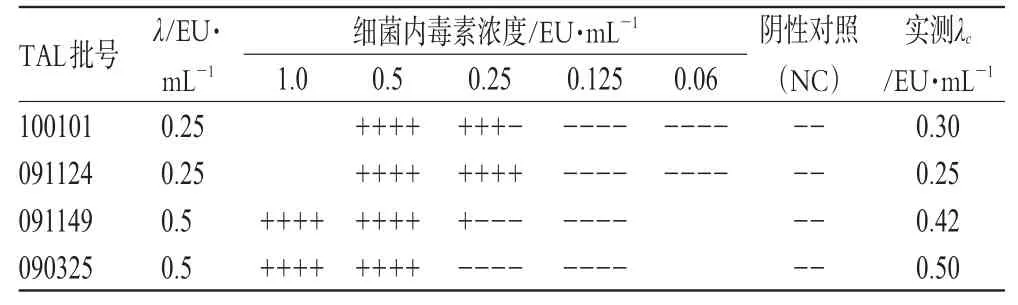
表1 TAL灵敏度复核结果Tab 1 The checking results of tachypleus amebocyte lysate’s sensitivity
表1结果表明,4个批号的TAL灵敏度测定值λc均在0.5 λ~2.0 λ之间,符合规定,可用于试验。
2.4 干扰预试验[4~6]
用BET水将马来酸桂哌齐特注射液分别稀释至质量浓度为0.5、0.25、0.125、0.06、0.03 mg·mL-1的系列溶液,测得pH值在6.8~7.2范围内,符合细菌内毒素检查的pH值要求,作为供试品阴性对照(NPC)系列。另制备同样浓度的供试品系列溶液,使每一浓度下的供试品溶液中都含有2 λ(λ为0.5 EU·mL-1)细菌内毒素,作为供试品阳性对照(PPC)系列。每一供试品浓度重复2管,按常规设立阳性对照(PC)管和阴性对照(NC)管。用2个不同厂家生产的鲎试剂(λ为0.5 EU·mL-1)与上述系列溶液进行反应,结果见表2。
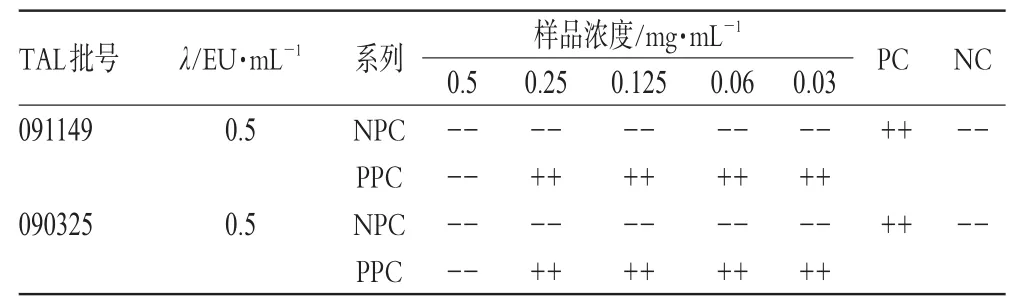
表2 样品干扰预试验结果Tab 2 Results of interference pretest of samples
由表2可知,2个厂家的TAL所能得到的最大不干扰浓度是一致的,即质量浓度为0.5 mg·mL-1的供试品溶液对TAL与细菌内毒素之间的凝集反应有抑制作用,但当样品稀释至0.25 mg·mL-1及以下浓度时,抑制作用消失。
2.5 干扰试验
根据干扰预试验结果,用质量浓度为0.25 mg·mL-1的供试品溶液及BET水分别稀释细菌内毒素工作标准品,制备成细菌内毒素最终浓度分别为0.5、0.25、0.125、0.06 EU·mL-1的系列溶液,分别取0.1 mL加入到已复溶的2个不同厂家生产的TAL(λ为0.25 EU·mL-1)管内,每个浓度平行做4管,另取供试品溶液做2支NC管,进行干扰试验,结果见表3。
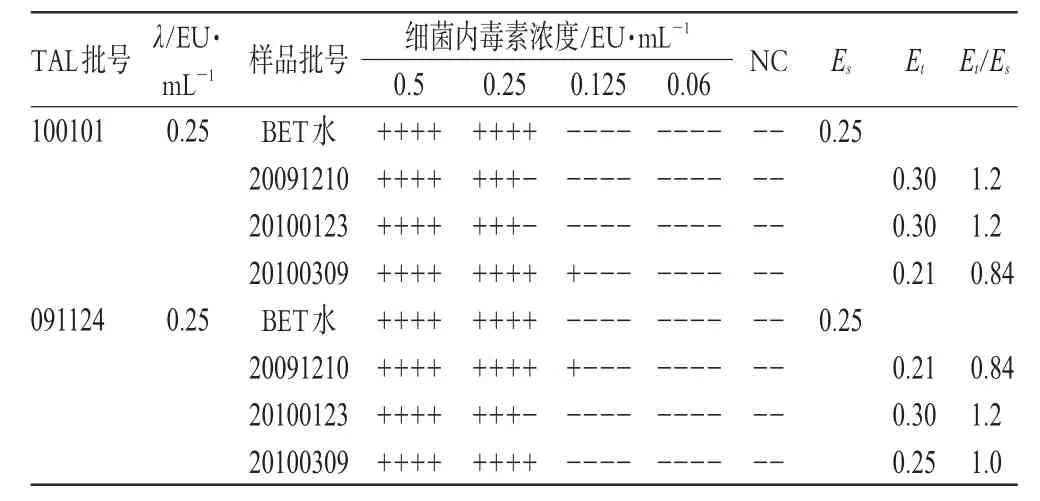
表3 样品干扰试验结果(0.25 mg·mL-1)Tab 3 Results of interference test of samples(0.25 mg·mL-1)
表3结果显示,Et/Es在0.5~2之间(Es为用BET水制成的细菌内毒素标准溶液反应终点浓度的几何平均值,Et为用供试品溶液制成的内毒素标准溶液反应终点浓度的几何平均值),按照《中国药典》2010年版(二部)判断标准,质量浓度为0.25 mg·mL-1的供试品溶液对TAL与细菌内毒素之间的凝集反应无干扰,细菌内毒素检查法适用于马来酸桂哌齐特注射液。
2.6 样品细菌内毒素检查
取3批马来酸桂哌齐特注射液(每批各取5支),制备成质量浓度为0.25 mg·mL-1的溶液,使用2个厂家生产的TAL(灵敏度λ均为0.25 EU·mL-1),按《中国药典》2010年版(二部)附录细菌内毒素检查法进行操作,并分别用BET水制备的细菌内毒素溶液(0.5 EU·mL-1)和BET水设立PC管和NC管,检查结果见表4。
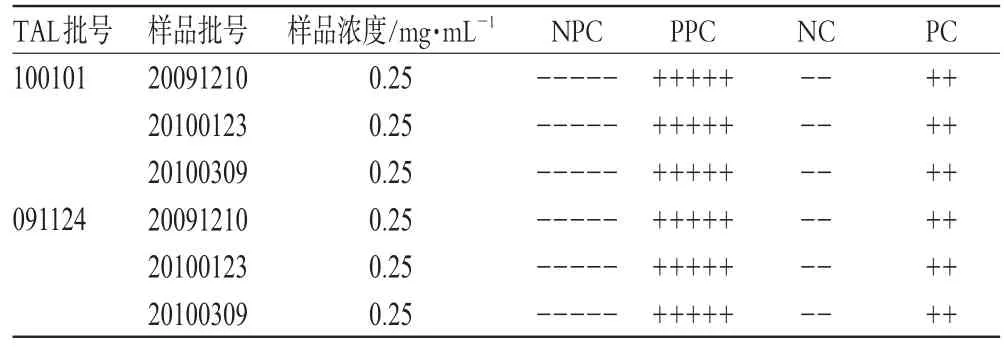
表4 样品细菌内毒素检查结果Tab 4 Results of bacterial endotoxins test of samples
表4结果表明,3批样品的细菌内毒素检查均符合规定。
3 讨论
细菌内毒素检查法中要求供试溶液的pH值在6.0~8.0范围内,过酸、过碱的供试品需调节其pH值。因此,在试验中用pH计测定了质量浓度为0.5、0.25、0.125、0.06、0.03 mg·mL-1的样品的pH值,结果均在6.8~7.2之间,不需调整,可直接用于细菌内毒素检查。
由表2干扰试验结果可以看出,将3批样品稀释至质量浓度为0.25 mg·mL-1,分别使用2个不同厂家生产的TAL(灵敏度均为0.25 EU·mL-1)进行干扰试验,其Et/Es均在0.5~2.0范围内,说明样品在该浓度下不干扰细菌内毒素检查。根据以上试验结果,确定马来酸桂哌齐特注射液的细菌内毒素检查方法如下:将本品稀释至质量浓度为0.25 mg·mL-1,依照《中国药典》2010年版(二部)附录细菌内毒素检查法进行检查,细菌内毒素限值定为1.0 EU·mg-1。
综上所述,建立的细菌内毒素检查方法可行,可用于马来酸桂哌齐特注射液的检查。
[1]国家药典委员会编.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:附录99-102.
[2]中国药品生物制品检定所.中国药品检验标准操作规范[S].北京:中国医药科技出版社,2005:287.
[3]黄清泉,夏振民.药品细菌内毒素检查的实验设计[J].中国药学杂志,1997,32(2):72.
[4]潘卫松,肖 瑛,潘建明.荧光素钠注射液细菌内毒素检查法的研究 [J].中国药房,2009,20(13):1010.
[5]刘 春,赵毓梅.马来酸氯苯那敏注射液的细菌内毒素检查[J].中国药房,2009,20(25):1990.
[6]蔡 慎,郑英丽,陈宝玲,等.复方钾钙镁液中细菌内毒素检查法的可行性研究[J].中国药房,2010,21(21):1997.
