HPLC法测定维格列汀片中主药和有关物质的含量
2011-05-23李燕赵春才刘艳艳南京医科大学附属南京儿童医院南京市10008南京安格医药化工有限公司南京市10009
李燕,赵春才,刘艳艳(1.南京医科大学附属南京儿童医院,南京市 10008;.南京安格医药化工有限公司,南京市 10009)
维格列汀[1]是Ⅳ型二肽基肽酶(DPP-4)抑制剂,通过与DPP-4结合形成DPP-4复合物而抑制该酶的活性,在提高胰高血糖素样多肽(GLP)-1浓度、促使胰岛B细胞产生胰岛素的同时,可降低胰高血糖素浓度,从而降低血糖,且对体重无明显影响。维格列汀片由诺华公司研发,2007年9月由欧盟委员会批准上市,商品名为Galvus。维格列汀片的含量及有关物质测定目前未见有文献报道,为此,本文建立了高效液相色谱(HPLC)法测定其主药和有关物质含量,为其质量评价和标准的建立提供科学依据。
1 仪器与试药
1.1 仪器
HPLC仪,包括LC-10ATvp泵、SPD-10Avp紫外检测器、UV-2401PC紫外-可见分光光度计(日本Shimadzu公司)。
1.2 试药
维格列汀片(南京安格医药化工有限公司制剂室,批号:100316、100317、100318,规格:每片50 mg);维格列汀对照品(南京安格医药化工有限公司合成室,由批号为100302的原料药精制而成,含量:99.64%);乙腈为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱:Phenomenex Luna C18(250 mm×4.6 mm,5µm);流动相:0.01 mol·L-1磷酸氢二钾溶液-乙腈(75∶25);流速:1.0 mL·min-1;检测波长:210 nm;进样量:20 μL。
2.2 溶液的制备
2.2.1 供试品与对照品溶液:取样品片剂研成的粉末适量,约相当于维格列汀25 mg,精密称定,置于100 mL容量瓶中,用流动相溶解并稀释至刻度,过滤;取续滤液5.0 mL,置于10 mL容量瓶中,加流动相稀释至刻度,摇匀,作为供试品溶液;另取维格列汀对照品,同法用流动相溶解并制成每1 mL中含125 μg的溶液作为对照品溶液。
2.2.2 有关物质溶液:取样品片剂研成的粉末(辅料不干扰测定)适量,用流动相制成维格列汀浓度为0.25 mg·mL-1的溶液作为供试液;取该液适量,用流动相稀释制成2.5 μg·mL-1的溶液作为对照液。
2.3 系统适用性试验
精密量取“2.2.1”项下对照品、供试品溶液各20 μL,按“2.1”项下色谱条件进样,并以空白辅料的流动相溶液作为阴性对照,进样分析。结果,在上述色谱条件下,维格列汀的理论板数为7293,保留时间为7.535 min,峰形对称,详见图1。
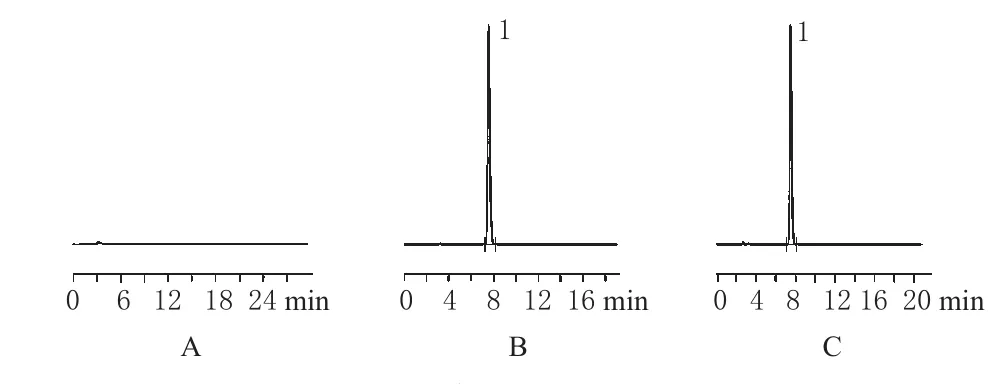
图1 高效液相色谱图A.阴性对照;B.对照品;C.供试品;1.维格列汀Fig 1 HPLC chromatogramsA.blank excipients;B.reference substance;C.test sample;1.vildagliptin
2.4 线性关系与定量限考察
取维格列汀对照品,用流动相溶解并稀释成浓度分别为225.0、175.0、125.0、75.0、25.0 μg·mL-1的溶液,分别精密量取上述溶液各20 μL注入液相色谱仪,记录色谱。以进样浓度(c)为横坐标,维格列汀的峰面积(A)为纵坐标进行线性回归,得回归方程为A=2.1654×104+3.5916×104c(r=0.9999,n=5)。表明维格列汀检测浓度的线性范围为25.0~225.0 μg·mL-1。以信噪比S/N=10计算,得维格列汀定量限为8 ng。
2.5 精密度试验
取维格列汀对照品适量,按“2.2.1”项下方法制备对照品溶液,连续进样6次进行测定。结果,峰面积值的RSD=0.21%。
2.6 重复性试验
精密称取同批样品6份,按“2.2.1”项下方法制备供试品和对照品溶液,各进样20 μL;在上述色谱条件下,分别测定每份样品的含量。结果平均含量为99.46%,RSD=0.38%,表明本方法重复性良好。
2.7 稳定性试验
取供试品溶液1份,在0、1、2、4、6 h分别进样20 μL,测定,以峰面积计算RSD为0.19%,结果表明,供试品溶液在6 h内相对稳定。
2.8 回收率试验
取同批样品,按测试浓度的80%、100%、120%3个浓度分别加入维格列汀对照品,每个浓度3份,照“2.9”项下“(1)”项方法操作,计算回收率,结果详见表1。
2.9 样品含量测定
(1)主药含量:取维格列汀片研成的粉末及对照品适量,按“2.2.1”项下方法分别制备成供试品、对照品溶液。分别精密量取20 μL注入液相色谱仪,记录峰面积,并按外标法以峰面积计算含量,结果详见表2。

表1 回收率试验结果(n=9)Tab 1 Results of recovery tests(n=9)
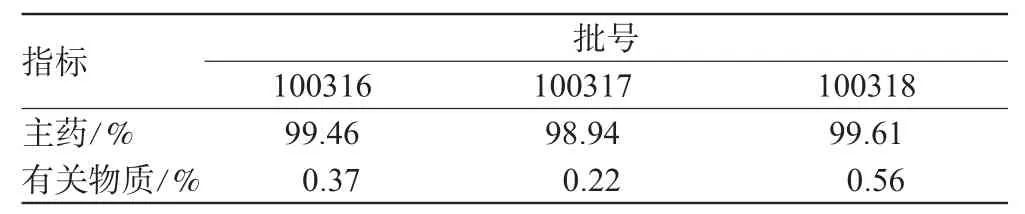
表2 样品中主药及有关物质含量测定结果Tab 2 Content determination of vildagliptin and the related substances in samples
(2)有关物质含量:取维格列汀片研成的粉末适量,按“2.2.2”项下方法制备成供试液和对照液。量取对照液20 μL注入液相色谱仪,调节仪器检测灵敏度,使维格列汀峰峰高为满量程的10%~30%;再量取供试液20 μL注入液相色谱仪,记录色谱至主峰保留时间的3倍,记录主峰和有关物质的峰面积,按1%自身对照法计算有关物质的含量,结果详见表2。
3 讨论
3.1 检测波长的选择
取维格列汀对照品及片剂研成的粉末适量,分别用流动相制备成浓度约20 μg·mL-1的对照品、供试品溶液,按紫外分光光度法[2]操作,于190~400 nm波长范围内进行测定。结果,对照品、供试品溶液均于210、265 nm波长左右有最大吸收,但265 nm波长处响应值只有0.102,且前一步中间体在此波长下仅有末端吸收;而辅料溶液在210 nm波长处无吸收,故检测波长选为210 nm。
3.2 流动相的选择
通过对维格列汀及其各步中间体及破坏后样品的测定,发现采用浓度为0.01 mol·L-1的磷酸氢二钾溶液-乙腈(75∶25)为流动相时,维格列汀的峰形对称,与其有关物质、各步中间体和降解产物均能得到很好的分离,但由于有关物质含量较少,所以在色谱上不能明显表示,故未列出相应色谱图。通过对维格列汀原料药的分析,其纯度为99.08%,通过重结晶精制,纯度达到99.64%。
综上所述,本方法操作简便、快捷,结果准确、可靠,可有效测定维格列汀片中的主药和有关物质的含量,适用于控制该制剂质量。
[1]樊新星,徐 珽,卢 静,等.抗糖尿病新药维格列汀[J].中国新药杂志,2008,17(14):1272.
[2]国家药典委员会编.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:附录ⅣA.
