奶牛乳房炎乳中结合珠蛋白含量的夹心ELISA检测方法研究
2011-05-21李庆章
杨 宇,吕 英,石 晶,李庆章
(东北农业大学乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
乳房炎对奶牛的健康和产奶量有一定的影响,因此建立一种简单、准确、快速、有效的乳房炎诊断方法是十分必要的。奶牛乳房炎与细菌感染密切相关,奶牛受感染乳区在炎症期间能够产生急性期蛋白[1-3]。结合珠蛋白(Haptoglobin,Hp)是一种奶牛乳房炎期间重要的急性期蛋白,其血液和乳汁中含量变化与乳房炎患病情况密切相关。Hp作为新发现的乳房炎诊断敏感性指标,在乳房炎的诊断中具有一定的应用价值和应用前景[4-6]。目前对乳房炎的诊断一般采用物理和化学的方法,乳房炎期间乳清中Hp含量检测方法国内尚未报道。
Hp是一种能够和血红蛋白(Hemoglobin,Hb)特异性结合形成稳定化合物的糖基化蛋白[7]。研究表明,牛奶中Hp仅来源于肝细胞Hp产物,但是近期研究表明,Hp mRNA也可以在乳腺中翻译,并且Hp可在乳腺中表达[8]。因此可以利用检测牛奶中Hp含量确定奶牛患乳房炎的情况。本研究基于商品化抗体,利用血红蛋白与结合珠蛋白特异性结合的原理,建立夹心ELISA检测Hp含量方法,从而为Hp夹心ELISA检测试剂盒的提供试验方法。
1 材料和方法
1.1 样品采集及制备 选取黑龙江省哈尔滨市周边奶牛场处于相同生理水平(年龄、泌乳期和产奶量)的荷斯坦奶牛,无菌采集牛奶样品,每头奶牛采集牛奶样品100 mL,50 mL用于体细胞数,50 mL保存于4℃,12000 r/min离心30 min,乳清-20℃保存备用。
所有牛奶样品应用体细胞计数法(SCC)计数。按照文献[9-11]的判定标准判定样品:SCC<200×103cells/mL样本定为健康样本;200×103cells/mL
1.2 主要试剂及试剂盒 牛血清白蛋白(BSA)和4-硝基苯基磷酸二钠盐(pNPP)均购自Sigma公司;Hp标准品和牛Hp-ELISA检测试剂盒(酶标板,牛Hp标准品,HRP标记抗Hp抗体,底物显色液,终止液)均购自美国R&D公司;山羊抗牛Hp多抗购自Innovative公司;碱性磷酸酶(AP)标记兔抗山羊酶标抗体购自北京中杉生物公司;FOSSMATIC 5000系列体细胞快速测定仪为丹麦福斯公司产品。
1.3 ELISA操作程序 用0.01 mol/L碳酸盐缓冲液(pH9.5)稀释牛Hb包被酶标板,4℃过夜,37℃1 h,加入Hp标准品溶液和待检乳清(100 μL/孔),37℃1 h,加入山羊抗牛 Hp多抗(100 μL/孔),37℃1 h,加入AP标兔抗山羊酶标抗体(100 μL/孔),37℃1 h,加入底物溶液(100 μL/孔),室温避光30 min,NaOH(100 μL/孔)终止反应;使用酶标仪测定OD405nm值。在OD405nm值接近1.0时,P/N值>2.1并呈现最大的反应条件为确定ELISA反应条件的参考依据。
1.4 ELISA反应条件的确定
1.4.1 牛Hb包被条件的确定 牛Hb结合Hp四聚体的能力为1∶1.1和1∶1.4[12],因此本实验分别以10%、20%和50%的牛Hb包被酶标板,分别于37℃1 h、37℃2 h和4℃孵育过夜。
1.4.2 封闭液和封闭时间的确定 分别以1%、2%和3%BSA作为封闭液,37℃分别作用1、2和3 h,测定其OD405nm值,选择最佳封闭液和封闭时间。
1.4.3 多抗和乳清工作浓度及作用时间的确定 以10%Hb包被酶标板,4℃过夜。进行ELISA检测,加入经稀释的多抗(1∶600~1∶4800)和乳清(1∶5~1∶50)。选择OD405nm值接近1.0,并且抗体与阳性、阴性乳清P/N最大的多抗工作浓度和乳清稀释度。
1.4.4 酶标抗体工作浓度及作用时间的确定 选择1∶200~1∶800 稀释度,37 ℃孵育 0.5 h~2 h,选择OD405nm值接近1.0,并且抗体与阳性、阴性乳清P/N最大的酶标抗体最适稀释度和作用时间。
1.4.5 底物显色时间和终止液浓度的确定 加底物后5 min~15 min,分别用1 mol/L~3 mol/L NaOH终止反应选择最适底物显色时间和终止液浓度。
1.5 ELISA检测下限(LOD)的确定 根据优化的条件,进行ELISA反应,以系列稀释度2.5 g/mL~0.08 μg/mL的Hp标准液建立标准曲线。以Hp浓度为横坐标,OD405nm值为纵坐标,绘制标准曲线,建立回归方程。LOD为在标准曲线上对应的Hp浓度值。
1.6 ELISA检测灵敏度的测定 从标准曲线的LOD继续倍比稀释测定OD值,确定本实验ELISA检测灵敏度。
1.7 精确度的测定 以批内和批间差表示该方法的精确度。将每一标准品浓度重复检测4次,计算孔间变异系数表示批内差;使用同质量的不同酶标反应板重复操作3次,计算批间变异系数表示批间差。
1.8 交叉反应试验 应用本实验建立的ELISA方法对乳房炎期间的主要急性期蛋白:Hp、MPO和牛IgG标准品进行交叉反应试验,以确定ELISA检测的特异性。
1.9 酶标包被板稳定性测定 将按最佳浓度包被好的酶标板置于4℃下0~6个月,按ELISA过程操作检测其OD405nm值。
1.10 奶牛乳清样本的测定 选取50份SCC法检测患有乳房炎疾病奶牛的乳清样品,分别应用本方法与牛Hp-ELISA检测试剂盒检测样品中Hp含量。
1.11 数据分析 使用SPSS 17.0软件分析本方法和牛Hp-ELISA检测试剂盒的检测数据,比较两者的相关性。
2 结果
2.1 SCC测定乳房炎 使用丹麦福斯公司FOSSMATIC 5000系列体细胞快速测定仪测定290个样品,根据SCC将检测样本分为3组,各组检出样本数量中,健康样品居多(表1)。
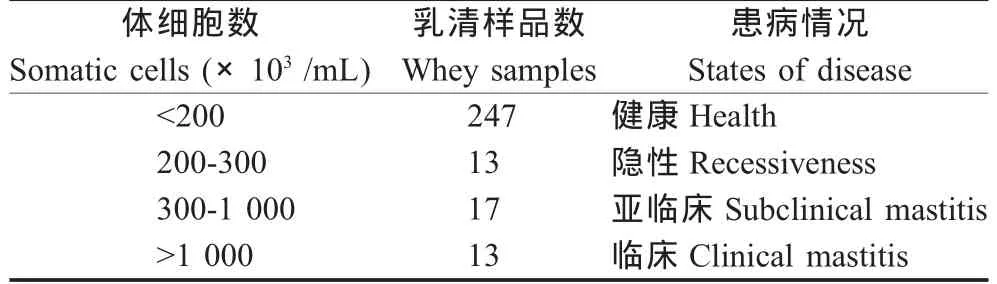
表1 SCC分组及患病情况Table 1 The groups by SCC and the states of disease
2.2 ELISA反应条件的确定 对ELISA各项条件进行优化,确定最佳反应条件为:10%Hb包被酶标板,4℃过夜;BSA工作浓度为2%,37℃1 h;最佳样本稀释度为乳清1∶10稀释,多抗工作浓度为1∶1000;最佳酶标抗体工作浓度为1∶500,37℃1 h,最佳显色时间为15 min,2 mol/L NaOH终止反应。
2.3 ELISA LOD的确定 根据试验数据绘制标准曲线,得到回归方程为y=0.1526x+0.2037,R2=0.97。检测下限 LOD=0.08 μg/mL,线性范围为0.08 μg/mL~2.50 μg/mL(图 1)。

图1 Hp标准曲线Fig.1 Hp standard curve
2.4 ELISA检测灵敏度的测定 本研究建立的夹心ELISA法的灵敏度结果表明,当Hp抗原稀释至0.08 μg/mL时 P/N>2.1,而当 Hp抗原稀释至0.04 μg/mL时P/N<2.1,因此该方法对Hp的检测灵敏度为 0.08 μg/mL(表 2)。
表2 灵敏度试验结果Table 2 Results of sensitivity experiment(±SD,n=5)
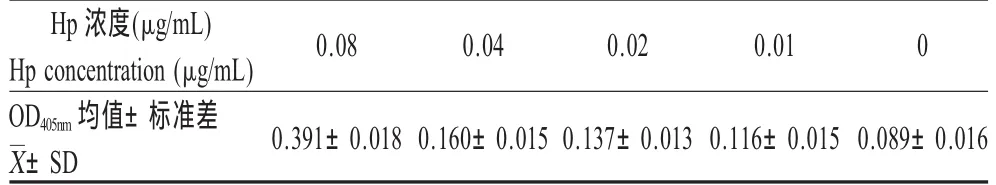
表2 灵敏度试验结果Table 2 Results of sensitivity experiment(±SD,n=5)
Hp浓度(μg/mL)0.080.040.020.010 Hp concentration(μg/mL)OD405nm均值±标准差0.391±0.0180.160±0.0150.137±0.0130.116±0.0150.089±0.016
2.5 精确度的确定 由Hp标准品建立的标准曲线批内、批间误差试验结果表明,在线性范围内标准品浓度的批内变异系数为3.27%~4.98%,批间变异系数为5.46%~8.31%(表3)。
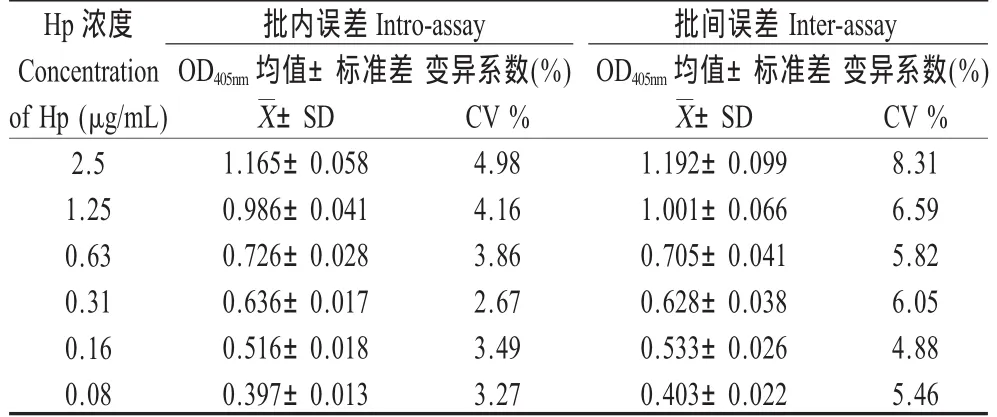
表3 夹心ELISA批内误差和批间误差试验Table 3 Intro-assay and Inter-assay test of the sandwich ELISA
2.6 交叉反应试验 应用本实验建立的ELISA方法对乳房炎期间的主要急性期蛋白:Hp、MPO和牛IgG标准品进行交叉反应试验。除Hp呈阳性外,其余均呈阴性,表明本实验具有良好的特异性。
2.7 酶标包被板稳定性测定 稳定性试验表明,包被酶标板在4℃下可保存6个月,测定OD405nm值变化较小,说明包被板具有良好的检测稳定性(表4)。
表4 Hb包被酶标板稳定性试验结果Table 4 The resuls of stability of plate coated with Hb(±SD,n=5)

表4 Hb包被酶标板稳定性试验结果Table 4 The resuls of stability of plate coated with Hb(±SD,n=5)
月数01246 Months OD405nm均值±标准差0.891±0.0140.887±0.0140.880±0.0160.879±0.0170.881±0.018
2.8 奶牛乳清样本的测定 选取50份根据SCC分组的乳清样本,分别应用本实验建立的夹心ELISA法和牛Hp-ELISA检测试剂盒检测乳清中Hp含量,结果表明,两种方法检测牛奶中Hp含量均与牛奶SCC成正比(表5),证实牛奶中Hp含量与乳房炎的患病情况呈正相关。
2.9 数据分析 使用SPSS 17.0数据统计分析软件对2.7测定样本数据进行分析,以ELISA检测结果为纵坐标,以ELISA试剂盒检测结果为横坐标做线性回归分析。回归方程为:y=1.0293x+0.0886(R2=0.9962)(图2)。表明本实验建立的ELSIA法检测Hp含量结果与牛Hp-ELISA检测试剂盒检测结果具有良好的相关性,表明ELSIA方法的可靠性。
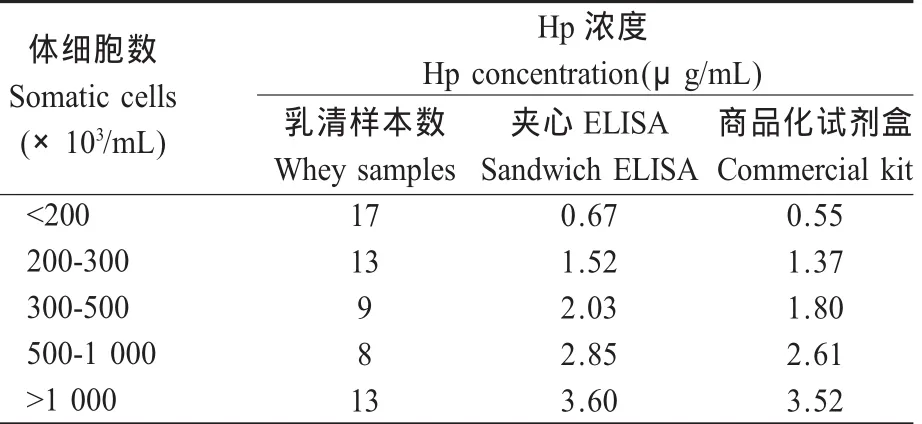
表5 商品化试剂盒与ELISA比较试验Table 5 Comparison between the commercial kit and ELISA
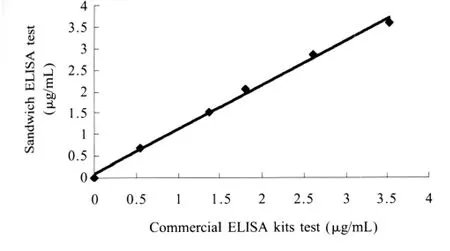
图2 ELISA法与商品化试剂盒检测乳清中Hp浓度相关性Fig.2 Correlations of concentrations of Hp in whey samples by ELISA and the commercial kit
3 讨论
本研究应用Hp和Hb特异性结合原理,建立夹心ELISA检测奶牛乳中Hp含量方法。对建立的方法进行优化,使用夹心ELISA方法和牛Hp-ELISA检测试剂盒检测50份牛奶样品中的Hp含量,结果表明,夹心ELISA方法检测结果具有较好的敏感性和特异性,操作简便,可重复性强,便于保存,适用于奶牛乳房炎乳中Hp含量的检测及乳中Hp含量的评价。
Hp作为一种敏感的急性期反应蛋白,一般在肝脏内合成,其表达受不同因素的调节,如细胞因子和前列腺素(PG)等;一些病理状态也会影响血液中Hp含量的变化,如炎症、创伤和感染等[13]。Khoshvaghti等对患有外科感染、急性子宫炎、急性局部外伤性网状腹膜炎(TRP)与健康奶牛的血清和牛奶中Hp含量进行比较测定,血清中Hp浓度显著升高,虽然牛奶中Hp浓度也有升高,但含量却很低(最高为0.41 μg/mL)[14]。这些病理状态下血液中Hp可能会通过血乳屏障进入乳中,但乳中Hp含量极少并且变化不显著。有研究表明,轻度乳房炎奶牛的血清和牛奶中Hp含量均迅速升高[3],与本研究的结果相同,在乳房炎期间乳中Hp浓度由0.67 μg/mL迅速升高至1.52 μg/mL。研究表明奶牛乳房炎期间牛奶中Hp的合成与释放与中性粒细胞相关,并表明中性粒细胞和乳腺上皮细胞是乳中Hp肝外合成的主要来源[15]。由于奶牛在患乳房炎期间,乳房是其主要的患病器官,牛奶中Hp含量相对其他病理时期较高,并且变化显著。因此在奶牛患有乳房炎期间可以检测到牛奶中Hp含量,并可以作为诊断乳房炎的一种方法。
检测乳房炎的方法中,以SCC检测最为准确,但敏感性和特异性不高,并且不易推广。本研究建立的ELISA方法较SCC法、双抗夹心ELISA方法具有良好的灵敏性和特异性,具有操作简单、特异性强、经济适用等特点,非常适用于奶牛乳清Hp含量检测,并可对奶牛乳房炎乳中Hp含量做准确评价为乳房炎进行实时监控、实地预防和及时治疗提供试验方法。
[1]Bramley A J,Dodd F H.Reviews of the progress of dairy science:Mastitis control progress and prospects[J].J Dairy Res,1984,51:481-512.
[2]Sandholm M,Kaartinen L,Pyo¨ra¨la¨ S.Bovine mastitis-Why does antibiotic therapy not always work?An overview[J].J Vet Pharmacol Ther,1990,13:248-260.
[3]Eckersall P D,Young F J,McComb C,et al.Acute phase proteins in serum and milk from dairy cows with clinical mastitis[J].Vet Rec,2001,148(2):35-41.
[4]Skinner J G,Brown R A L,Roberts L.Bovine haptoglobin response in clinically defined field conditions[J].Vet Rec,1991,128:147-149.
[5]Alsemgeest S P M,Lalsbeek H C,Wensing T,et al.Concentrations of serum amyloid-A(SAA)and haptoglobin(Hp)as parameters of inflammatory diseases in cattle[J].Vet Q,1994,16(1):21-23.
[6]Conner J G,Eckersall P D,Doherty M.Acute phase response and mastitis in the cow[J].Res Vet Sci,1986,41(1):126-128.
[7]Javid J,Liang J C.The hemoglobin-haptoglobin bond I.Dissociation of the complex and recovery of the native haptoglobin in an affinity chromatography system[J].J Lab Clin Med,1973,82(6):991-1002.
[8]Hiss S,Mielenz M,Bruckmaier R M,et al.Haptoglobin concentrations in blood and milk after endotoxin challenge and quantification of mammary Hp mRNA expression[J].J Dairy Sci,2004,87(11):3778-84.
[9]Emanuelson U,Funke H.Effect of milk yield on relationship between bulk milk somatic cell count and prevalence of mastitis[J].J Dairy Sci,1991,74:2479-2483.
[10]Ulrika G,Charlotte H S,Karin P W.Haptoglobin and serum amyloid A in milk from dairy cows with chronic sub-clinical mastitis[J].Vet Res,2005,36:191-198.
[11]Rogers G W,Hargrove G L,Cooper J B.Correlations among somatic cell scores of milk within and across lactations and linear type traits of Jerseys[J].J Dairy Sci,1995,78:914-920.
[12]Morimatsu M,Syuto M,Shimada N,et al.Isolation and charact erization of bovine haptoglobin from acute phase sera[J].J Biol Chem,1991,266(18):11833-11837.
[13]谭丽娜.结合珠蛋白研究进展[J].国际病理科学与临床杂志,2006,26(1):43-47.
[14]Khoshvaghti A,Nazifi S,Vafafar A,et al.Evaluation of serum and milk haptoglobin in some inflammatory diseases of cattle[J].J Vet Res,2009,3(1):31-36.
[15]Lai I H,Jung HT,Lu Yi-ping,et al.Neutrophils as one of the major haptoglobin sources in mastitis affected milk[J].Vet Res,2009,40:17-28.
