养殖河豚鱼弧菌病原菌的鉴定和生物学特性分析
2011-05-18麻丽丹王殿夫于晓婕
麻丽丹,王殿夫,于晓婕,吴 斌
(1.丹东出入境检验检疫局,辽宁 丹东 118000;2.辽东学院动物科学系,辽宁 丹东 118000;3.四川大学生命科学学院,四川 成都 610065;4.辽宁出入境检验检疫局,辽宁 大连 116001)
近年来,由于河豚鱼出口创汇价值较高,所以河豚鱼的养殖面积正在迅速增多。河豚鱼的生物学特性较常规养殖鱼类复杂、特殊,且易受外界环境因子的影响,疾病发生率高。近几年来在规模化育苗和养殖过程中病害日益严重,河豚疾病在河豚养殖过程中降低河豚养殖成活率、同时也降低了河豚外观和品质,从而影响了产品出口及其出口价格,对养殖户造成了严重经济损失,河豚疾病成了限制其发展的主要因素[1]。
自2007年开始,辽宁地区一种由弧菌感染导致的腹面皮下充血发红病症时有发生,造成不同程度的死亡率,给该产业带来一定的经济损失。弧菌是一类世界范围内广泛分布的革兰氏阴性杆菌,其中至少有12个种,如霍乱弧菌、副溶血弧菌、创伤弧菌和拟态弧菌等对人体有很强的致病性,常引起人体严重腹泻和脱水,有时还出现伤口感染,中耳炎及败血症。弧菌也是水产养殖中最为常见、流行性最广、危害最为严重的细菌性病原之一[2-4],随着水产养殖业的发展,弧菌病的暴发越来越频繁,传播速度越来越快,给全世界水产养殖业带来了巨大的经济损失。
本研究从患病养殖河豚鱼病灶处分离出11株优势菌,经感染实验证实致病菌为河弧菌和霍利斯弧菌,并对其一些生物学特性和敏感药物进行了测定,为养殖河豚疾病的防治提供依据,减小因河豚疾病造成的损失。
1 材料和方法
1.1 实验材料
患病河豚鱼取自辽宁庄河和丹东东港的两家河豚鱼养殖场,患病河豚鱼病症为尾鳍基部、躯干部以及腹面出现斑点状出血,随着病情的发展,患部组织浸润呈出血性溃疡,严重者,出血处病灶随之发生脓疡,形成皮下脓肿,吻端、鳍膜烂掉,肛门红肿扩张,并有黄色粘液流出。解剖发现病鱼肝脏呈弥散性出血,肠壁和腹腔膜也有发炎充血现象,病鱼脾脏时有肿大,失血呈粉红色。
1.2 病原菌分离
无菌解剖病鱼,分别取其体表病灶、鳃、肝和肾等组织少许,剪碎后在MA平板上划线分离,于30℃恒温培养箱中培养24 h。从平板上形态一致的优势菌落中挑取单个菌落,重复进行MA平板划线3次,以获得病菌的纯培养。
1.3 人工感染实验
1.3.1 试验用鱼 试验用健康河豚鱼共计48尾,按每个50L的塑料缸中放养3尾,暂养1周,水温控制在(15±1)℃,确认无病后开始试验。
1.3.2 菌悬液制备 将纯培养菌株接种于新鲜TSA琼脂培养基上,30℃培养24 h后,用无菌生理盐水洗下菌落,制成菌悬液,以麦氏比浊法制得9×108/mL浓度的菌悬液。
1.3.3 攻毒试验 将每缸设为一组,共11组分别用于所分离的11株菌(从养殖场患有明显弧菌病病症鱼中分离的优势菌株)的攻毒试验,体壁肌肉注射健康河豚鱼(每尾0.1mL),每组设平行试验,同时设对照组,注射等量无菌0.85%生理盐水。
1.4 病原菌分离鉴定
1.4.1 形态学观察 纯培养的细菌于30℃培养24 h后,按常规方法进行革兰氏染色和显微镜观察。
1.4.2 生理生化测定 采用法国梅里埃公司的API-20E鉴定系统并结合传统的手工鉴定方法对纯培养24 h的菌株进行生理生化指标的测试。细菌的生理生化特征实验参照《常见细菌系统鉴定手册》[5]和《伯杰氏细菌学鉴定手册》(第九版)[6]进行。
1.4.3 实时PCR检测 根据文献报道,toxR基因首先是作为霍乱毒素操纵子的调控基因而被发现,随后被发现它也是霍乱弧菌许多其它基因的调控基因。研究发现toxR基因在弧菌中普遍存在而不同种之间同源性程度却又较低,霍乱弧菌和副溶血性弧菌之间为52%,所以我们选择了toxR基因作为检测靶基因。与GenBank等网络数据库中登录的所有物种核苷酸序列进行比对的结果,以及生物信息学方法证明,该基因在河弧菌内高度保守,而相对于其它物种则具有高度特异性。结合文献研究成果,以toxR基因为设计目标,设计的引物探针经BLAST验证具有高度保守性,特异性强。所用引物和探针见表1所列。

表1 河弧菌实时PCR检测所用引物和探针序列
采用煮沸法提取细菌基因组DNA,并对提取DNA作为反应模板,进行实时PCR反应。本研究按照试剂厂家推荐的反应程序,进行实时荧光PCR检测和特异性试验。
1.5 药物敏感试验
药敏纸片购自英国Oxoid公司,共15种抗菌药物,药敏试验参照纸片法抗菌药物敏感试验操作标准进行。
2 结果
2.1 人工感染实验
用菌株M1~M11通过体壁肌肉注射方式感染实验组,感染M1、M3~M5、M7~M9和M11的河豚鱼在20 d内仍健康,无发病症状,而感染M2、M6和M10的河豚鱼均在15 d内全部死亡,从所有死亡的鱼中都分离出了与注射菌株特性一致的菌株,因此可认为死亡是由注射菌株感染造成的。死亡鱼与自然状态下急性感染的病鱼症状相似,表现为腹面肌肉充血发红;肾脏有肿大、灰白色脓样坏死灶;肝脏充血,腹腔膜和肠壁发生充血炎症。对照组无死亡现象。
2.2 病原菌的分离鉴定
2.2.1 形态及生理生化鉴定 选取菌株M2、M6和M10,对其进行生理生化鉴定,3株菌株均为革兰氏阴性;弯曲短杆菌;粘丝试验阳性,氧化酶阳性。鉴定结果见表2,结果均为为河弧菌。

表2 菌株M2、M6和M10生理生化特征的比较
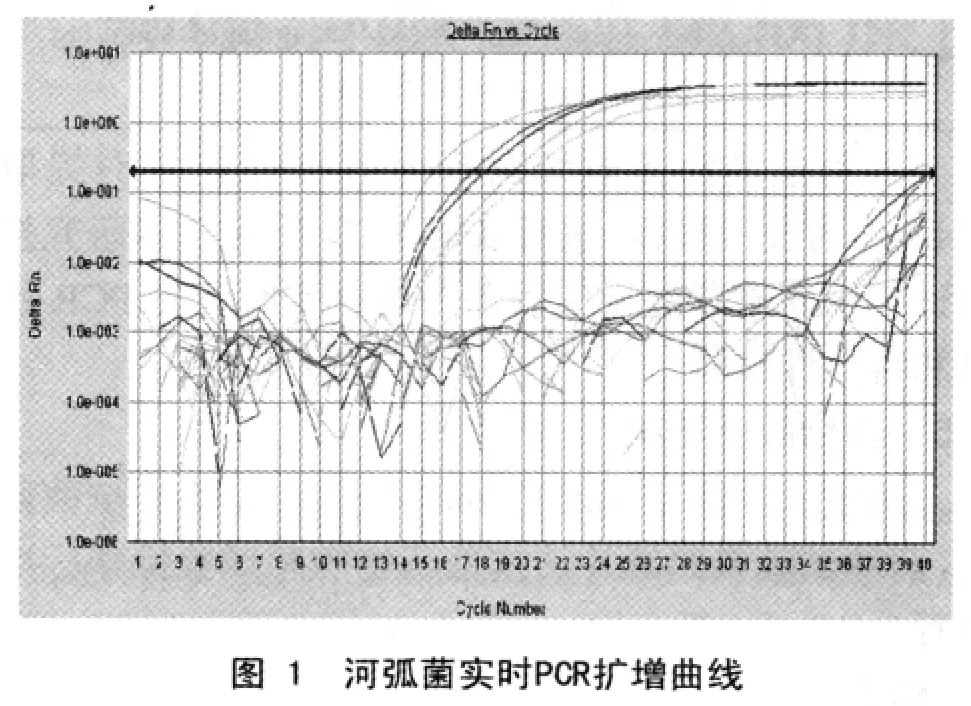
2.2.2 PCR扩增结果:均出现了典型的扩增曲线(图1),表明为河弧菌。
2.3 药物敏感试验
利用纸片法测定15种抗菌药物对菌株M2和M6的作用效果见表3。15种药物的敏感性试验证实两菌株均对氯霉素、环丙沙星和诺氟沙星较为敏感,对头孢类药物具有耐药性。
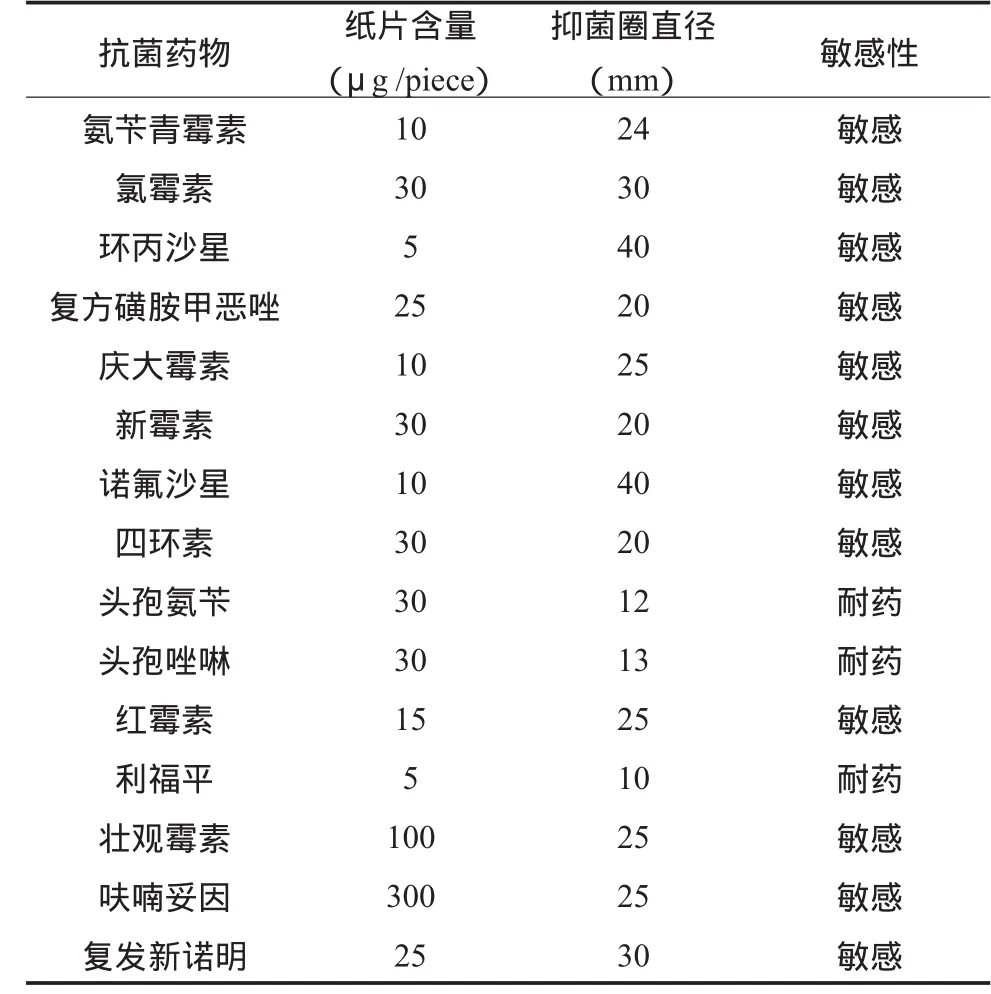
表3 河弧菌对不同抗菌药物的敏感性
3 讨论
3.1 海洋弧菌是海洋生物体表和体内微生物区系中的优势菌群,在世界各沿海地区,因为食用海鲜尤其是贝类造成人类消化道等疾病的现象时有发生,因此,弧菌对人类健康的危害受到人们广泛的重视,世界各国对于海产品的进出口以及食品卫生检疫都有相当严格的标准。副溶血性弧菌、霍乱弧菌、溶藻弧菌和创伤弧菌对人类具有致病性,可以导致人类发生严重的腹泻等消化道疾病、创伤感染或败血症。1994年出版的《伯杰氏细菌学鉴定手册》(第9版)列举了12种与人类临床疾病有关的弧菌。
目前国内外对河豚疾病的深入研究几乎为零,国内仅有少量关于河豚疾病防治的经验介绍。弧菌是水产养殖中最常见的病原菌之一,如养殖刺参溃疡病和斑节对虾弧菌病[7]等。水产养殖中多次大面积流行的弧菌病原都来自于水体,可以推测水体是一个天然的弧菌毒力基因的保存库,通过船舶的压舱水与水产品的进出口等多种途径很容易造成毒力基因的地域性转移,从而可能使当地的某些无毒株转变为重要的有毒株,可能是不断出现弧菌新病原菌的重要原因之一。
3.2 对大部分水生环境中的弧菌如溶藻弧菌、河弧菌、霍利斯弧菌、鲨鱼弧菌、弗氏弧菌等的研究明显不足。它们的毒力基因与病原性资料不足的现状不利于揭开这些未被重视的环境病原种(株)的致病机理,也无法发现这些种类对弧菌进化的真正贡献及现有毒力基因的演化来源,同时也明显阻碍了这些弧菌的株型分类与鉴定。因此开展各地环境,特别是水生环境中弧菌毒力基因及其多样性研究,发展毒力基因检测与毒力菌株的鉴定方法显得非常重要,只有这样才能及时有效地预防弧菌传染病的大面积暴发[8]。
本实验从病原学方面对河豚鱼皮下充血病做了基础性研究,并对病原菌的敏感性药物进行了筛选,有助于指导河豚鱼的养殖生产。
[1]窦海鸽,刘彦,王亚军.河豚养殖中几种常见疾病及防治技术[J].北京水产,2004,5(3):26-28.
[2]陶保华,胡超群,吴蔚.斑节对虾弧菌病的病原生物学研究[J].热带海洋学,2001,20(2):80-87.
[3]陶保华,胡超群,任春华.海水鱼类病原弧菌对对虾的致病力及其疫苗的免疫预防作用 [J].热带海洋学报,2001,20(4):68-73.
[4]陈偿,胡超群,张吕平,等.用RAPD 技术对养殖环境溶藻弧菌遗传多样性的研究[J].热带海洋学报,2002,21(4):49-54.
[5]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[6]Holt J G.Bergey’s manual of determinative bacteriology[M].9thed.Baltimore,Maryland:LippincottWilliams & Wilkins,1994.
[7]杨嘉龙,周丽,绳秀珍,等。养殖刺参溃疡病病原菌RH12的鉴定及其生物学特性分析 [J].水产学报,2007,31(4):504-511.
[8]谢珍玉,胡超群.弧菌毒力基因水平转移与进化的研究进展[J].热带海洋学报,2005,24(3):77-86.
