PEG化隐形纳米脂质体的研究进展*
2011-05-17陈建明
顾 芃,陈建明
第二军医大学药学院药剂教研室,上海 200433
脂质体系将药物包封于类似生物膜结构的双分子层中所得到的微型球状载体。20世纪70年代以来,脂质体作为一种重要的药物载体,具有生物相容性、低毒、可提高药物治疗指数、易制备、可工业化生产等优势,但普通脂质体的半衰期短、疗效低、靶向性差等缺点限制了脂质体的广泛应用。近年来,可明显提高药物体内半衰期,增强药物靶向性及疗效的PEG化隐形纳米脂质体 (PEGylation stealth nano-liposomes)逐渐受到人们的重视。
PEG化隐形纳米脂质体又称为长循环纳米脂质体(long circulating nano-liposomes)或空间稳定纳米脂质体(sterically stabilized nano-liposomes),这类脂质体和普通脂质体相比含有PEG的二硬脂酸磷脂酰胺衍生物(PEG-DSPE)或其它PEG衍生物,并且粒径在100 nm左右。制备PEG化隐形纳米脂质体基本方法是在脂质体的磷脂双层外加上PEG,连接方法有两种:一种是以共价键偶联在已制备好的脂质体表面;另一种是以疏水性取代基的疏水作用吸附或结合在脂质体的表面。结合或吸附于脂质体表面的PEG极性长链暴露于溶液中,增强脂质体的溶剂化作用,有效阻止血浆蛋白的调理作用,使脂质体可以逃避网状内皮系统的发现和捕获,延长脂质体及其携带药物的体内循环时间,故具有隐形性。
PEG化隐形纳米脂质体具有以下特征:改善脂质体的理化性质,延长药物体内的半衰期;可以增加肿瘤部位的药物浓度,提高治疗效果,降低药物毒副作用;用配体、磁靶向材料、热敏材料等或者这些材料联合对其修饰,通过特异性结合和特殊治疗作用进一步增强药物的靶向性等。PEG化隐形纳米脂质体在新型给药系统中的应用越来越广泛,并且与其他学科相互渗透和交融,促进了生命科学的研究和发展,已成为研究热点[1-4]。本文重点围绕PEG化隐形纳米脂质体在体内药动学、组织分布、提高肿瘤靶向性、降低药物毒性等方面的研究和应用进展做一综述,以期为相关医药学研究提供参考。
1 PEG化隐形纳米脂质体对药物体内动力学的影响
PEG(polyethylene glycol,PGE)系线性高分子材料,其分子中存在的较长的极性基团(乙氧基)能够与水形成氢键,在脂质体的表面形成一层水化膜;PEG在脂质体表面交错重叠覆盖,形成致密的蘑菇状、毛刷状或烙饼状构象云,构成空间位阻,阻碍血液中蛋白质的吸附和细胞的黏附,从而有效地躲避网状内皮系统的识别和吞噬(图1)。PEG化隐形纳米脂质体是在PEG化的基础上降低脂质体粒径至100nm左右或小于100 nm,从而进一步降低网状内皮系统对其识别和摄取能力,延长在血循环滞留时间。
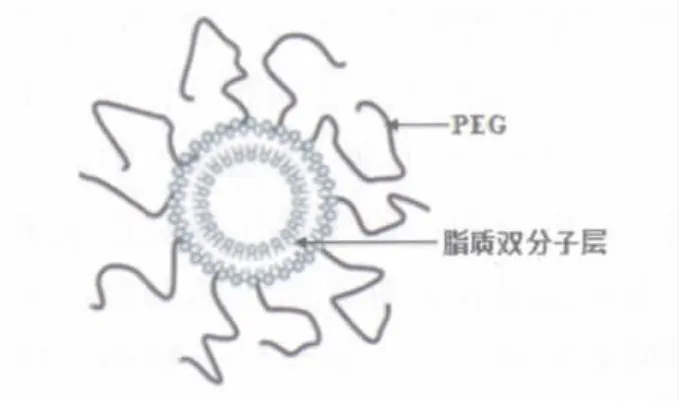
图1 PEG化隐形纳米脂质体示意图
多柔比星隐形纳米脂质体是美国食品药品监管局(FDA)批准的第一个有长循环特性的脂质体产品,1995年上市。与多柔比星注射液相比,多柔比星隐形纳米脂质体体内分布体积降低至原来的 1/200,清除速率降低至原来的 1/1400,半衰期延长了约100倍[5]。有报道将拓扑替康PEG化隐形纳米脂质体和注射溶液、普通脂质体进行药动学比较,该PEG化隐形纳米脂质体的AUC分别是注射溶液和普通脂质体的52倍和2倍,并且平均驻留时间(MRT)和血液中的半衰期都显著长于注射溶液和普通脂质体[6]。张自强等[7]比较了紫杉醇注射液和紫杉醇隐形纳米脂质体的药动学,结果半衰期分别为1.48h和10.48h,后者的AUC是前者的3.13倍。Yang T等[8]也研究了紫杉醇隐形纳米脂质体的药动学,它在血液循环中的滞留时间明显长于游离紫杉醇。
PEG化隐形纳米脂质体经其他材料修饰后长循环的作用更加明显。Ryo S[9]等将偶联转铁蛋白的奥沙利铂隐形纳米脂质体、奥沙利铂隐形纳米脂质体、奥沙利铂普通脂质体、奥沙利铂溶液,以尾静脉注射到荷瘤的BALB/c小鼠体内,结果显示:溶液组和普通脂质体组在肿瘤组织中的达峰时间为18 h,峰浓度分别为 0.98 μg·g-1和 2.1 μg·g-1;隐形纳米脂质体组在肿瘤组织中的达峰时间为30 h,峰浓度约为6 μg·g-1;而转铁蛋白介导的隐形纳米脂质体在肿瘤组织中的达峰时间为72 h,峰浓度约为10 μg·g-1,并能在高浓度维持很长一段时间。
2 PEG化隐形纳米脂质体对药物体内组织分布的影响
PEG化隐形纳米脂质体具长循环作用的同时还可以避免网状内皮细胞的吞噬,降低肝、脾、骨髓等组织的药物分布,并增加其它靶组织的药物分布。脂质体粒径的大小直接影响其体内分布。一般认为:脂质体粒径大于300 nm时,易被网状内皮系统吞噬;而大于100 nm的脂质体易被淋巴系统清除;100 nm左右的脂质体在肿瘤组织中有较多的分布。有报道将二乙基三胺五乙酸(DTPA)包封成普通脂质体和隐形纳米脂质体,Sprague–Dawley大鼠尾静脉给药48 h后,隐形纳米脂质体组的肝、脾DTPA浓度比普通组显著降低[10]。多柔比星普通脂质体能用于多种类型肿瘤的治疗,但其对心脏、骨髓等组织产生的不良反应限制了它的应用,而多柔比星隐形纳米脂质体可以减少多柔比星在心脏等组织的分布,大大降低多柔比星的心脏毒性等不良反应,提高了病人的用药顺应性[5]。
有研究将破伤风抗毒素(TAT)连接在磁靶向隐形纳米脂质体的表面,药物可以通过血脊髓屏障分布于脊髓组织内,并在这些部位浓聚。连接有TAT的磁靶向隐形纳米脂质体,可以提供一种用于治疗神经脊髓损伤等方面疾病的药物载体[11]。PEG化隐形纳米脂质体包裹的放射性药物已用于某些疾病显像诊断的研究。Awasthi等[12]比较了99mTc标记的隐形纳米脂质体和111In标记的白细胞在结肠炎兔体内的显像诊断:24 h时前者在肝、脾中的放射性分布分别为7.8%和0.3%,低于后者的39.7%和7%;前者的靶/非靶为37.1,而后者的为15.2。放射性药物标记长循环脂质体在肝、脾等组织的分布减少,提高了诊断炎症和感染组织的准确性。在PEG隐性化纳米脂质体的基础上制备免疫脂质体,能够更有效地靶向HIV感染的组织,明显改善药物在各组织中的分布,是抗艾滋病药物载体研究的重要方向[13,14]。 研究将茚地那韦(indinavir sulfate,IDV)包封于隐形纳米脂质体制备免疫脂质体,在雌性C3H小鼠上背颈部皮下注射IDV或载IDV的免疫脂质体,未经包封的IDV在淋巴组织中药物浓度极低,绝大多数IDV聚集在肝脏;而经免疫脂质体包封的IDV,明显改善药物在各组织中的分布,注射后15 d,在各个组织中仍持续释放高浓度的IDV,药物浓度累计比注射未经包封的IDV高21~126倍[15]。
3 PEG化隐形纳米脂质体对肿瘤靶向性的影响
大多数实体瘤的病理生理特征与正常组织相比有显著不同:肿瘤血管生长迅速,外膜细胞缺乏,淋巴管道回流系统缺损,大量血管渗透性调节剂的生成等。这些生理变化有利于肿瘤组织获取大量养分和氧气,同时也使肿瘤血管渗透性增加,进而产生增强穿透性和延长滞留时间的效应 (enhanced permeability and retention effect,EPR效应),可以使大分子物质等穿透缺损的血管内皮细胞进入肿瘤组织,并由于清除障碍而高浓度、长时间蓄积在肿瘤组织中,有的可长达100h[16-17]。普通脂质体,由于粒径过大,缺乏血管通透性,并且易被网状内皮细胞吞噬而清除,难以进入肿瘤组织。100nm左右的PEG化隐形纳米脂质体容易透过肿瘤组织的毛细血管,并延长在血循环滞留时间,使脂质体有充分时间与肿瘤组织接触,在血-瘤转换时更有效,从而使小粒径纳米脂质体在肿瘤部位高渗漏、高聚集,提高药物的肿瘤靶向性。
顺铂的隐形纳米脂质体LipoplatinTM的Ⅰ、Ⅱ期临床实验中,4名患者 (1名结肠癌,2名胃癌和1名肝细胞腺癌)静脉滴注20h后切除肿瘤,肿瘤组织中铂浓度平均值是相邻正常组织的10~50倍,结肠癌组织中铂浓度是正常结肠的200倍,胃癌组织中铂浓度高达260μg·g-1,表明顺铂隐形纳米脂质体有良好的肿瘤靶向性。Lipoplatin已被欧洲药品管理局认定为治疗胰腺癌的罕见病用药[18]。文献[19,20]比较了100nm左右的PEG化隐形纳米脂质体与100nm左右的普通脂质体在肿瘤中的积聚程度,发现前者比后者有更强的肿瘤部位积聚性能,说明前者延长了脂质体在血液循环中的时间,从而增加了在肿瘤中积聚的可能性。
近年来用配体修饰的PEG化隐形纳米脂质体的肿瘤靶向治疗逐渐成为研究的热点。Yang T等[8]成功制备了配体靶向的紫杉醇隐形纳米脂质体,用巯基化曲妥珠单抗作为靶配体连接在PEG末端,结果显示:该粒子可以通过受体介导途径进入肿瘤细胞内,可以用于高表达人表皮生长因子受体2(HER2)的乳腺癌细胞的靶向给药。Li XM[21]等研究多柔比星的转铁蛋白隐形纳米脂质体,可以显著提高药物在肿瘤部位的浓度,较普通脂质体更有效抑制肿瘤生长。有报道将热疗作用和长循环作用联用,制备成热敏隐形纳米脂质体,可以提高靶向性,增加治疗效果。多柔比星脂质体用氮异丙烯月桂酰胺和丙烯酰胺的共聚物(PNIPAM-AAM)及PEG修饰后,不仅可以使脂质体在血液中的存在时间延长,还可以使其有效地达到热疗靶点释放药物,使药物的疗效明显提高[22]。
4 PEG化隐形纳米脂质体降低药物的毒副作用
PEG化隐形纳米脂质体可以提高药物体内循环的稳定性,延长血液内循环时间,它的被动靶向作用和代偿滤过机制,使药物在肿瘤部位浓聚,提高靶向性,降低药物的毒副作用。PEG化的隐形纳米脂质体显示了其特有的优越性,使一些不能用于临床的高活性药物有可能开发成产品。
柔红霉素是广谱抗肿瘤药,主要用于治疗急性粒细胞白血病,其不良反应主要是骨髓抑制和心脏毒性。游离柔红霉素、脂质体柔红霉素和隐形纳米脂质体柔红霉素的体内研究结果表明:与游离组相比,脂质体组在肝、脾内有较高的浓度,而心、肺、肾内浓度较低;隐形纳米脂质体组在心、肺、肾、肝、脾内没有被检测到,能够更显著地降低心脏等组织的毒副作用[23]。Cogsweu[24]等用薄膜挤压法和胶束迁移载药法成功制备了益康唑隐形纳米脂质体,并考察其对异种嫁接MCF-7人乳腺癌细胞后的Rag2M小鼠肿瘤生长的延迟作用和对肝脏、肾脏的毒副作用。研究结果表明,两种方法制备的益康唑隐形纳米脂质体,治疗乳腺癌的效果基本相同,而且不会引起显著的肝毒性、肾毒性及体重下降等不良反应。
PEG化隐形纳米脂质体还可以作为基因治疗的载体。基因治疗的载体有生物载体和非生物载体。生物载体如病毒,因有可能导致宿主正常核苷酸序列发生改变等安全性问题,应用受到限制;非生物载体安全可靠,可以避免常规病毒载体存在的潜在危险。PEG化隐形纳米脂质体是应用比较广泛的非生物载体,是基因治疗的发展方向。有报道将针对EWS Fli-1基因的反义寡核苷酸包裹于隐形纳米脂质体内,能够有效地抑制鼠Ewing’s肉瘤相关肿瘤的生长[25]。
5 结 语
随着化学、物理、生物及医学等学科互相提高和不断发展,隐形纳米脂质体的体内分配的生理学机制、脂质体和药物及PEG相互作用的特点等逐渐被认识,各种生物、免疫治疗药物等以PEG化隐形纳米脂质体为载体的研究显示了其良好的生物活性和治疗效果[26-28]。PEG化隐形纳米脂质体赋予了脂质体与众不同的特性,随着研究的不断深入,其作为载体的各项性能将不断得到完善,所转运药物的种类和范围将不断扩大,PEG化的隐形纳米脂质体将会有更为广阔的应用前景。
[1] Wang HJ,Zhao PQ,Liang XF,et al.Folate-PEG coated cationic modified chitosan-cholesterol liposomes for tumor-targeted drug delivery[J].Biomaterials,2010,31(14):4129-38.
[2] Song SX,Liu D,Peng JL,et al.Novel peptide ligand directs liposomes toward EGF-R high-expressing cancer cells in vitro and in vivo[J].FASEB J,2009,23(5):1396-404.
[3] Jung SH,Jung HS,Seong H,et al.Polyethylene glycolcomplexed cationic liposome for enhanced cellular uptake and anticancer activity[J].Int J Pharm,2009,382(1-2):254-61.
[4] Hong MH,Zhu SJ,Jiang YY,et al.Novel anti-tumor strategy:PEG-hydroxycamptothecin conjugate loaded transferrin-PEG-nanoparticles[J].J Control Release,2010,141(1):22-9.
[5] Orditura M,Quaglia F,Morgillo F,et a1.Pegylated liposomal doxorubicin pharmacologic and clinical evidence of potent antitumor activity with reduced anthracyclineinduced cardiotoxicity[J].Oncol Rep,2004,12(3):549-56.
[6] Dadashzadeh S,Vall AM,Rezaie M.The effect of PEG coating on in vitro cytotoxicity and in vivo disposition of topotecan loaded liposomes in rats[J].Int J Pharm,2008,353(2):251-9.
[7] 张自强,覃 斌,李 战,等.mPEG-DSPE修饰的紫杉醇脂质体的制备及其药动学研究 [J].中国药学杂志,2008,43(3):199-202.
[8] Yang T,ChoiMK,CuiFD,etal.Preparation and evaluation of paclitaxel-loaded PEGylated immunolip osome[J].J Control Release,2007,120(3):169-77.
[9] Ryo S,Tomoko T,Yasubiro K,et a1.Effective antitumor activity of oxaliplatin encapsulated in transferring-PEG-liposome[J].Int J Pharm,2008,346(2):143-50.
[10] Phan G,Herbet A,Cholet S,et al.Pharmacokinetics of DTPA entrapped in conventional and long-circulating liposomes of different size for plutonium decorporation[J].J Control Release,2005,110(1):177-88.
[11] WangHJ,ZhangSG,LiaoZY,etal.PEGlated magnetic polymeric liposome anchored with TAT for delivery of drugs across the blood-spinal cord barrier[J].Biomaterials,2010,31(25):6589-96.
[12] Awasthi V,Goins B,McManus L,et a1. [99m Tc]liposomes for localizing experimental colitis in a rabbit mode1[J].Nucl Med Biol,2003,30(2):159-68.
[13] Lalanne M,Paci A,Andrieux K,et al.Synthesis and biological evaluation of two glycerolipidic prodrugs of didanosine for direct lymphatic delivery against HIV[J].Bioorg Med Chem Lett,2007,17(8):2237-40.
[14] Garg M,Dutta T,Jain NK.Reduced hepatic toxicity,enhanced cellular uptake and altered pharmacokinetics of stavudine loaded galactosylated liposomes[J].Eur J Pharm Biopharm,2007,67(1):76-85.
[15] Gagne JF,Desormeaux A,Perron S,et al.Targeted delivery of indinavirtoHIV-1primaryreservoirswithimmunoliposomes[J].Biochim Biophys Acta,2002,1558(2):198-210.
[16] Maeda H,Bharate GY,Daruwalla J.Polymeric drugs for effcient tumor-targeteddrug delivery based on EPR-effect[J].Eur J Pharm Biopharm,2009,71(3):409-19.
[17] Ogawara K,Un K,Minato K,et al.Determinants for in vivo anti-tumor effects of PEG liposomal doxorubicin:Importance of vascular permeability within tumors[J].Int J Pharm,2008,359(1-2):234-40.
[18] Boulikas T.Molecular mechanisms of cisplatin and its liposomally encapsulated form,LipoplatinTM.IipoplatinTMas a chemotherapy and antiangiogenesis drug[J].Cancer Therapy,2007,5(B):349-76.
[19] Dadashzadeh S,Vali AM,Rezaie M,et al.The effect of PEG coating on in vitro cytotoxicity and in vivo disposition of topotecan loaded liposomes in rats[J].Int J Pharm,2008,353(1-2):251-9.
[20] 施 斌,方 超,游美羡,等.聚乙二醇修饰对羟基喜树碱隐形纳米囊泡的肿瘤靶向和抑瘤作用的影响[J].中国临床药学杂志,2006,15(1):46-9.
[21] Li XM,Ding LY,Xu YL,et al.Targeted delivery of doxorubicin using stealth liposomes modified with transferring[J].Int J Pharm,2009,373(1-2):116-23.
[22] Han HD,Shin BC,Choi HS.Doxorubieinencapsulated therulosensitive liposomes modified with poly(Nisopropylacrylamide-co-acrylamide):drug release behaviorand stability in the presence of serum[J].Eur J Pharm Biopharm,2006,62(1):110-6.
[23] Lu WL,QiXR,Zhang Q,etal.A pegylated liposomal platform:pharmacokinetics,pharmacodynamics,and toxicity in mice using doxorubicin as a model drug[J].J Pharmacol Sci,2004,95(3):381-9.
[24] Sebastian C,Stuart B,Dawn W,et al.A parenteral econazole formulation using a novelmicelle-toliposome transfer method:in vitro characterization and tumor growth delay in a breast cancer xenograft model[J].Pharm Res,2006,23(11):2575-85.
[25] Song LY,Ahkong QF,Rong Q,et a1.Characterization of the inhibitory effect of PEG-lipid conjugates on the intracellular delivery of plasmid and antisense DNA mediated by cationic lipid liposomes[J]. Biochem Biophys Acta,2002,1558(1):1-13.
[26] PaoloDD,PastorinoF,BrignoleC,etal.Drugdeliverysystems:applicationofliposomalanti-tumoragentstoneuroectodermal cancer treatment[J].Tumori,2008,94(2):246-53.
[27]Narayanan NK,Nargi D,Randolph C,et al.Liposome encapsulation of curcumin and resveratrol in combination reduces prostate cancer incidence in PTEN knockout mice[J].Int J Cancer,2009,125(1):1-8.
[28]Ito Y,Kimura Y,Shimahara T,et al.Disposition of TF-PEG-Liposome-BSH in tumor-be aring mice[J].Appl Radiat Isot,2009,67(7-8):109-10