非酒精性脂肪性肝病和非酒精性脂肪性肝炎的无创性诊断
2011-05-15LeonADAMSArielFELDSTEIN
Leon A ADAMS* Ariel E FELDSTEIN
*School of Medicine and Pharmacology,University of Western Australia,Sir Charles Gairdner Hospital Unit,Nedlands,Western Australia,Australia;and†Department of Cell Biology and‡Pediatric Gastroenterology,Cleveland Clinic,Cleveland,Ohio,USA
引言
非酒精性脂肪性肝炎(NASH)指不是由于过量饮酒引起的肝脂肪变性、炎症、肝细胞损伤等组织学改变。过量饮酒的定义一般指女性饮酒>20 g/d,男性饮酒>30 g/d。NASH常伴有基础的胰岛素抵抗,因此常发生于超重、肥胖或2型糖尿病患者。NASH为非酒精性脂肪性肝病(NAFLD)的组织学表现之一,NAFLD尚包括无肝损伤和炎症的单纯性脂肪肝(肝脂肪变性)。NASH和肝脂肪变性共累及发展中国家和发达国家9%~30%的人群,使NAFLD成为全球范围内最常见的肝脏疾病。肝脂肪变性被认为是一种相对良性的疾病,而NASH则可能进一步发展甚至致死。
NAFLD诊断的建立:肝脂肪变性与NASH
NASH的诊断需要临床与病理相结合,由肝活检证实存在肝脂肪变性伴炎症和肝损伤,由临床问诊排除过量饮酒。尽管影像学检查(超声、CT或MRI)能发现肝脂肪变性,但目前尚无影像学方法可检出炎症和气球样变性的细微组织学变化,因而难以鉴别肝脂肪变性与NASH。脂肪肝患者应排除肝脂肪变性的继发性因素,如药物(如泼尼松龙、他莫昔芬、胺碘酮、甲氨蝶呤)、毒物(如氯乙烯)、全胃肠外营养、恶病质、肠旁路手术、病毒(如HCV3、HIV)和脂肪营养障碍。慢性血清肝酶升高者应根据临床病史和实验室检查排除其他原因,如病毒性肝炎、自身免疫性肝病和药物性肝中毒。在转诊中心见到的慢性肝酶升高但实验室评价阴性的患者中,约33%患有NASH,其他诊断包括肝脂肪变性(27%)、非特异性肝炎(9%)、结节状再生性增生(2%)和肉芽肿性肝病(1%)。
肝活检诊断NASH的能力受病理医师之间观察者间和观察者内变异的影响。对脂肪变性的分级较为可靠,观察者内和观察者间变异的一致性检验Kappa值分别为0.74~0.98和0.79。纤维化分期观察者内和观察者间变异的Kappa值亦相对较高,分别为0.68~0.85和0.84。而肝小叶炎症、气球样变性的观察者内和观察者间变异较大,Kappa值分别为0.37~0.60和0.45、0.62~0.66和0.56。 诊断 NASH的总体观察者间和观察者内一致性属中至高等,Kappa值分别为0.66~0.90和0.61~0.62。
由于肝活检只能取到约0.00002%的肝组织,取样误差将影响肝活检诊断组织学上可能呈斑片状改变的NASH的能力。配对肝活检研究表明,多达24%的NASH病例可能被漏诊,22%~37%肝纤维化病例的分期与实际不符。
NASH的生化预测指标
肝酶:ALT和AST水平升高可反映肝脂肪变性、炎症或纤维化的存在,但很少超过正常上限4倍。尽管NAFLD患者的ALT水平倾向于高于非NAFLD患者,人群队列研究表明近80%的脂肪肝患者ALT水平在正常范围内。即使肝纤维化处于进展状态,转氨酶水平仍倾向于随肝脂肪变性和炎症的改善而降低。进展期肝纤维化可能出现ALT/AST比值倒置。
数项对行肝活检的肝病科患者以及行减肥手术的肥胖症患者的研究发现,NASH患者的ALT水平高于单纯肝脂肪变性患者,但尚未对此现象作广泛观察。此外,一些系列研究报道ALT水平升高者与正常者的组织学改变范围相似。采用ROC曲线进行分析,ALT在139例NAFLD患者中检出NASH的准确性仅为0.58(95%CI:0.49~0.68)。土耳其一项纳入54例NAFLD患者的研究同样发现ALT和AST的诊断准确性较差,两者鉴别NASH与单纯肝脂肪变性的AUC均仅为0.61。一项研究检验了不同ALT界值在233例行减肥手术的女性患者中诊断NASH的准确性。将ALT界值从30 IU/L降低至19 IU/L,诊断NASH的敏感性从42%提高至72%,但特异性从80%降低至42%。ALT水平较高的NAFLD患者更可能患NASH,但ALT水平正常不能排除NASH和进展期肝纤维化。
细胞死亡标记物:肝细胞凋亡被认为是NASH患者肝损伤和细胞死亡的关键通路之一。与单纯肝脂肪变性相比,NASH时肝细胞凋亡水平升高,可通过检测血浆细胞角蛋白-18(CK-18)片段评估凋亡水平。CK-18是肝内主要的中间丝蛋白,在凋亡过程中被caspases裂解。NASH患者的CK-18片段水平高于单纯肝脂肪变性者,行减肥手术后可随体质量的减轻而降低。不同研究小组应用ROC曲线分析了CK-18片段检出NASH的准确性,AUC在0.71到0.93之间(见表1)。除检测CK-18片段外,Younossi等评估了可反映肝细胞坏死和凋亡的总CK-18水平的预测价值。在101例肥胖症患者中,总CK-18水平的AUC与CK-18片段相比略有升高(0.81对0.71),但差异无统计学意义。然而在一组包括83例临床NAFLD患者的队列中,总CK-18水平鉴别NASH与单纯肝脂肪变性的准确性与CK-18片段相比无明显差异(AUC 0.81对0.83)。
细胞因子和脂肪因子:脂联素、肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)是 NASH 时在介导肝脂肪变性、胰岛素抵抗和炎症反应中起关键作用的细胞因子。脂联素是一种胰岛素敏感性抗炎脂肪细胞因子,在肥胖、糖尿病等胰岛素抵抗状态下其水平降低。NAFLD患者的脂联素水平与肝脂肪变性程度呈负相关,关于脂联素是否与NASH或坏死-炎症活动性独立相关的研究结果存在争议。TNF-α是肝内主要的促炎细胞因子,亦能由脂肪组织分泌,可拮抗脂联素的作用。在中国和挪威的NASH患者中,TNF-α与NASH和坏死-炎症等级相关,在澳大利亚患者队列中则未观察到此相关性。IL-6是另一个肝内关键的促炎细胞因子,参与了胰岛素抵抗的发病机制。NASH患者的肝内和全身性IL-6水平升高,此种关联可以用胰岛素抵抗和体重指数(BMI)加以解释。最近发现由脂肪细胞和巨噬细胞分泌的脂肪细胞脂肪酸结合蛋白(AFBP)与NAFLD患者的胰岛素抵抗和坏死-炎症独立相关。AFBP可能参与了脂多糖刺激引起的胰岛素抵抗和炎症反应,其在NAFLD发病机制中的作用尚不清楚。
血清氨酰基脯氨酸二肽酶活性(SPEA):SPEA参与了胶原的裂解,被认为是肝纤维化的无创性标记物。一项纳入54例患者的小样本研究发现,SPEA与肝小叶炎症、NAFLD活动性评分和纤维化相关,其鉴别NASH与单纯肝脂肪变性的AUC为0.85(见表1)。目前尚不清楚SPEA预测NASH的能力是否独立于肝纤维化分期,有待进一步验证。
可溶性晚期糖基化终产物受体(sRAGE):晚期糖基化终产物参与了炎症反应和胰岛素抵抗的发生。其血浆可溶性受体易于测定,并与多个代谢综合征参数相关。Yilmaz等对57例NAFLD患者的研究表明,sRAGE与ALT水平呈负相关,预测NASH的AUC为 0.77(见表 1)。sRAGE与 NASH的相关性与年龄、性别、胰岛素抵抗、BMI和转氨酶水平无关。
氧化应激标记物:肝脏氧化应激被认为是引起肝细胞损伤和导致NASH发生的关键因素。脂肪酸氧化增加可导致自由基和随后脂质过氧化产物的产生。与单纯肝脂肪变性相比,NASH时可见肝内脂质过氧化水平升高,但全身性脂质过氧化产物水平与肝内坏死-炎症活动性的关系尚存在争议。一项纳入51例NAFLD患者的研究显示,患者的血浆丙二醛水平高于对照组,但与坏死-炎症活动性无关。NASH患者(n=74)源自脂质过氧化产物修饰蛋白,如人血清白蛋白-丙二醛加合物、过氧羟基花生四烯酸(AAHP)、心磷脂氧化物的IgG抗体滴度与单纯肝脂肪变性患者(n=79)相比无明显差异,但与纤维化相关。与年龄、性别、BMI匹配的对照组相比,NASH患者脂质过氧化标记物硫代巴比妥酸反应底物和氧化修饰低密度脂蛋白的血浆水平升高,然而其水平与肝组织学改变无关,可能仅反映胰岛素抵抗。NASH患者的血浆脂质过氧化水平和总抗氧化反应与无肝病的对照组存在差异,但不清楚其是否能鉴别单纯肝脂肪变性与NASH。另一些研究小组检测了抗氧化物如辅酶Q10、锌-铜超氧化物歧化酶水平,其与组织学坏死-炎症活动性是否相关尚存在争议。一些氧化反应通路,包括酶和自由基介导的过程可能参与了NASH时脂质过氧化产物的过度产生。每一条通路产生不同的氧化产物,对这些产物可作定量分析。这些不同通路在NASH发生过程中的作用有待进一步研究。
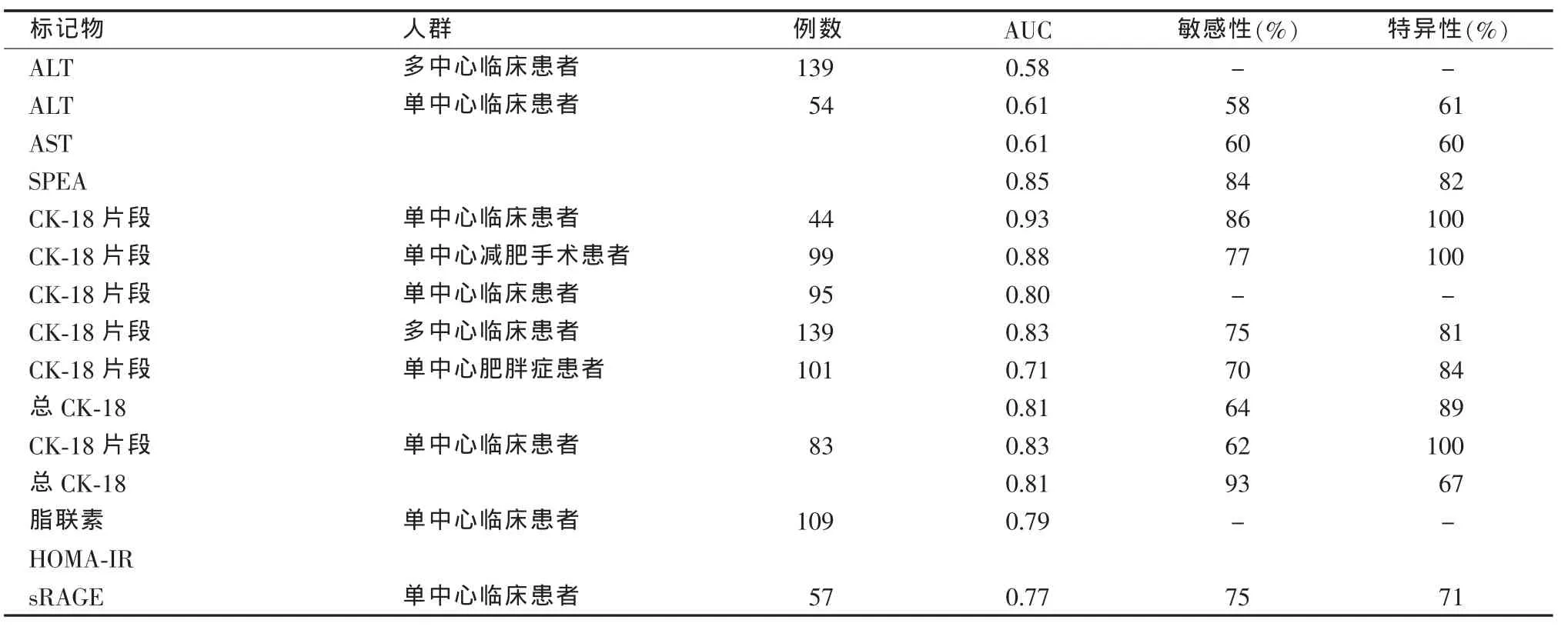
表1 NASH生化预测指标的准确性
NASH的预测模型
由于单个临床或生化标记物不足以准确预测NASH的存在,应使用多个参数组合成数学模型,产生诊断算法(见表2)。最早的模型之一来源于101例行减肥手术的患者队列,参数包括HOMA-IR(homeostasis model assessment of insulin resistance)、ALT和高血压,该模型在这一队列中的AUC为0.90,预测NASH的敏感性和特异性分别为80%和89%。其后,其他来源于减肥手术患者队列并使用类似参数的预测模型的AUC在0.76到0.82之间。这些简单评分在广泛使用前,须在非肥胖症患者中进行独立验证。
结合临床和血清生化标记物的模型用于肝纤维化的预测已得到广泛验证。Poynard等采用此种方法建立的模型(NASHTest)结合了13种变量,包括年龄、性别、身高、体质量以及血清三酰甘油、胆固醇、α2巨球蛋白、载脂蛋白A1、触珠蛋白、GGT、ALT、AST和总胆红素水平(见表2)。该模型来源于160例NAFLD患者,随后在来自不同中心的另97例NAFLD患者中进行了验证。以NAFLD活动性评分>4为NASH诊断标准,两组患者的AUC均为0.79。以资深病理医师作出的NASH诊断为标准,NASHTest在训练集和验证集中的AUC分别为0.78和0.69。一项较小规模的研究在80例NAFLD患者中建立了一个基于AST、BMI、AST/ALT比值、透明质酸和年龄的评分系统(见表2)。该研究得出的AUC准确性为中等(0.76),但未作验证队列研究。
Younossi等以行减肥手术的患者为样本建立了两个应用CK-18测定与脂肪细胞因子组合的模型(见表2)。使用裂解和完整CK-18水平、脂联素和抵抗素组合的模型(NASH diagnostics)来源于含101例患者的队列,AUC在0.73到0.91之间。随后在另一个含79例患者的样本中对该模型作了再评估,得到的AUC相对较低(0.70),由此促成了另一个模型(NASH diagnostic panel)的建立,该模型包括糖尿病、性别、BMI、三酰甘油、CK-18片段和总CK-18水平。这一新模型的AUC水平高于NASH diagnostics或单独应用CK-18片段水平,但尚未在独立样本中进行验证。
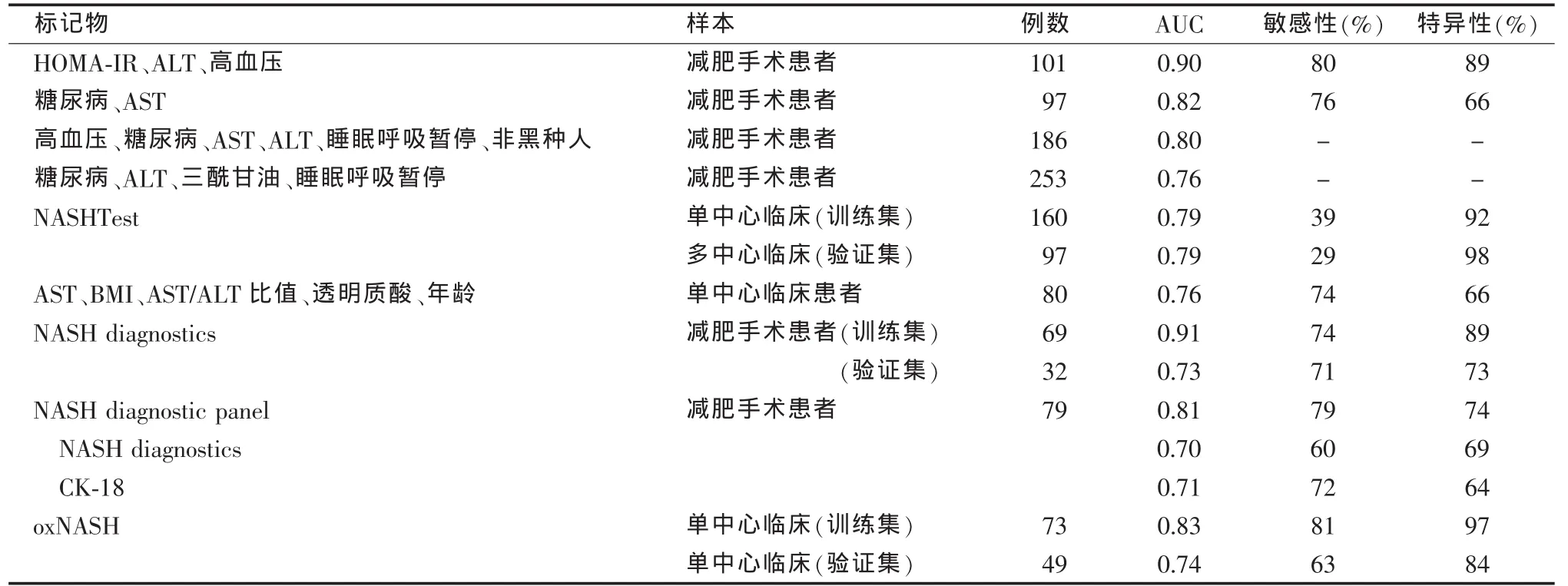
表2 组合模型预测NASH的准确性
最近一项研究应用高敏感性液相色谱-质谱测定技术确定了NASH患者循环中生物活性脂质过氧化产物的特征性参数,并基于该结果在一个大型临床NAFLD患者队列中建立了NASH风险评分系统(oxNASH,包括 13-羟基-十八碳烯酸/亚油酸比值、年龄、BMI和AST)。在独立验证队列中,该评分系统对于鉴别NASH与单纯肝脂肪变性具有较高的诊断准确性。事实上,oxNASH评分升高者(上1/3)患NASH的可能性是低评分者(下1/3)的9.7倍(P<0.0001)。这一简单的风险评分对于确定疾病的存在及其严重程度似具有临床实用性,值得进一步研究。
诊断策略
在多数病例中,根据影像学检查发现肝脂肪变性的证据和临床排除继发性因素后,通常可直接作出NAFLD的诊断。应对所有患者尝试行NAFLD严重程度分级和分期。NASH患者更可能合并更严重的代谢性危险因素,如糖尿病、代谢综合征和(或)严重肥胖症。尽管这些因素无一足以可靠地预测NASH,这些因素不存在时NASH并不常见。转氨酶水平显著升高提示NASH或其他诊断,但ALT和AST水平正常并不能排除进展期疾病。在预测NASH的可用生化标记物中,仅CK-18片段得到独立验证,但该指标不属于常规检查。目前尚无得到充分验证的生化标记物和模型可取代肝活检用于诊断NASH,但这些指标可能改变行肝活检的指征。
在决定行肝活检确诊NASH之前,须权衡虽小但确实存在的损伤风险,包括出血和极少发生的死亡。欧洲肝脏研究学会建议疑有进展期肝纤维化的患者行肝活检,而可能通过调整生活方式减轻体质量和改善潜在的胰岛素抵抗、ALT和其他无创性标记物的患者应避免行肝活检。一些评论者建议,当NASH常见的无创性预测指标为阴性时,对具有进展期肝纤维化危险因素,包括年龄、糖尿病、严重肥胖和代谢综合征者行肝活检是合理的。
概要和结论
NAFLD是一个严重的公共卫生问题。本文复习了关于这一全球性问题临床影响的一些关键因素,以及现有诊断工具的局限和挑战。约7000万美国人受NAFLD困扰,因此迫切需要发现和验证有潜在价值的新的无创性标记物以检出NASH患者。现已采取多种不同手段开发相关检查,随着对NAFLD疾病进展病理生理学机制认识的不断深入,已开发出一些基于发病机制、靶向参与肝损伤和疾病进展至NASH的特异性通路的生物标记物。这些发现有可能在临床实践中为NAFLD的诊断和分期开创一个新纪元。
(略)
译自Adams LA,Feldstein AE.Non-invasive diagnosis of nonalcoholic fatty liver and nonalcoholic steatohepatitis.J Dig Dis,2011,12(1):10-16.
