胃蛋白酶原亚群测定与萎缩性胃炎相关性研究及效价比分析
2011-05-14杜囚鹏曹建彪郭汉斌李浩然
杜囚鹏 曹建彪 郭汉斌 李浩然
资料显示,世界范围内胃癌居恶性肿瘤发病率第四位,死亡率居第二位[1-2]。在日本,胃癌患者的5年生存率为40%~60%,居世界之首;其他国家约20%。中国每年死于胃癌的约有22.7万人,占所有恶性肿瘤死亡的23%。而患者的早期诊断率还不到20%,早期胃癌(early gastric cancer EGC),患者的手术率低于5%~10%[3-4]。EGC如预后良好,5年生存率可达90%以上,而进展期胃癌的5年存活率约为40%[5-6]。因此,胃癌的早期诊断、早期治疗对于提高胃癌的疗效、降低死亡率具有十分重要的意义。通过检测血清中胃蛋白酶原(pepsinogen,PG)水平变化筛查萎缩性胃炎和胃癌,在日本、芬兰等国家已开始应用,使萎缩性胃炎及胃癌的诊断率显著提高,从而很好地改善了患者的预后,但在我国尚属起步阶段。
一 材料
(一)研究对象
收集2010年3月2010年12月于北京军区总医院体检者及住院患者共113例,依据胃镜及病理结果分组如下:正常组(健康体检者)胃镜下观察胃黏膜大致正常且无明显肝、肾疾病者;胃溃疡组(经胃镜证实);萎缩性胃炎组(经胃镜取病理证实);胃癌组(经胃镜取活检或者手术病理证实)。以上研究对象均为汉族居民,在纳入本研究前1周内无特殊用药史(包括质子泵抑制剂和H2受体拮抗剂)且C13呼吸试验呈阴性。表1为纳入本研究的各组研究对象的性别与年龄构成。
(二)主要试剂
胃蛋白酶原Ⅰ放射免疫检测试剂盒(北京永瀚星港生物技术有限公司)。胃蛋白酶原Ⅱ放射免疫检测试剂盒(北京永瀚星港生物技术有限公司)。
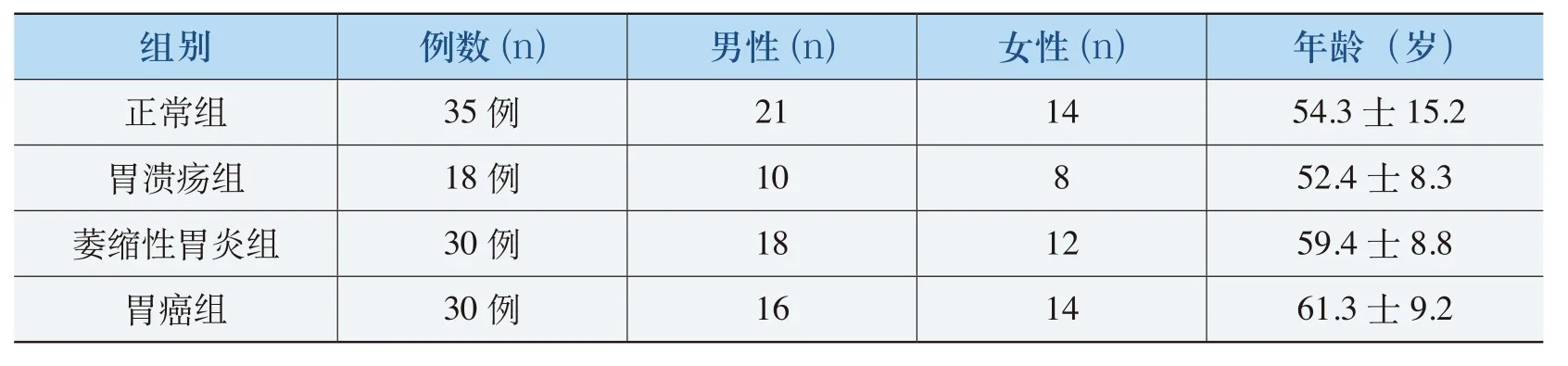
表1 各组中研究对象的性别与年龄构成
(三)主要仪器设备
使用OLYMPUS5421全自动分析仪(日本奥林巴斯公司)进行检测。
二、方法
(一)标本采集
取受检者清晨空腹静脉血3ml,离心(2000G,10~15分钟),分离血清后迅速冻存于-20℃箱备用行同批检测。
(二)血清PGI、PGll含量测定:
采用放射免疫法测定PGⅠ和PGⅡ:
(1)将全部血清标本及PGI、PGll试剂盒平衡至室温(19~27℃),按照试剂盒要求配制洗涤液,稀释血清标本。
(2)向各管中加入20μL标准样或者样本血清,再加入80μL测定液,以及碘125标记单抗100μL。
(3)每个试管中加入包被珠1粒,室温(25℃)震荡3小时。
(4)吸取反应液,用蒸馏水将珠子洗三遍。
(5)将珠子倒入另一干净的试管中,在伽玛计数器上测珠子的放射计数(CPM)。
(6)以标准品的CPM对浓度做标准曲线,根据标准曲线读出未知样品的PGⅠ或者PGⅡ。
(三)胃黏膜的病理学检查
萎缩性胃炎组均以胃镜活检病理诊断;胃癌组均以胃镜活检或者手术后病理诊断为准。
(四)数据处理
用SPSS16.0统计软件进行分析。计量资料以均数正负标准差表示;样本资料性别构成比及年龄运用卡方检验;计量资料经正态性、方差齐检验,方差齐的正态分布资料运用方差分析,P<0.05(双侧)有统计学意义。
三、结果
(一)不同胃黏膜病变患者血清PGⅠ含量的变化情况
与正常组相比,胃溃疡患者血清PGⅠ升高(P=0.029),萎缩性胃炎和胃癌患者血清PGⅠ降低(P<0.05和P<0.05);与胃溃疡组相比,萎缩性胃炎和胃癌患者血清PGⅠ明显低于胃溃疡患者(P<0.001);与萎缩性胃炎组相比,胃癌患者血清PGⅠ值虽略低于萎缩性胃炎组,但差异无统计学意义(P=0.117)。各血清PGⅠ的比较值见表2。
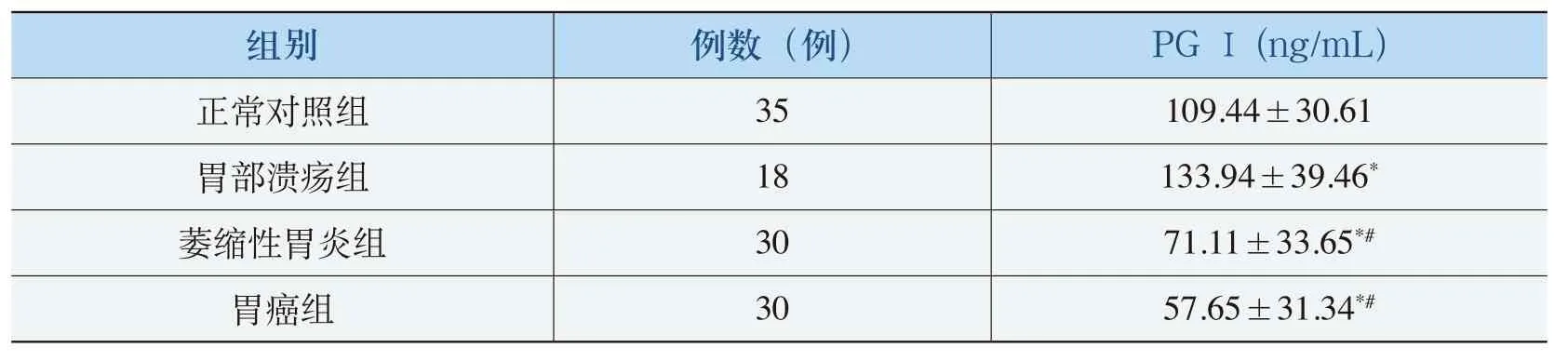
表2 各组血清PGⅠ值的比较
(二)不同胃黏膜病变患者血清PGⅡ含量的变化情况
与正常组相比,胃溃疡患者血清PGⅡ升高(P=0.017),萎缩性胃炎和胃癌患者血清PGⅡ与正常组无统计学差异(P=0.07和P=0.39);与胃溃疡组相比,萎缩性胃炎和胃癌患者血清PGⅡ低于胃溃疡组(P=0.036和P=0.001);与萎缩性胃炎组相比,胃癌患者血清PGⅡ值虽略低于萎缩性胃炎组,但差异无统计学意义(P=0.097)。各血清PGⅡ的比较值见表3.
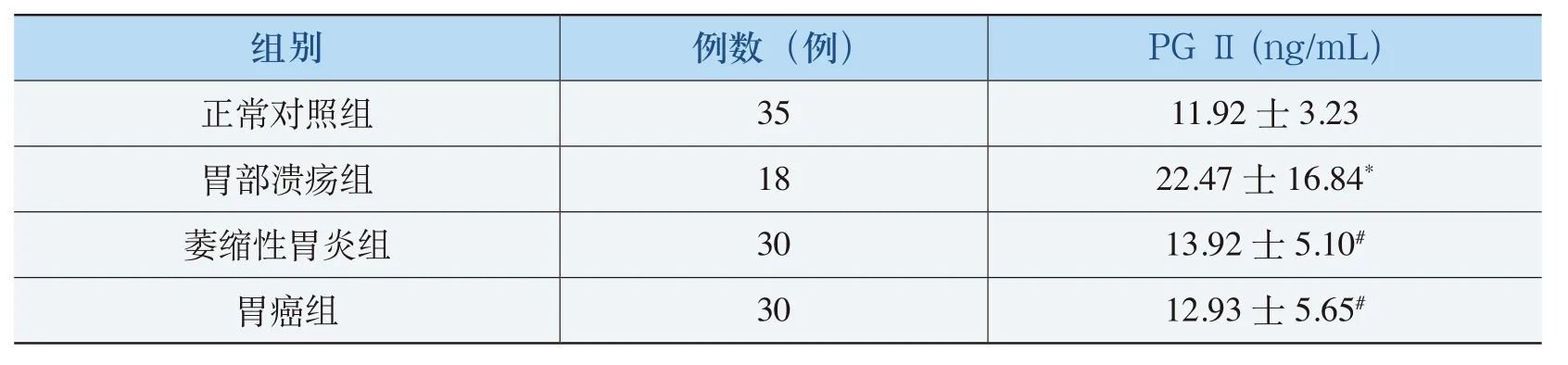
表3 各组血清PGⅡ值的比较
(三)不同胃黏膜病变患者血清中PGⅠ/PGⅡ比值的变化情况
与正常组相比,胃溃疡患者血清PGⅠ/PGⅡ比值降低(P=0.035),萎缩性胃炎、胃癌患者血清PGⅠ/PGⅡ比值降低(P<0.05,P<0.05);与胃溃疡组相比,萎缩性胃炎和胃癌患者血清PGⅠ/PGⅡ比值均低于胃溃疡组(P=0.046,P=0.001);与萎缩性胃炎组相比,胃癌组患者血清PGⅠ/PGⅡ比值虽略低于萎缩性胃炎组,但差异无统计学意义(P=0.097)。各血清PGⅠ/PGⅡ值的比较详见表4。
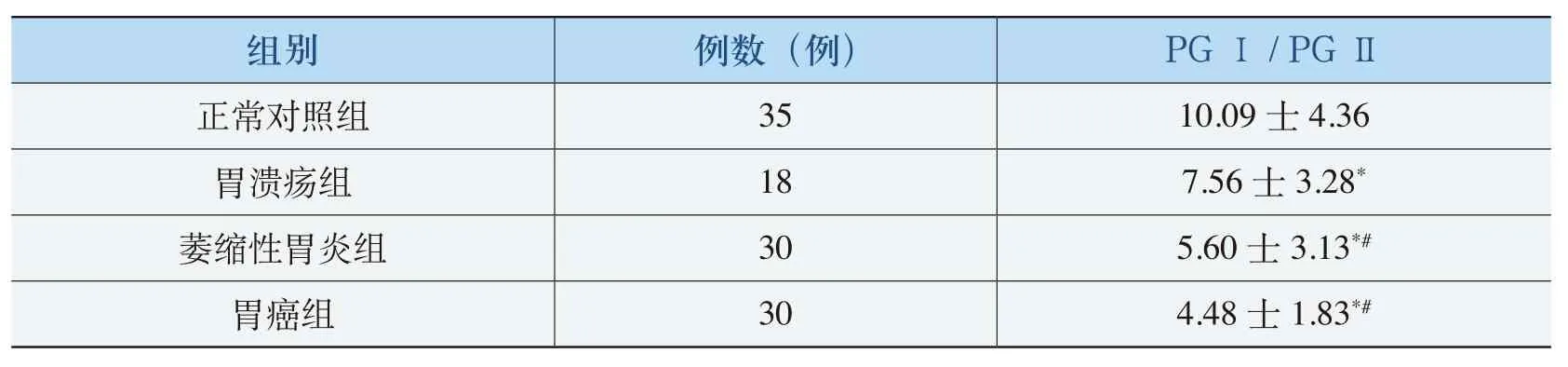
表4 各组血清PGⅠ/PGⅡ值的比较
(四)血清PGⅠ检测萎缩性胃炎的阳性界定值判定
不同血清PGⅠ界定值对萎缩性胃炎的检出情况及其灵敏度和特异度见表5和图1。受试者工作特征曲线(ROC曲线)显示曲线下面积为0.756,所以该曲线对萎缩性胃炎具有较好的诊断价值;当PGⅠ≤80ng/mL时,检测萎缩性胃炎的灵敏度和特异度分别为66.7%和85.7%,相对较好。
(五)血清PGⅠ/PGⅡ比值检测萎缩性胃炎的阳性界定值判定
不同血清PGⅠ/PGⅡ比值的界定值对萎缩性胃炎的检出情况及其灵敏度和特异度见表6和图2。受试者工作特征曲线(ROC曲线)显示曲线下面积为0.783,所以该曲线对萎缩性胃炎具有较好诊断价值;PGⅠ/PGⅡ≤(5~6)时检测萎缩性胃炎的灵敏度和特异度相对较好,PGⅠ/PGⅡ≤5时特异度和灵敏度分别为88.6%和53.3%,PGⅠ/PGⅡ≤6时分别为82.9%和60%。
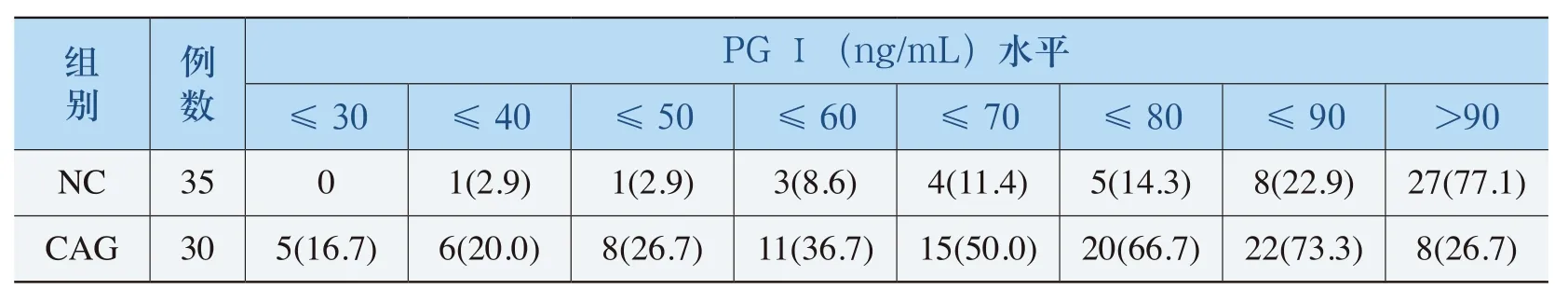
表5 不同血清水平PGⅠ(ng/mL)值对萎缩性胃炎的检出率(%)
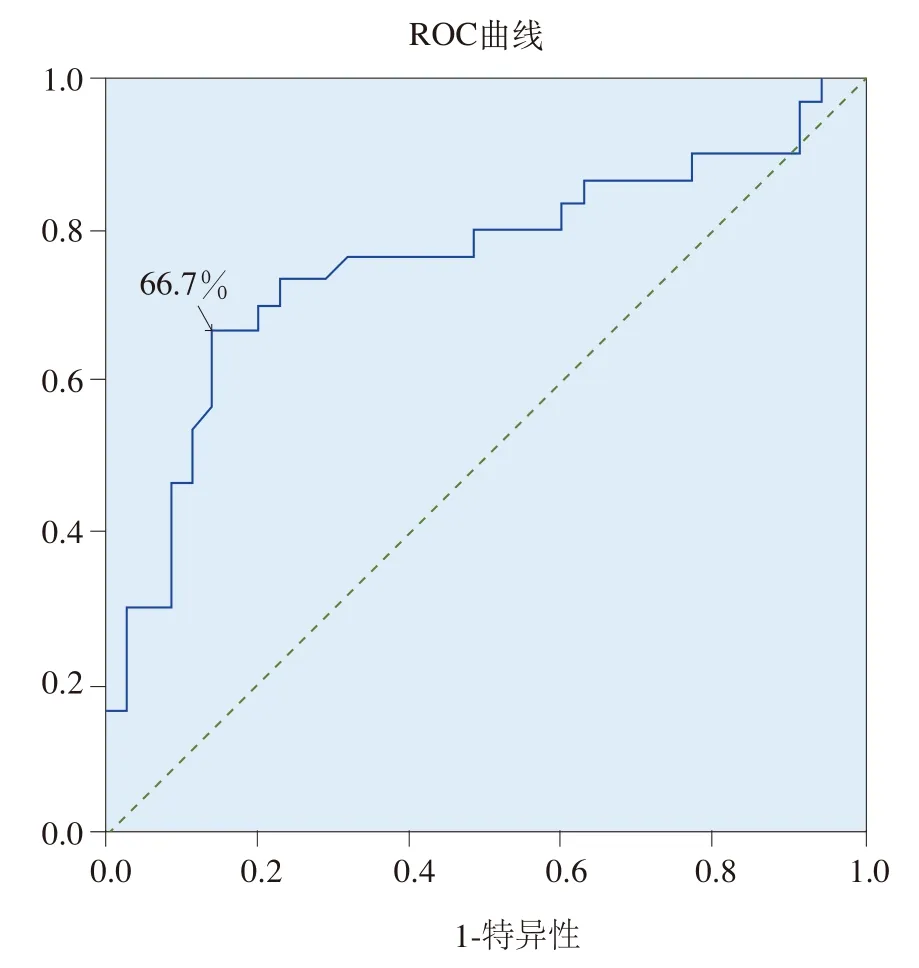
图1 根据不同血清PGⅠ(ng/mL)值检出萎缩性胃炎的特异度和灵敏度的ROC曲线
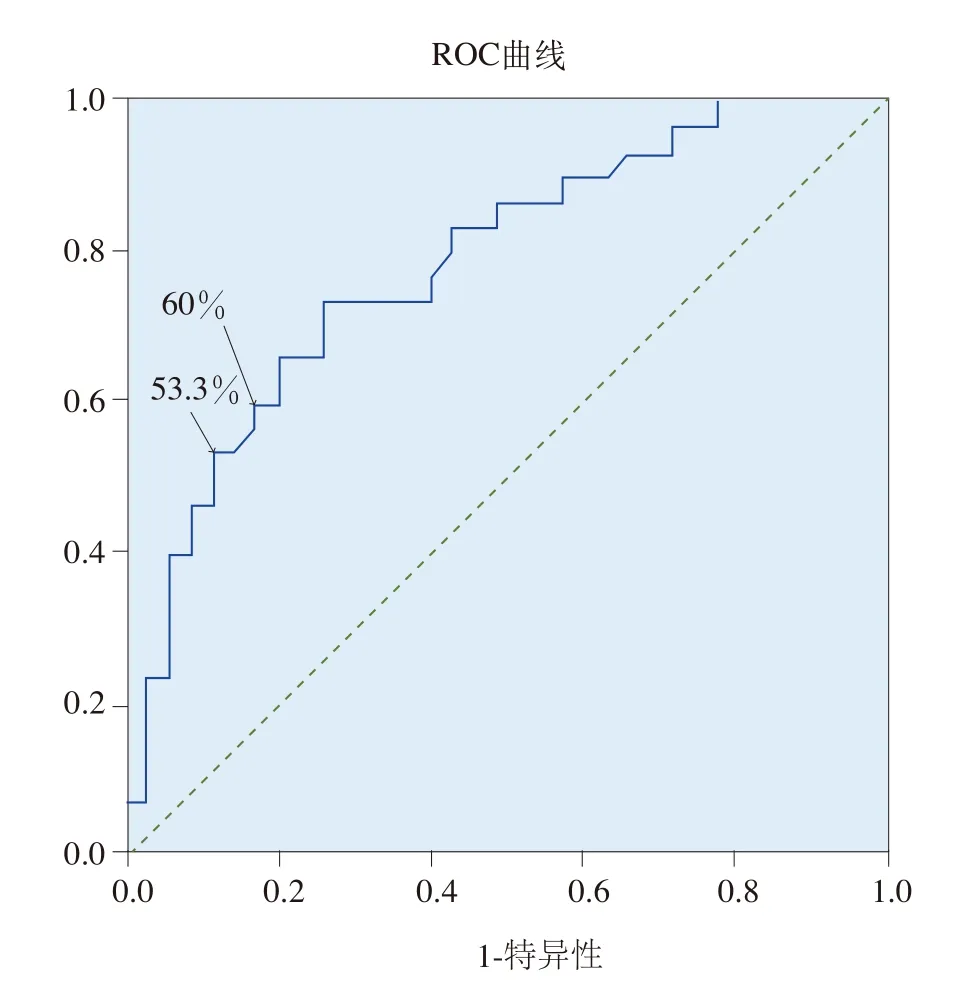
图2 根据不同PGⅠ/PGⅡ的界定值检出萎缩性胃炎的特异度和灵敏度的ROC曲线
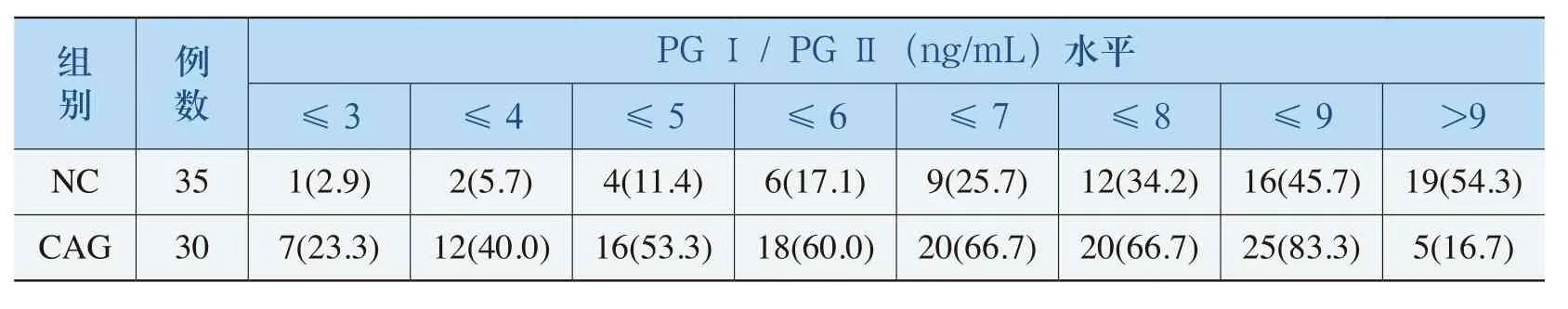
表6 不同血清水平PGⅠ/PGⅡ的界定值对萎缩性胃炎的检出率(%)
(六)血清PGⅠ和PGⅠ/PGⅡ联合检测萎缩性胃炎的阳性界定值判定
与单独检测血清PGⅠ和PGⅠ/PGⅡ相比,两项联合检测可以提高检测的特异性(见表7)。PGⅠ≤80ng/mL且PGⅠ/Ⅱ≤6时,检出萎缩性胃炎的特异度和灵敏度分别为94.3%和53.3%。
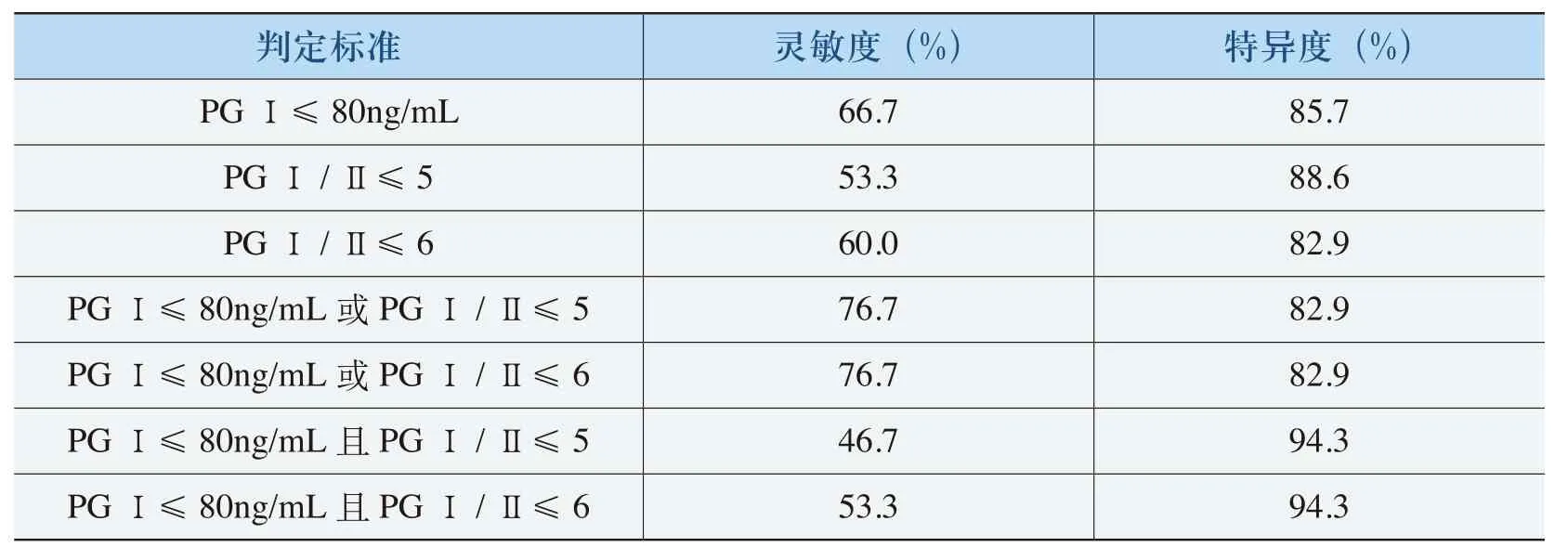
表7 血清PGⅠ、PGⅠ/PGⅡ单独及联合检测萎缩性胃炎的灵敏度和特异度比较
(七)胃蛋白酶原检测与胃镜和(或)取病理检查的效价比
此项检查PGⅠ≤80ng/mL且PGⅠ/Ⅱ≤6时,检出萎缩性胃炎的特异度和灵敏度较高,分别为94.3%和53.3%。由于其费用低,适用于初筛及胃镜检查禁忌者,大大节约了国家医疗资源。表8为胃蛋白酶原检测与胃镜、胃镜并取病理的检测费用比较。
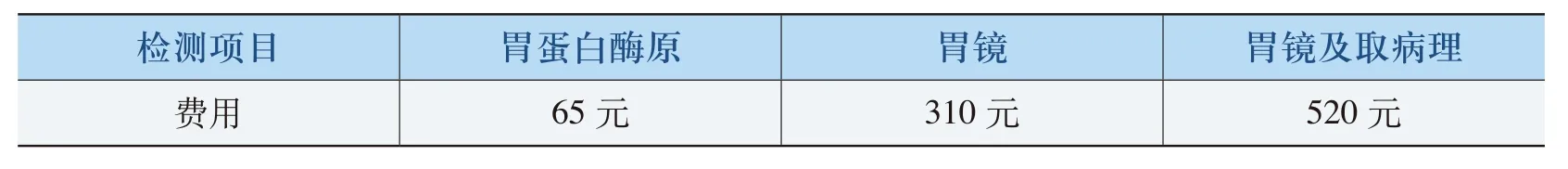
表8 PG检测与胃镜、胃镜并取病理的项目费用
四、讨论
PGⅠ和PGⅡ的细胞来源和组织分布各不相同,PGⅠ主要由胃底腺的主细胞和颈黏液细胞分泌,PGⅡ则由全胃腺(包括胃贲门腺、胃底腺、胃窦幽门腺)和近端十二指肠的Brunner腺产生。大部分PG分泌入胃腔,约1%透过胃黏膜毛细血管进入血液中,故可以从血清中检测到,因为胃部几乎是PG唯一来源,所以检测血清中PG水平可准确地反映胃黏膜组织学状况[7-9]。目前国内有关PGⅠ,PGⅠ/PGⅡ比值与萎缩性胃炎及胃癌的关系尚无理想的研究,其判断界值差异也较大[10-14],本研究采用了敏感性较高的放射免疫法,排除了性别、种族及年龄等因素对检测结果的影响,用来测定不同组别血清中胃蛋白酶原的水平。研究结果显示:
(1)与正常组相比,消化性溃疡由于壁细胞数量增加,胃酸分泌增多,高酸刺激胃部腺体导致PGⅠ、PGⅡ大量分泌,而且PGⅡ增高明显(P=0.029,P=0.017),所以导致PGⅠ、PGⅡ进入血循环的量增加[15,16]、PGⅠ/PGⅡ比值降低(P=0.035)。本研究与既往研究结果相符。萎缩性胃炎组及胃癌组血清PGⅠ水平均呈下降趋势,这可能与胃黏膜发生萎缩或癌变及胃腺萎缩使分泌蛋白酶原能力减弱有关。而血清PGⅡ水平变化不明显,可能是因为分泌PGⅡ的胃黏膜细胞分布较广以及幽门腺化生使PGⅡ产生增多。萎缩性胃炎和胃癌组由于PGⅠ明显下降(P<0.05)、PGⅡ变化不大(P=0.39),导致PGⅠ/PGⅡ比值下降(P<0.05),与国外文献报道结果一致[10-13]。
(2)与溃疡组相比,萎缩性胃炎和胃癌患者血清PGⅠ明显低于胃溃疡患者(P<0.001,P<0.001),血清PGⅡ低于胃溃疡组(P=0.036,P=0.001),血清PGⅠ/PGⅡ比值也低于胃溃疡组(P=0.046,P=0.001)。溃疡患者高酸刺激导致PGⅠ和PGⅡ分泌增加,进入血液循环量增加,而萎缩性胃炎及胃癌患者因胃腺萎缩、致癌因子使产生胃蛋白酶原的基因突变等导致PGⅠ和PGⅡ分泌减少。
(3)与萎缩性胃炎组相比,胃癌患者血清PGⅠ、PGⅡ及PGⅠ/PGⅡ比值虽略低于胃癌组,但差异无统计学意义(P=0.117,P=0.097,P=0.097)。此结论与既往文献报道不符,本研究虽采用了敏感性比较高的放射免疫方法,但仍未能做出萎缩性胃炎及胃癌之间的统计学差异。其原因可能与胃癌组患者中早期胃癌所占比例较大相关(66.7%)。
(4)由上得出结论,PGⅠ和PGⅠ/PGⅡ比值降低是胃癌及萎缩性胃炎发生的警戒信号之一。检测血清PGⅠ和PGⅠ/PGⅡ比值简单、易行,且经济,易被人们接受,可以作为高危人群筛查和辅助诊断的项目。待发现问题后再进一步行胃镜及病理检查,从而达到萎缩性胃炎及胃癌早期诊断的目的。
(5)在本研究中萎缩性胃炎患者血清中PGⅠ和PGⅠ/PGⅡ比值均稍高于胃癌组,无统计学差异(P=0.117,P=0.097),所以制定萎缩性胃炎PGⅠ和PGⅠ/PGⅡ的阳性界定值,由此可以达到对萎缩性胃炎及胃癌早期诊断的目的。以血清PGⅠ、PGⅠ/PGⅡ分别做ROC曲线,该曲线的运用也对萎缩性胃炎具有较好的诊断价值。本研究又进一步做了单独检测血清PGⅠ和PGⅠ/PGⅡ,及两项联合检测之间灵敏度和特异度的比较,发现联合应用可以提高检测的特异度(见表7)。PGⅠ≤80ng/mL且PGⅠ/PGⅡ≤6时,检出萎缩性胃炎的特异度和灵敏度分别为94.3%和53.3%。因与萎缩性胃炎组相比,胃癌患者血清PGⅠ、PGⅡ及PGⅠ/PGⅡ比值虽略低于萎缩性胃炎组,但差异无统计学意义。所以按此界定值可同时达到对萎缩性胃炎及胃癌的筛查和辅助诊断。
(6)目前PGⅠ及PGⅠ/PGⅡ与萎缩性胃炎及胃癌的相关性尚无理想的研究。虽然血清PGⅠ、PGⅡ和PGⅠ/PGⅡ比值在不同疾病状态下的变化趋势国内外研究结果较一致,但作为判断的界定值差异还比较大。鉴于我国是胃癌高发区,如果能进一步开展大规模、多中心、高质量的前瞻性研究,明确PG在我国癌前病变及胃癌筛查中的价值,并制定出标准参考数据,将对我国胃癌的防治工作产生重要影响。
[1]Kwong Ming Fock,Nick Talley.Asia–Pacific consensus guidelines on gastric cancer prevention[J].Journal of Gastroenterology and Hepatology,2008,23:351–365
[2]Kuninushi Kiyohira,Masaharu Yoshihara.Serum pepsinogen concentration as a marker of Helicobacter pylori infection and the histologic grade of gastritis;evaluation of gastricmucosa by serum pepsinogen levels[J].Journal of gastroenterol,2003,38:332–338
[3]Diana Aulia,Gaby Octavia Manz.Pepsinogen I Concentration in Organic Dyspepsia Patients at Gastroenterology Division[J].Acta Med Indones-Indones J Intern Med,2009,41(3):107-114
[4]Kuninushi Kiyohira,,Masaharu Yoshihara.Serum pepsinogen concentration as a marker of Helicobacter pylori infection and the histologic grade of gastritis;evaluation of gastricmucosa by serum pepsinogen levels[J].Journal of gastroenterol,2003,38:332–338
[5]Diana Aulia,Gaby Octavia Manz.Pepsinogen I Concentration in Organic Dyspepsia Patients at Gastroenterology Division[J].Acta Med Indones-Indones J Intern Med,2009,41(3):107-114
[6]R sierra.Antibodies to Helicobcter Plyori and pepsinogen Levels in children from costa rica:comparison of two areas with different risks for stomach cancer[J].Cancer Epdemiology,1992,(1):149-154
[7]Ma rio Dinis-Ribeiro.Validity of Serum Pepsinogen I/II Ratio for the Diagnosis of Gastric Epithelial Dysplasia and Intestinal Metaplasia during the Follow-Up of Patients at Risk for Intestinal-Type Gastric Adenocarcinoma[J].Pepsinogen Validity in Intestinal Metaplasia and Gastric Dysplasia,2004,6(5):449-456
[8]Jian-Song Ren,Farin Kamangar.Serum pepsinogens and risk of gastric and esophageal cancers[J].Gut,2009,58(5):636–642
[9]Miyoko Yamaoka and Shigemi Nakajima.Prevalence of Subjects at a High or Very High Risk of Gastric Cancer in Japan[J].Gut and Liver,2009,3(2):95-100
[10]Je woo.kim and ki sup chung.Serum gastrin and pepsinogenⅠandⅡconcentrations in children with Helicobacter pylori.infection:the role of cagA and vacA.Yonsei MedicalJournal,1998,39(2):159-165
[11]Hirokazu Tamura,Hidetsugu Tokushima.Influences of Helicobacter pylori on serum pepsinogen concentrations in dialysis patients[J].Nephrology Dialysis Transplantation,1999,14:113-117
[12]Yuichi.Yasunaga MD.High prevalence of serum immunoglobulin Gantibody to Helicobacter pylori and raised serum gastrin and pepsinnogen Levels in enlarged fold gastritis.Can J Gastroenterol,1997,5(11):433-436
[13]蒋孟军,肖志坚.胃癌患者血清胃蛋白酶原含量的检测及其临床意义[J].实用癌症杂志,2000,15(1):40-42
[14]张祥宏,卜玉华.血清胃蛋白酶原异常居民胃粘膜变化的随访观察[J].中国肿瘤临床,2000,27(7):491-494
[15]Antonio Rollan,Catterina Ferreccio.Non-invasive diagnosis of gastric mucosal atrophy in an asymptomatic population with high prevalence of gastric cancer[J].World Journal of Gastroenterology,2006,44(12):7172-7178
[16]曹勤,冉志华,萧树东.血清胃蛋白酶原、胃泌素-17和幽门螺杆菌IgG抗体筛查萎缩性胃炎和胃癌[J].胃肠病学,2006,11(7):388-394
