第四部分 《规则》制定与实施的评价
2011-05-04
第四部分 《规则》制定与实施的评价
课题组运用调查问卷(量表)和药品价格调查表及网上价格信息,对《规则》制定和实施前后的评价与效果进行了调查,获得了较充分的调查数据。根据这些调查数据及分析,对《规则》的制定和实施情况进行分析与评价。
一、《规则》的评价视角
在本课题的研究中,课题组主要从理论、动态发展、结构分析和国际比较以及综合效益等视角,对《规则》的制定和实施情况进行了分析和评价。
(一)《规则》的理论评价
从理论分析的视角,课题组主要对《规则》的执行效果进行分析和评价。此评价视角在第二部分中加以运用和体现,主要分析药品、药品价格和药品价格管理等方面的特性,以及《规则》的理论基础。
(二)《规则》的动态评价
从动态发展的视角,对《规则》执行前后的药品价格变化情况进行历史比较与评价。此评价视角在第四部分的“《规则》制定与实施的评价”中加以运用和体现。
(三)《规则》的区域评价
从结构分析的视角,对各省、自治区、直辖市价格主管部门执行《规则》效果进行区域比较和评价。此评价视角在第四部分的“《规则》制定与实施的评价”中加以运用和体现。
(四)《规则》的国际评价
从国际药品价格规制的视角,将我国《规则》执行效果与其他主要国家采用不同药品价格管理模式的效果进行比较与评价。此评价视角在第二部分的“《规则》的理论基础和法律政策依据”中加以运用和体现。
(五)《规则》的综合效益评价
从综合效益的视角,对《规则》执行的产业贡献率、经济贡献率和社会贡献率等方面进行综合评价。此评价视角在第四部分的“《规则》制定与实施的评价”中部分加以运用和体现。
这五个方面的分析和评价视角互为一体,共同体现于《规则》的制定和实施情况的分析与评价之中。
二、《规则》制定的评价
对于《规则》制定情况,主要从《规则》制定目的、适用范围、差比价关系、差比价考虑因素、差比价代表品、差比价系数等六个方面进行数据分析和评价。
(一)《规则》的制定目的评价
在表4-1中,被调查者对于《规则》制定与实施的目的合理性评价的均值(Mean)为8.64,标准差(Std. Deviation)只有1.731,中位数(Median)为9.00,众数(Mode)为10,从百分位数P10开始均在6.00以上(即90%以上被调查者评价在6.00以上)。这些数据分析结果在图4-1的箱线图得到充分显示,即中位数为9,上四分位数为10,下四分位数为8。这说明被调查者对《规则》的目的的合理性评价具有较高集中度,离散程度较小。因此,以均值8.64的评价可以看出《规则》的制定与实施具有较高的合理性。
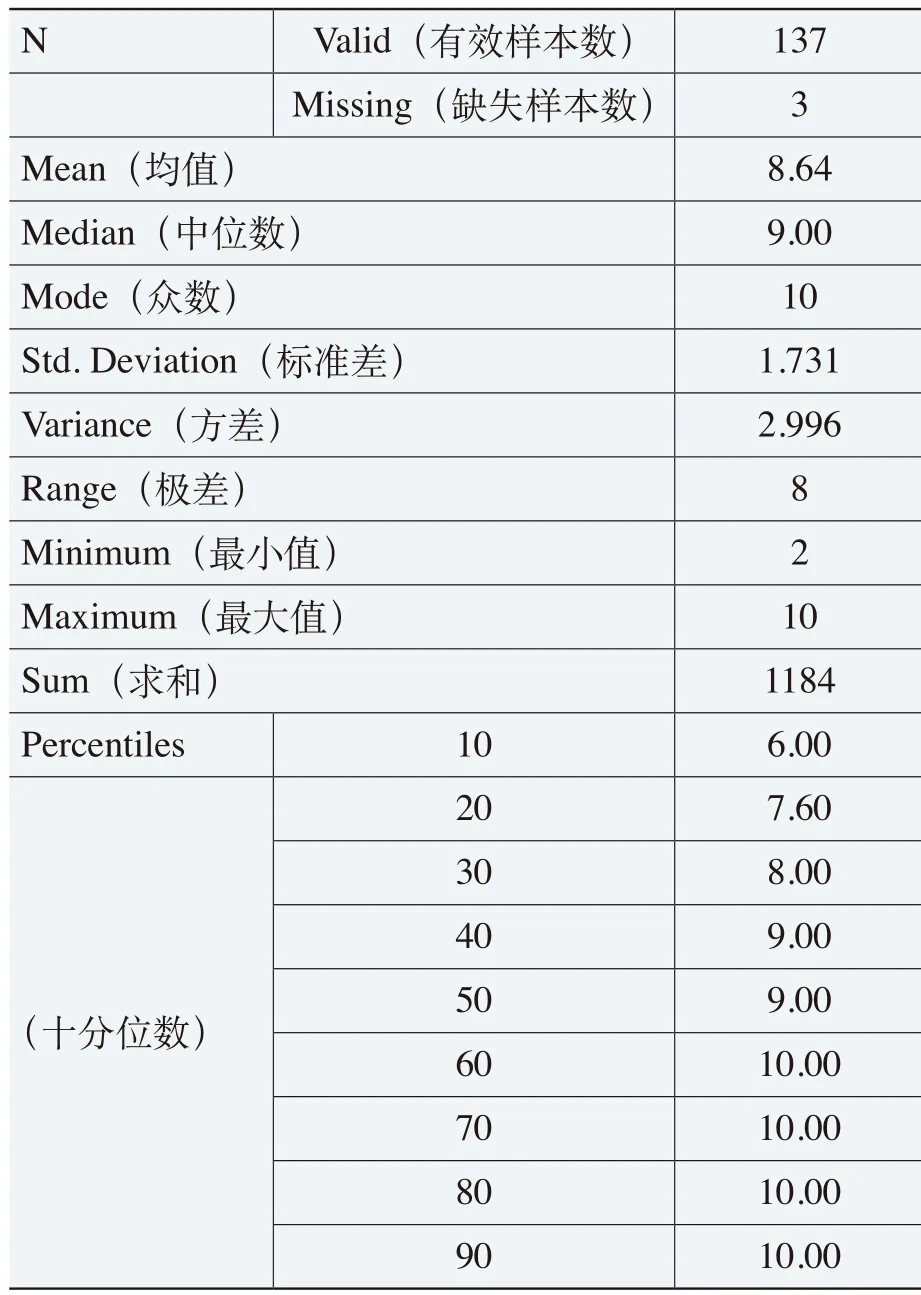
表4-1 《规则》的目的合理性评价表
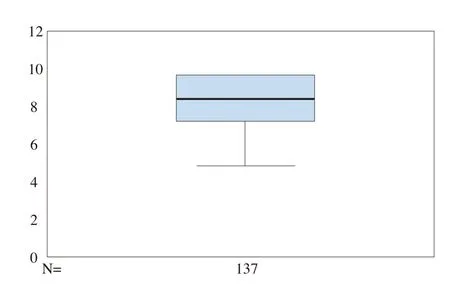
图4-1 《规则》的制定目的的合理性评价

表4-2 《规则》规制药品价格的可行性评价表
在表4-2中,被调查者对于运用《规则》来规制药品价格的可行性评价的均值(Mean)为7.88,中位数(Median)为8.00,众数(Mode)为8.00,十分位数P20为6.00,80%的被调查者对《规则》的可行性评价在6.00以上;而标准差Std. Deviation)仅为1.866,这说明对可行性评价的离散程度较低,对《规则》可行性评价具有较高的集中趋势。
(二)《规则》的适用范围评价
对《规则》的适用范围主要分为化药、中药和生物制品。其中化药分为专利药、原研制药和仿制药;中药分为传统名中药、保密处方等中药、优质优价中药和其他中药。对于适用范围的评价主要从合理性和全面性两个角度进行评价。
1.《规则》适用范围的合理性评价
对《规则》适用范围的合理性评价的统计分析结果见表4-3。从该表中可以看出,《规则》对化药进行规制的合理性程度为7.24,生物制品合理性程度为6.27,中药的合理性程度为6.21。结合这些指标的中位数和众数以及“6分”以上所在百分位数的位置来看,《规则》对化药、生物制品和中药的规制合理性得到社会各界的认可,而且合理性程度均在62%以上。
但是,《规则》适用范围的合理性程度在化药、中药和生物制品中略有差异:《规则》对化药进行规制的合理性程度最高,尤其是化药中的仿制药更是呈现这样的特点;《规则》对生物制品和中药规制的合理性程度比化药略低。究其原因,主要有两个方面:一是被调查者对于生物制品和中药了解程度比化药的要低,被调查者中“无明确意见”(见“选5所占比重”),即基本接近或超过25%。二是生物制品和中药在剂型和规格的变化程度要比化药要少,因而被调查者对《规则》中的化药进行规制的合理性相对评价较高。化药中的“专利药”和“原研制药”表现出与生物制品和中药类似的评价特点及其原因(这里不再赘述)。
通过对“无明确意见”(即因不了解而无法评价《规则》对药品进行规制合理性)的样本进行数据净化,而得到表4-4的统计分析结果。
从表4-4可以明显看出对药品及其价格比较了解的被调查者对《规则》适用范围的评价态度:《规则》对化药、生物制品和中药进行规制的合理性程度均值分别为7.53、6.78和6.64,评价分值在“6”以上被调查者分别占到80%、80%和70%以上。因此,《规则》适用范围的合理性得到较高的评价,尤其是对仿制类药品进行规制具有更高的合理性。
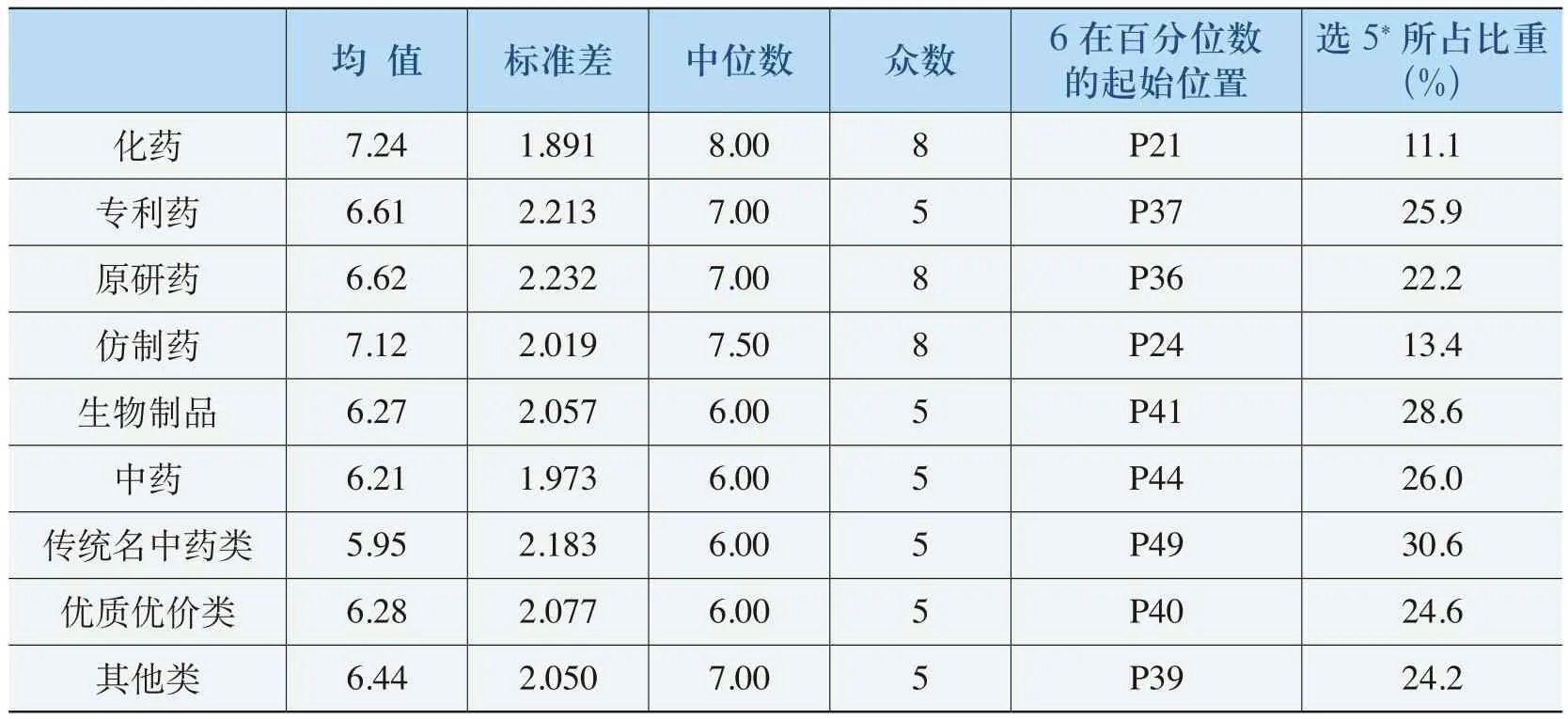
表4-3 《规则》适用范围的合理性评价表
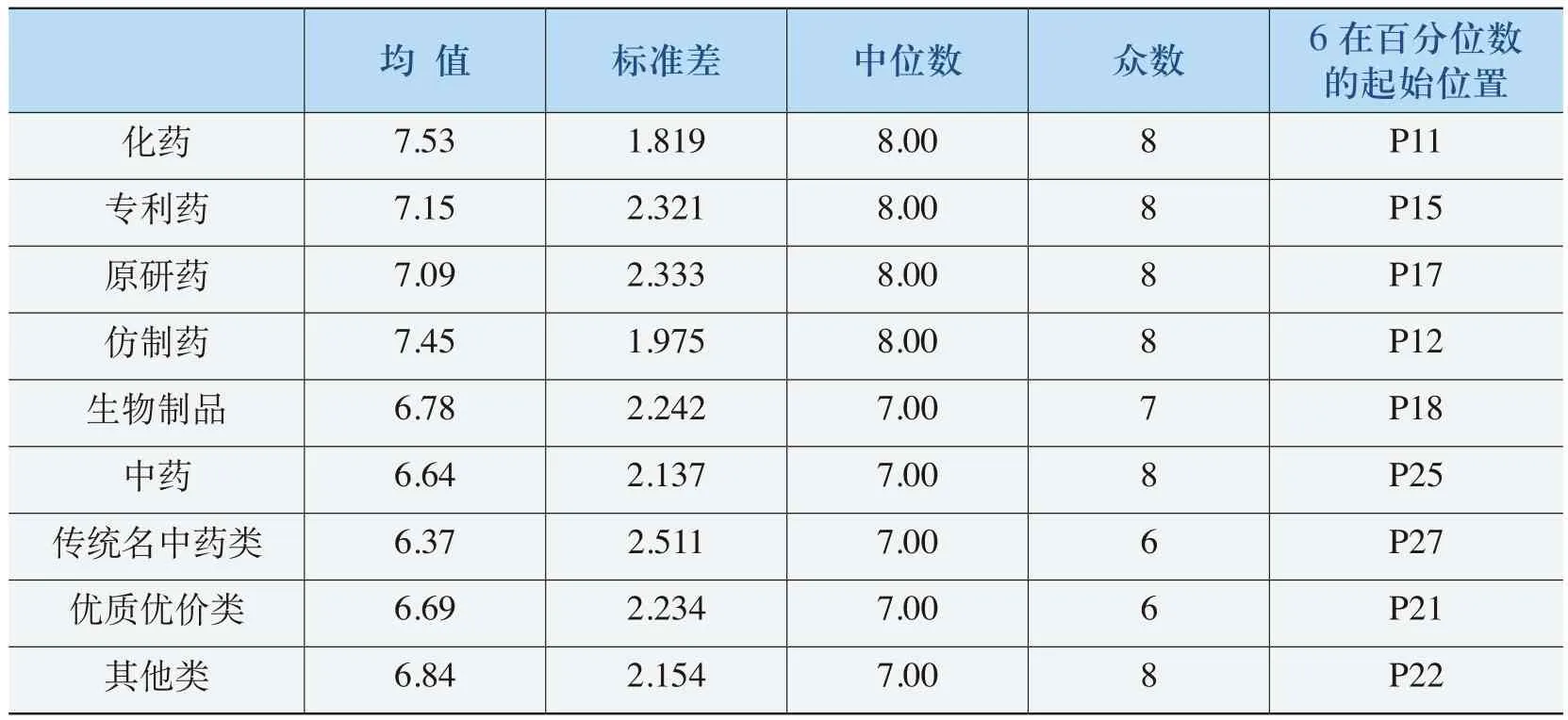
表4-4 《规则》适用范围的合理性评价(净化)表
2.《规则》适用范围的全面性评价
表4-5是关于《规则》对化药、生物制品和中药的全面性程度评价的统计分析结果。
在表4-5中,《规则》在化药的适用的范围全面性程度高于生物制品和中药,其均值达到7.03,其中仿制药达到7.10,评价为“6”以上的达到70%以上。生物制品和中药(除传统名中药类以外)均值都在6.20以上,评价为“6”以上达到60%以上。化药、生物制品和中药的全面性评价与其合理性评价基本一致。
表4-5中,选“5”(即“无明确意见”)在化药的专利药和原研制药、生物制品和中药的比重均在22%以上,因此需要对“无明确意见”的样本进行数据净化,结果见表4-6。

表4-5 《规则》适用范围的全面性评价表
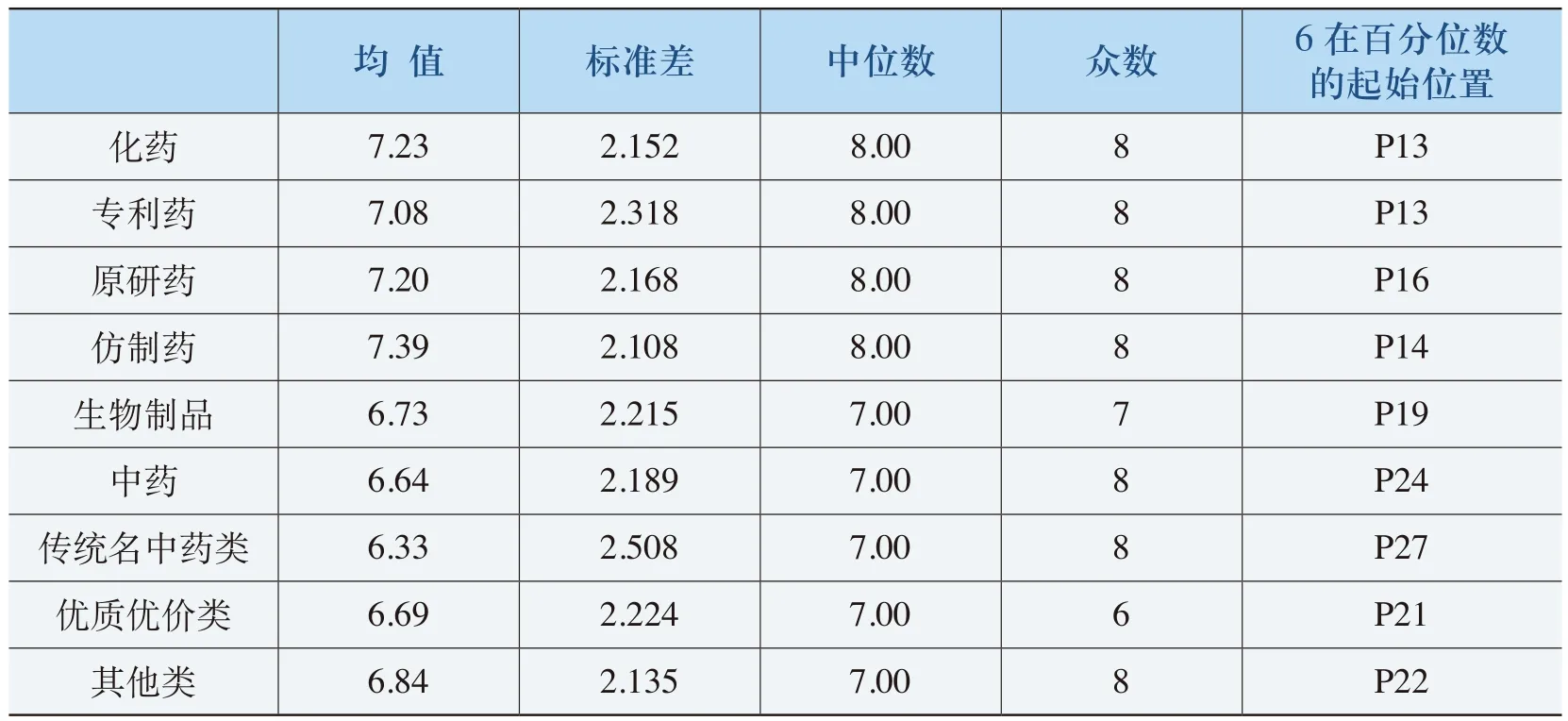
表4-6 《规则》适用范围的全面性评价(净化)表
根据表4-6的分析结果,《规则》适用范围的全面性评价得分的均值在6.60以上,其中,化药全面性评价均值达到7.23;评价在6以上均达到70%以上,化药和生物制品达到80%以上。《规则》的适用范围全面性评价与其合理性程度评价比较一致。
(三)《规则》的差比价关系评价
《规则》的差比价主要是考虑同种药品因剂型、规格或包装材料的不同而形成的价格之间的差额或比值。其中,规格差比价主要包括含量、装量、重量、包装数量或药品性状等。对于《规则》的差比价关系评价主要从必要性和合理性两个方面进行评价。
1.《规则》差比价关系的必要性评价
《规则》差比价关系的必要性评价的统计分析结果见表4-7。从该表中可以看出,《规则》对剂型差比价关系规制的必要性程度为8.54,规制规格差比价关系必要性程度为8.63,规制包装材料差比价关系必要性程度为7.96。结合这些指标的中位数和众数以及“6分”以上所在百分位数的位置来看,《规则》对剂型差比价关系、规格差比价关系和包装差比价关系规制的必要性得到了社会各界的认可,而且合理性程度均在85%以上(除了包装材料差比价关系的必要性评价均值为79.6%)。
2.《规则》差比价关系的合理性评价
关于《规则》对剂型差比价关系、规格差比价关系和包装材料差比价关系规制的合理性评价的统计分析结果见表4-8。
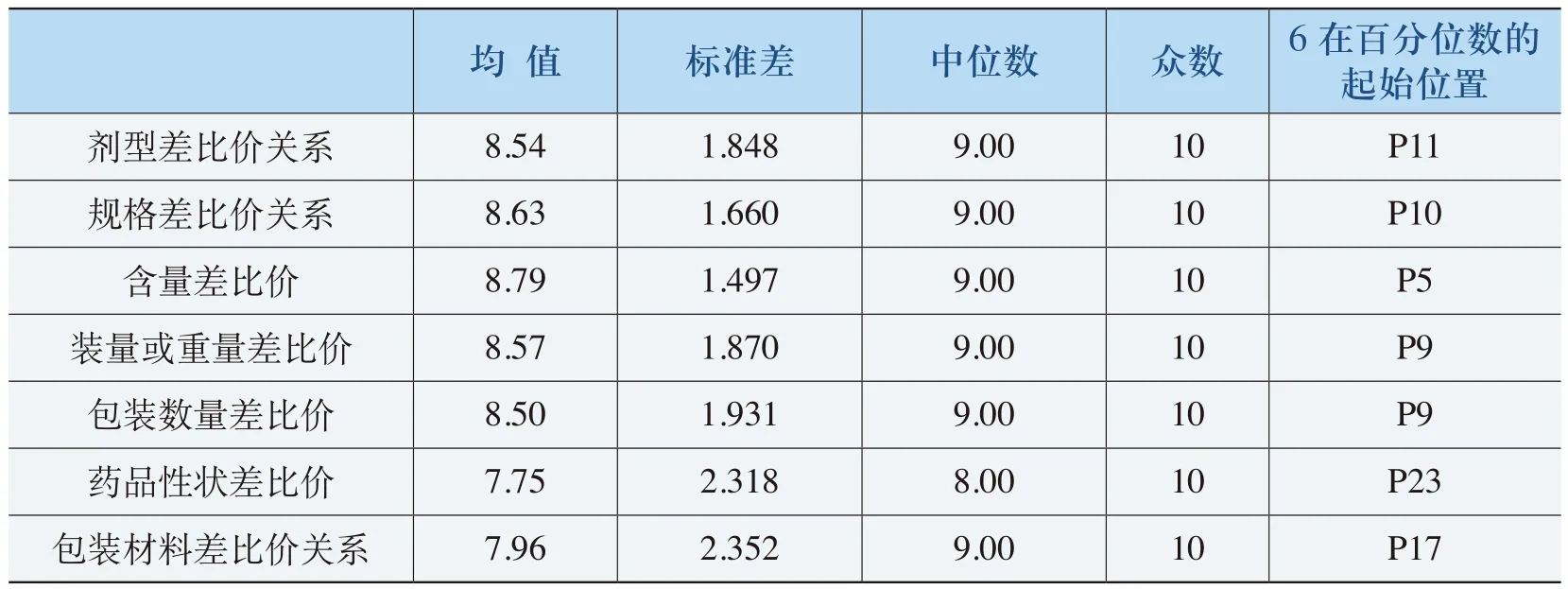
表4-7 《规则》差比价关系的必要性评价表
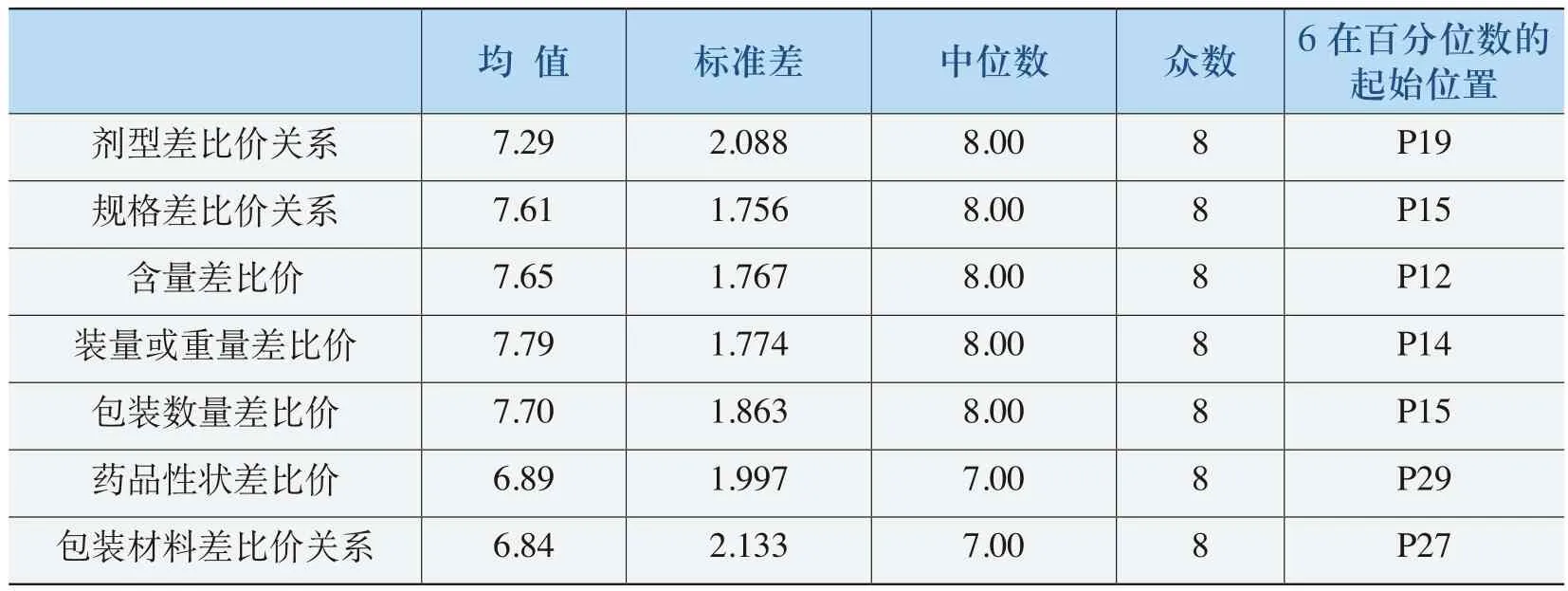
表4-8 《规则》差比价关系的合理性评价表
在表4-8中,《规则》对剂型差比价关系和规格差比价关系规制的合理性程度均值分别为7.29和7.61,要高于对包装材料差比价关系规制的合理性程度。剂型差比价关系和规格差比价关系(除药品性状差比价)评价为“6”以上达到80%以上。包装材料差比价关系评价为“6”以上达到73%以上。对剂型差比价关系、规格差比价关系和包装材料差比价关系规制的合理性程度评价基本一致。
(四)《规则》中差比价考虑因素的评价
《规则》中差比价考虑因素主要从化药、生物制品和中药三个方面考虑。其中化药分为专利药、原研制药和仿制药;中药分为传统名中药、保密处方等中药、优质优价中药和其他中药。对于考虑因素的评价主要从全面性和合理性两个角度进行评价。
1.《规则》中差比价考虑因素的全面性评价
《规则》中差比价考虑因素的全面性评价的统计分析结果见表4-9。从该表中可以看出,《规则》对差比价考虑因素总的全面性均值为7.74。对化药考虑因素的全面性程度均值达7.18;对生物制品考虑因素的全面性程度均值达6.99;对中药考虑因素的全面性均值都在6.5以上。结合这些指标的中位数和众数以及“6分”以上所在百分位数的位置来看,对化药、生物制品和中药(除传统名中药类),《规则》中差比价考虑因素的全面性得到社会各界的认可,而且合理性程度均在64%以上。
但是,《规则》中差比价考虑因素的全面性程度在化药、生物制品和中药三方面略有差异:《规则》对化药考虑因素的全面性程度最高,尤其是化药中的仿制药更是呈现这样的特点;《规则》对生物制品和中药考虑因素的全面性程度比化药略低。究其原因,主要有两个方面:一是被调查者对于生物制品和中药的了解程度比化药的要低,被调查者中“无明确意见”(见“选5所占比重”)的基本接近或超过25%。二是生物制品和中药在剂型和规格的变化程度比化药少,因而被调查者对《规则》在规制化药时考虑因素的合理性相对评价较高。化药中的“专利药”和“原研制药”表现出与生物制品和中药类似的评价特点及其原因,不再赘述。

表4-9 《规则》中差比价考虑因素的全面性评价表
表4-9中选“5”(即“无明确意见”)的,化药的专利药的比重接近20%;在生物制品和中药的比重均在22%以上,在中药的比重都在25%以上。因此需要对“无明确意见”的样本进行数据净化,得到统计分析表4-10。
从表4-10可以明显看出,被调查者对《规则》中的化药、生物制品和中药方面考虑因素全面性的评价程度均值分别为7.91、7.57和7.37,其中除了对传统名中药类的评价均值为7.10外,其余的评价均值都在7.40以上。评价分值在“6”以上被调查者分别占到85%、85%和70%以上。因此,《规则》考虑因素的全面性得到较高的评价,尤其是在对化药和生物制品的考虑因素具有更高的全面性。
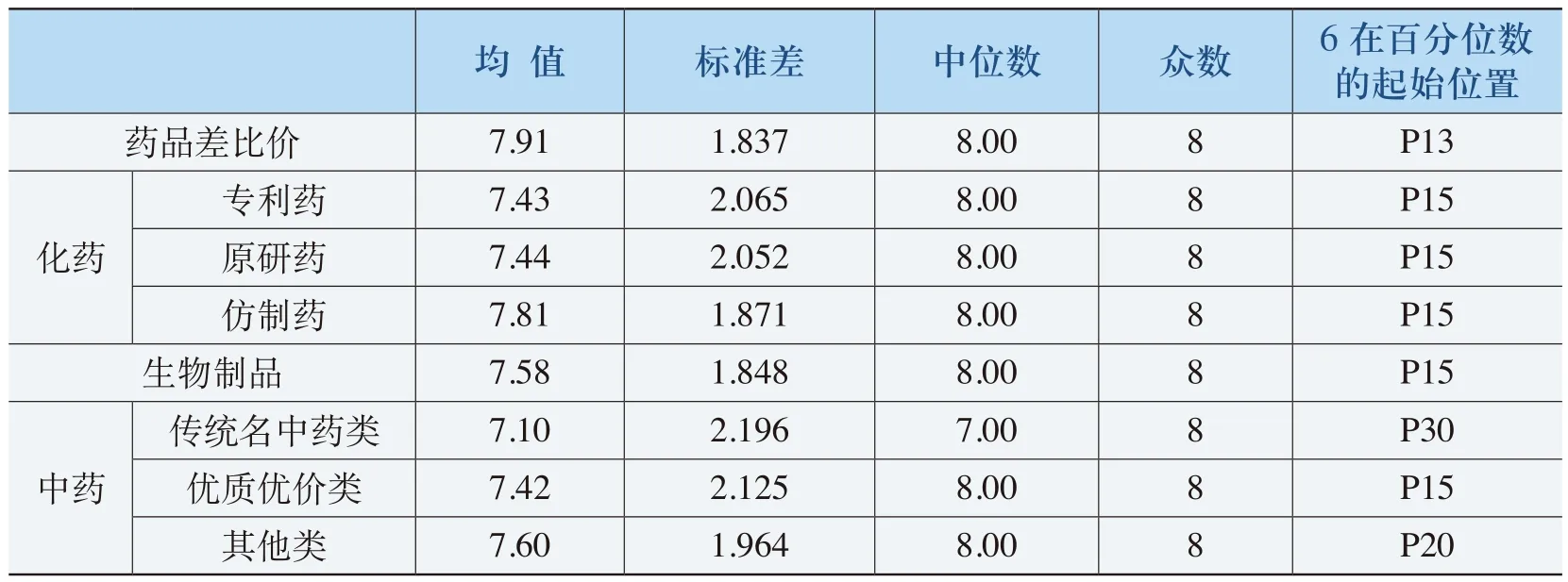
表4-10 《规则》中差比价考虑因素的全面性评价(净化)表

表4-11 《规则》中差比价考虑因素的合理性评价表
2.《规则》中差比价考虑因素的合理性评价
被调查者对《规则》中的化药、生物制品和中药考虑因素的合理性评价的统计分析结果见表4-11。
从表4-11中可以看出,被调查者对药品考虑因素总的合理性程度的均值为7.47。对化药考虑因素合理性程度高于生物制品和中药,其均值达到7.08,其中仿制药达到7.49。评价为“6”以上的达到68%以上。生物制品和中药(除传统名中药类以外)均值都在6.80以上,评价为“6”以上达到57%以上。化药、生物制品和中药的合理性评价与其全面性评价基本一致。
对“无明确意见”(即因不了解而无法评价《规则》对药品进行规制的合理性)的样本进行数据净化,得到表4-12的统计分析结果(见表4-12)。
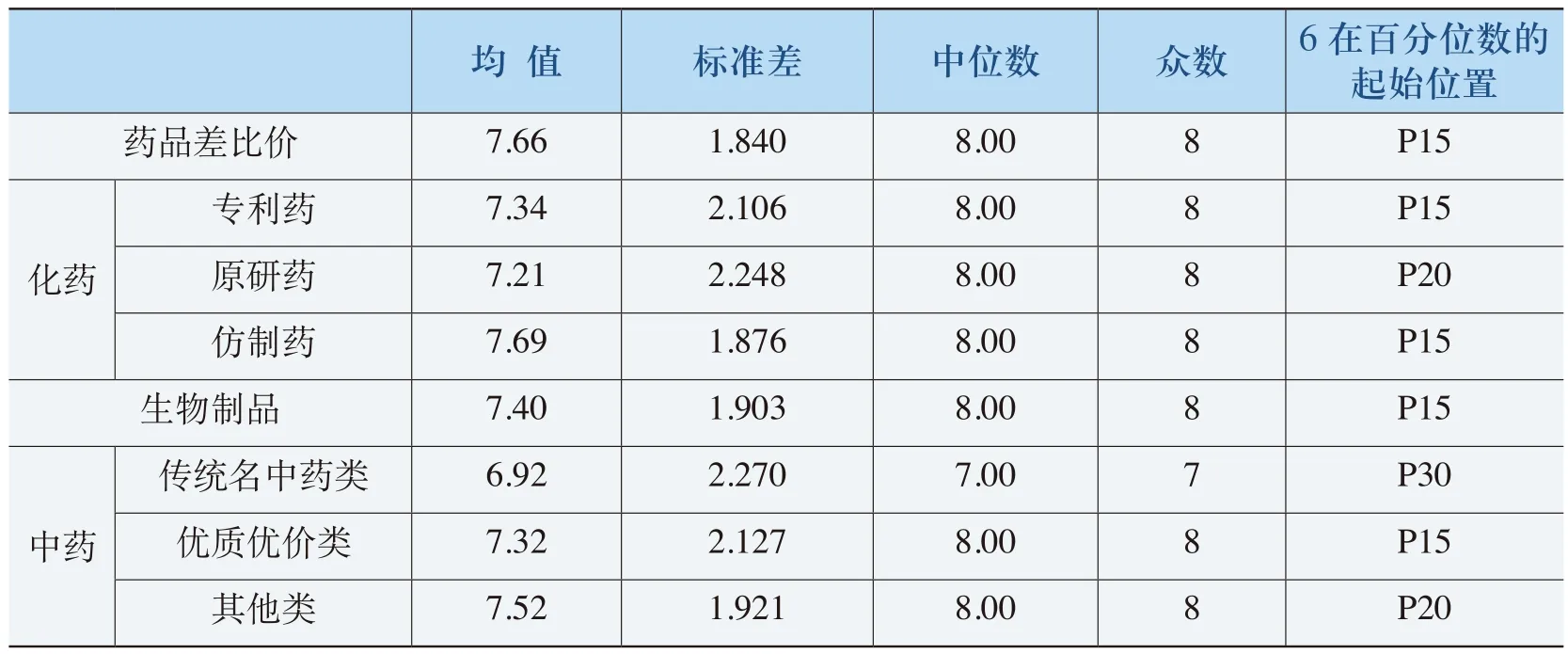
表4-12 《规则》中差比价考虑因素的合理性评价(净化)表
根据表4-12的分析结果,《规则》考虑因素的合理性评价总体得分的均值在7.66以上,其中,除了传统名中药类外,其他中药、化药和生物制品的得分均值都在7.21以上。中药评价在“6”以上均达到70%以上,化药和生物制品达到80%以上。《规则》考虑因素的合理性评价与其全面性程度评价比较一致。
(五)《规则》中差比价代表品的评价
对《规则》中差比价代表品的评价是指对由国家统一确定并公布代表品必要性的评价。
在表4-13中,被调查者对于《规则》中由国家统一公布代表品的必要性评价均值为8.97,标准差只有1.717,中位数为10.00,众数10,从百分位数P10开始均在7.00以上(即90%以上被调查者评价在7.00以上),同时,百分位数P40开始均在10.00(即超过60%的被调查者完全认同国家统一公布代表品)。这说明,被调查者对《规则》中由国家统一公布代表品的必要性评价具有较高集中趋势,离散程度较小。因此,以均值8.97的评价可以看出,《规则》中由国家统一公布代表品具有很高的必要性。

表4-13 《规则》中国家统一公布代表品的必要性评价表
(六)《规则》中差比价系数的评价
《规则》中规格差比价主要包括含量、重量、包装数量、药品性状。对于《规则》中的差比价系数评价主要从系数设定的合理性方面进行评价评价的统计分析结果见表4-7。

表4-14 《规则》中差比价系数的合理性评价表
从该表中可以看出,《规则》差比价系数总的合理性程度为7.76。其中:剂型差比价系数规制的合理性程度为7.16,规制规格差比价系数的合理性程度为7.38,规制包装材料差比价系数的合理性为7.15。结合这些指标的中位数和众数以及“6分”以上所在百分位数的位置来看,《规则》对剂型差比价系数、规格差比价系数和包装差比价系数规制的合理性得到了社会各界的认可,而且合理性程度均在80%以上(除了剂型差比价系数和药品性状差比价系数的合理性评价为75%以上)。因此,《规则》中对于剂型差比价系数、规格差比价系数和包装材料差比价系数的合理性得到了社会各界的普遍认同。
三、《规则》实施效果的评价
对于《规则》的实施效果,主要从规范药品价格、覆盖剂型及其相关系数、对政府职能部门医药产业乃至社会等方面的影响进行分析和评价
(一)《规则》实施效果的总体评价
对《规则》实施的总体效果评价主要是从被调查者对《规则》实施效果的理想程度的数据进行统计分析,结果如表4-15所示。
从表4-15中可以看出,被调查者对《规则》实施效果的总体评价均值为7.23,标准差为2.077,中位数为8.00,众数8,从百分位数P3开始均在6.00以上(即70%以上被调查者评价在6.00以上)。这说明被调查者对《规则》实施效果的理想性程度评价具有较高集中趋势,离散程度较小。因此,总的来说,《规则》的实施取得了比较理想的实施效果。

表4-15 《规则》实施效果的总体评价表
(二)《规则》实施对规范药品价格的评价
《规则》中对药品价格水平的规制按药品价格管理权限分为两种形式:一种是国家发改委对药品价格实施的差比价规制,简称为“国家规制”,一种是地方价格主管部门对药品价格实施的差比价规制,简称为“地方规制”。《规则》的实施对规范药品价格表现为三种情况:一是降低药品价格;二是药品价格水平持平;三是提高药品价格。课题组先对化药价格数据进行分析和评价①在分析和评价《规则》对药品价格的规范作用时,首先剔除了由于各种降价因素(除《规则》以外的药品价格管理行为)对药品价格的影响。具体计算方法如下:(1) 先以某一种药品在“《规则》实施后的价格水平”除以“《规则》实施前的价格水平”,得到该种药品的所有价格管理行为的总体价格规范水平,即该种药品的总体降价(或提价)幅度,其计算公式为(2) 计算该种药品代表品的规范水平,即该种药品代表品的降价(或提价)幅度,其计算公式为(3) 由于代表品是该种药品的差比价关系的参照系,不存在《规则》规制的价格规范效果,而仅存在《规则》以外的价格管理行为的规范效果。因此,以式(1)减去式(2)便得到《规则》规制药品的价格规范效果,即得到《规则》所引起药品价格的下降(或上升)幅度。(4) 以此类推,计算出所有品种的药品在《规则》作用下的价格规范效果。(5) 将所有品种药品的《规则》作用下的价格规范效果进行总体分析,从而得出《规则》实施对规范药品价格的效果。。
1.《规则》的实施降低了药品价格
《规则》通过对规格、剂型在差比价关系的规制,降低了部分规格、剂型的化学药品的价格水平②这里的“平均降价幅度”是指《规则》实施所实现的药品价格下降,不包括招投标等因素引起的药品价格下降。,见表4-16。
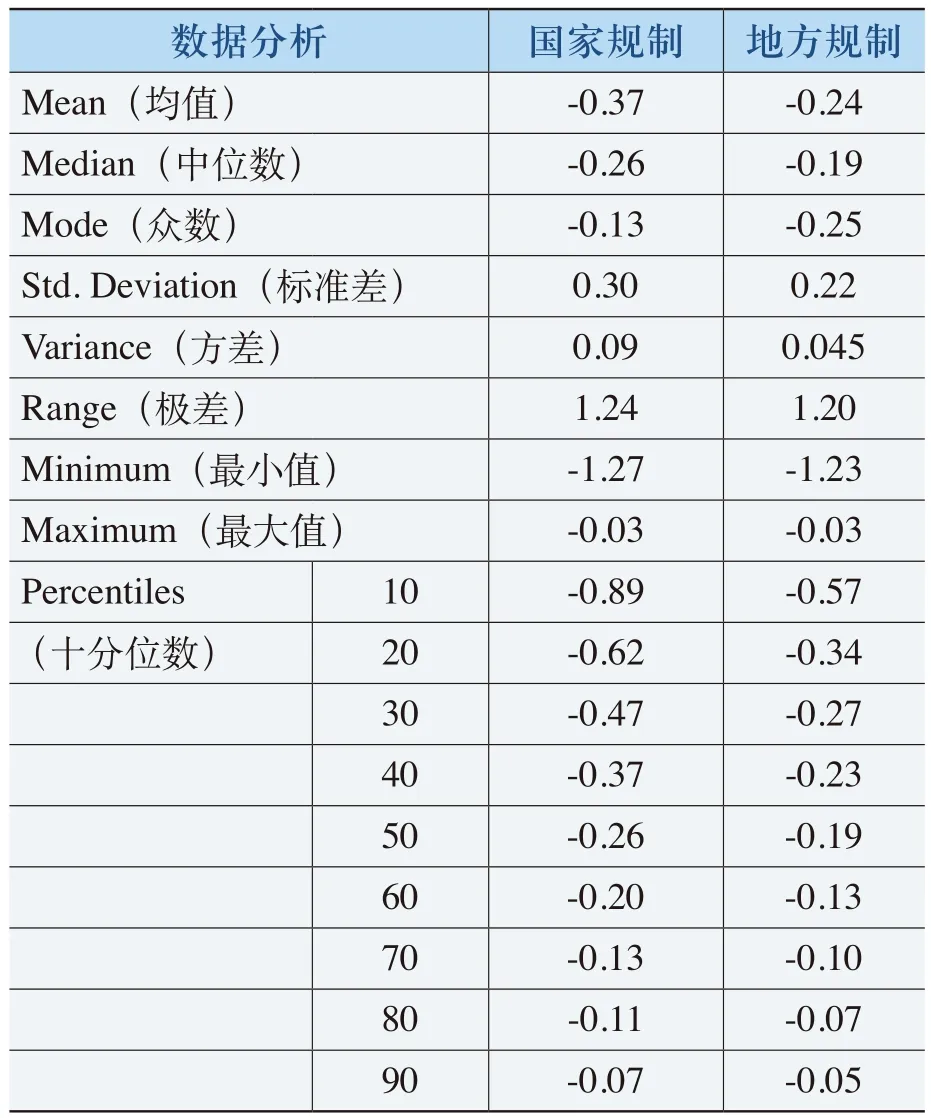
表4-16 《规则》降低化药价格表
在表4-16中,“国家规制”对部分化药的平均降价幅度达到37%;“地方规制”对部分化药的平均降价幅度达到24%。这些化药的降价幅度均在3%以上,最高降幅达到127%和123%。例如,利巴韦林的片剂(50mg×24片)从《规则》实施前的9.8元降到《规则》实施后的2.96元,其中《规则》所起到降价幅度达到69.8%。其中,利巴韦林注射剂的代表品(2ml∶250mg)则从《规则》实施前的0.76元升到1.20元,即上升了57.90%;利巴韦林注射剂(100mg)的总体降价幅度为65.31%。果糖二磷酸钠(5g)注射剂原价为78.元,《规则》实施后降价幅度达到111.08%,由于招投标政策影响,最终价格为3.1元。阿奇霉素(500mg冻干粉)注射剂从原价130元降低到46.20元,降价幅度达到64.46%。国家规制和地方规制的化药降价效果的百分位数分布特征见图4-2。

图4-2 《规则》对化药降价效果的百分位数分布图
通过对化药价格数据的分析,这部分出现价格下降的剂型和规格具有单价较高的特点(见表4-17)。《规则》实施之前,这部分药品的价格均在45元以上,《规则》实施之后,均价下降了50%左右。这充分说明了《规则》对于部分比价关系不合理的剂型和规格、特别是对其中一些高价格的剂型和规格,达到降低价格水平的目的。

表4-17 《规则》降低价格的化药特征表
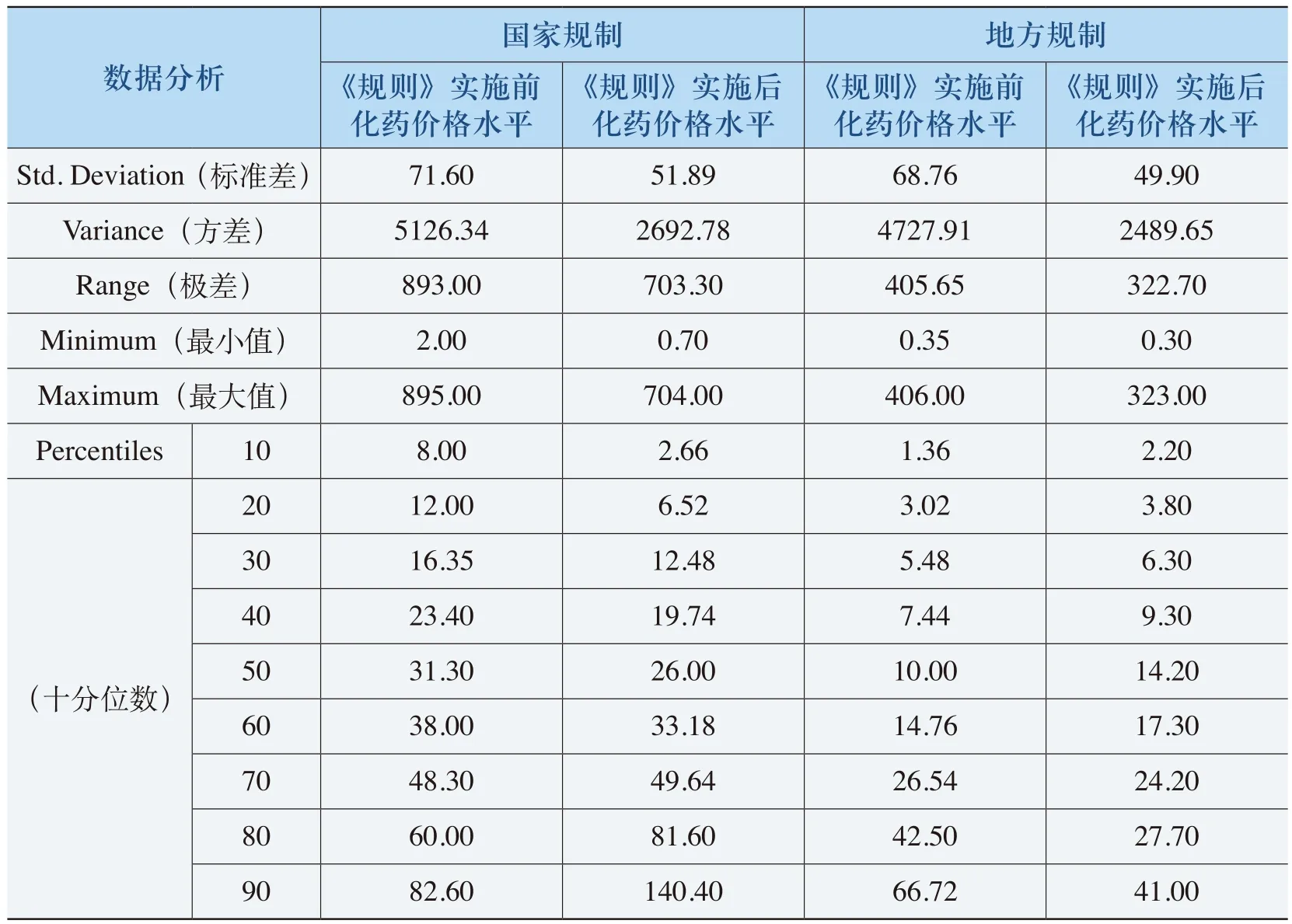
(表4-17续)
2.《规则》的实施使部分化药价格水平持平
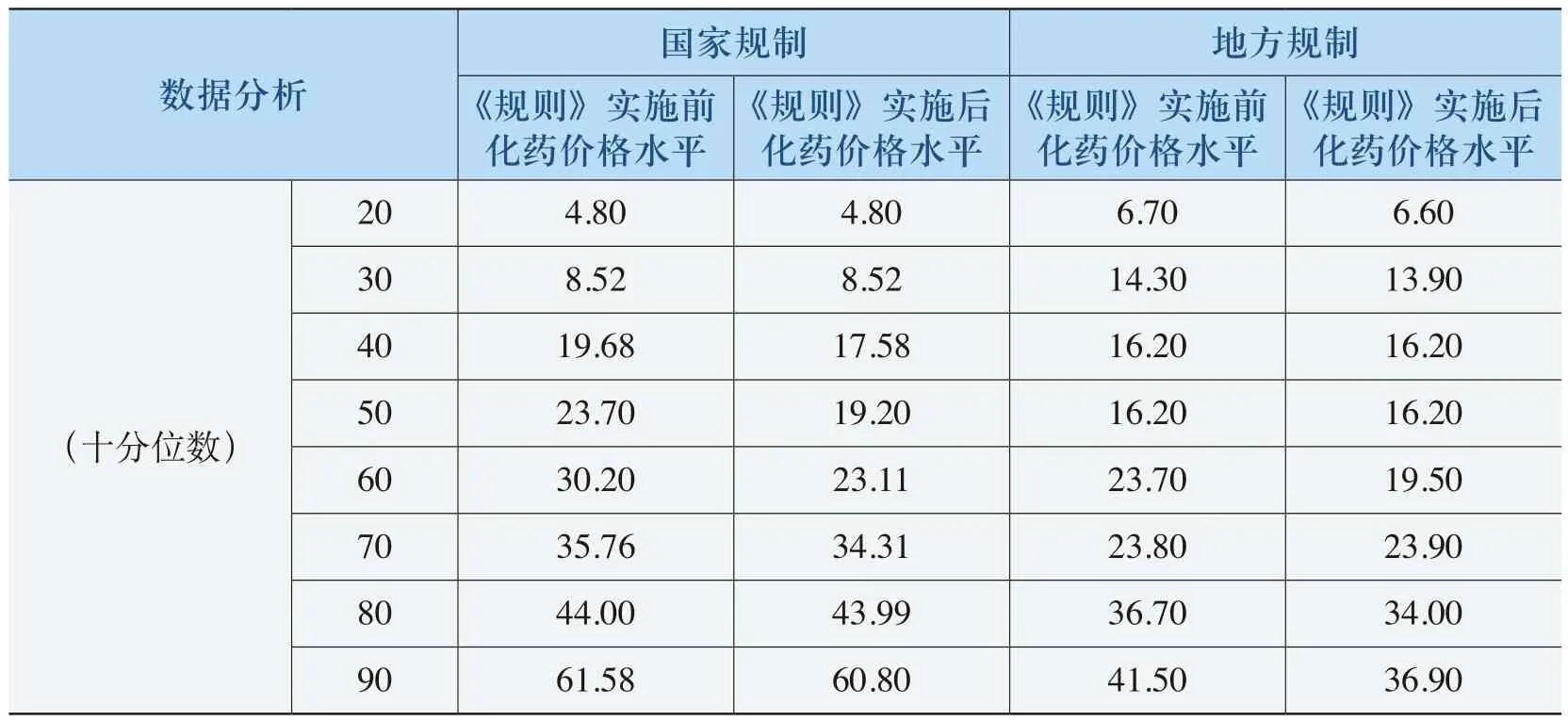
《规则》的实施使部分化药价格水平保持在±3%范围之内浮动。与出现降价的化药相比,这部分化药在《规则》实施之前的单价水平相对较低(见表4-18)。在表4-18中,这部分化药在《规则》实施之前的均价在37元(“国家规制”)和28元(“地方规制”),大部分化药价格位于12-50元之间。例如,亚叶酸钙(3mg)注射剂从原来的4元上涨到4.08元,涨幅为2.06%,在招投标政策影响下最终价格为3元。

表4-18 价格持平的化药特征表
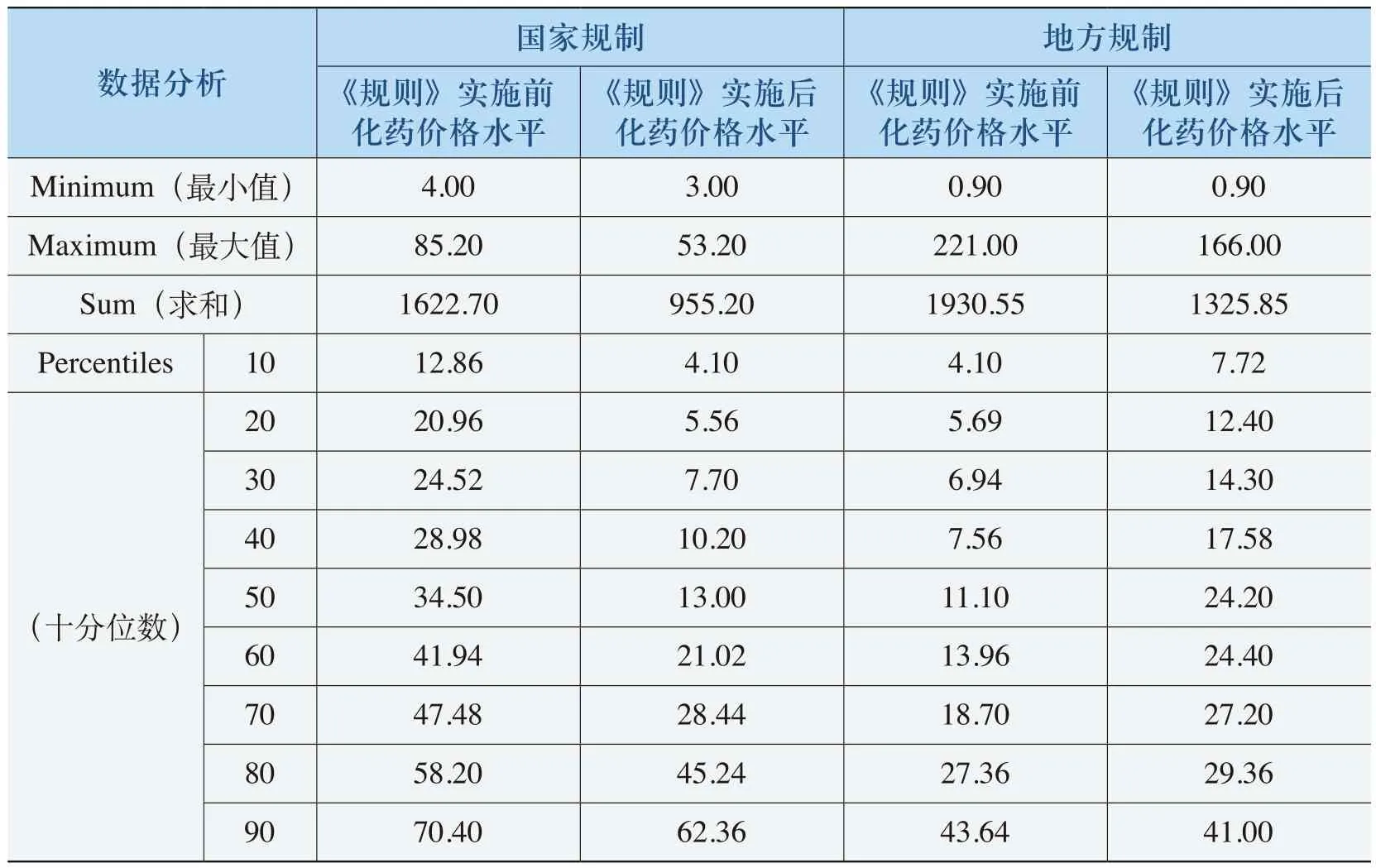
(表4-18续)
3.《规则》的实施提高化药价格
《规则》的实施提高了部分低价格、高疗效的化药价格(见表4-19)。表4-19中,这部分化药在《规则》实施之前的均价在27.55元(“国家规制”)和24.52元(“地方规制”),“国家规制”此类化药的差比价中,有70%以上的化药单价在25元以下,“地方规制”此类化药的差比价中,有80%以上的化药单价在25元以下。例如,氨溴索(15mg/2ml)注射剂从5.9元上涨到10.94元,上涨幅度达到85.37%,在其他价格政策的综合影响下最终价格为6.9元;肌苷(0.2g)注射剂从1.元上涨了129.85%,达到3.91元,在其他价格政策的综合影响下最终价格为2.5元。这反映了《规则》提高了部分价格较低的化药的价格,在一定程度上鼓励了低价药的生产和使用。
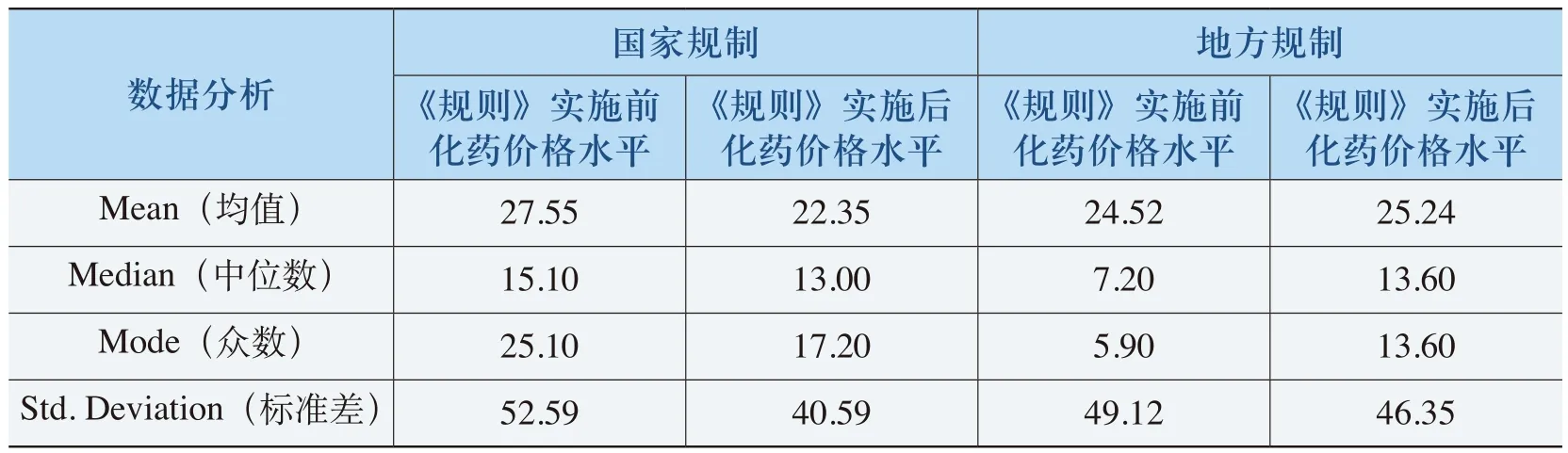
表4-19 《规则》提高价格水平的化药特征表
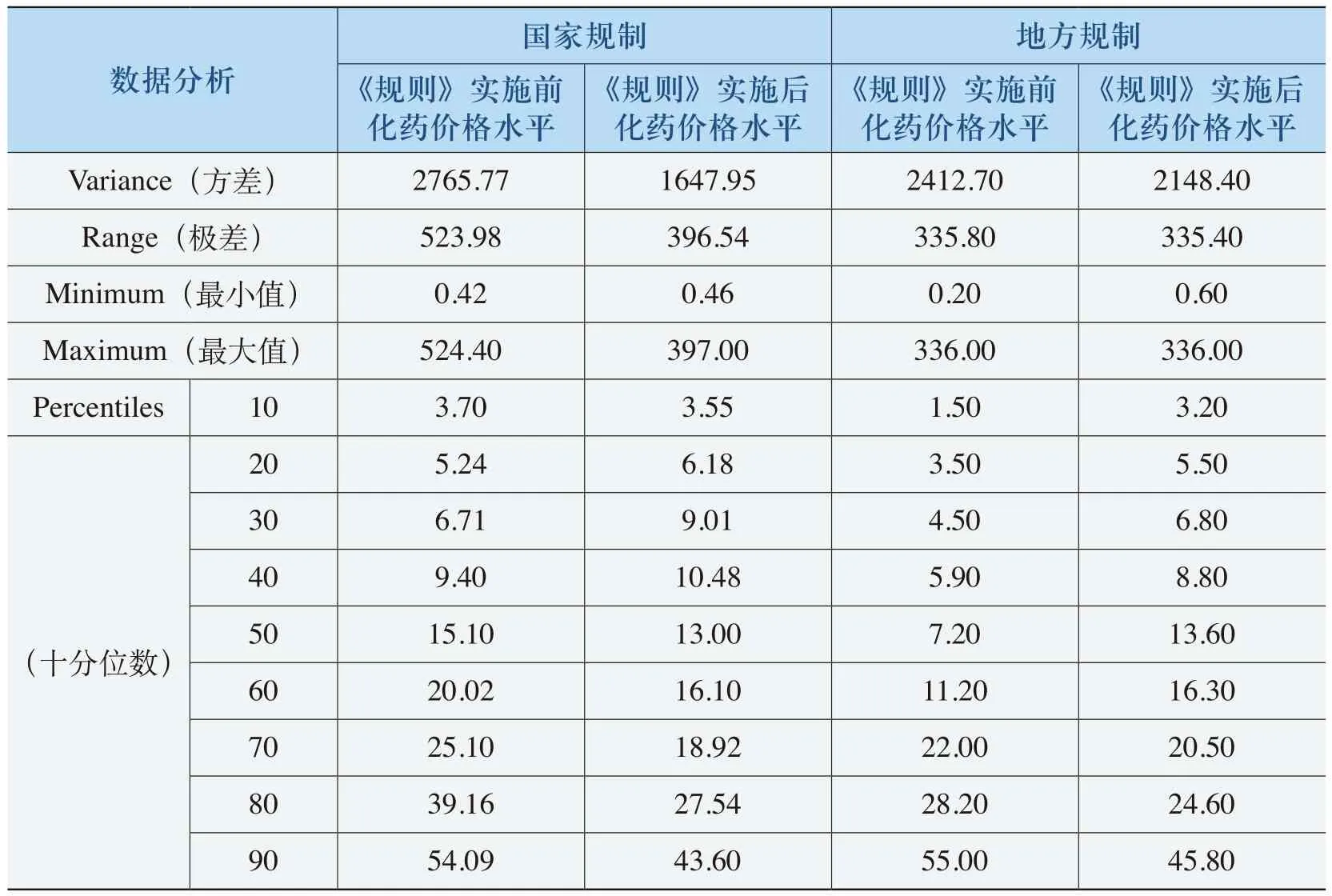
(表4-19续)
在保护部分低价格的化药中,“国家规制”的化药价格比《规则》实施之前平均提高了42%,地方规制”的化药价格平均提高了103%(其中,60%以上化药价格平均提高了39%,近20%的低价化药价格提高了100%以上,从而提高了整体价格水平(见表4-20)。

表4-20 《规则》提高化药价格表
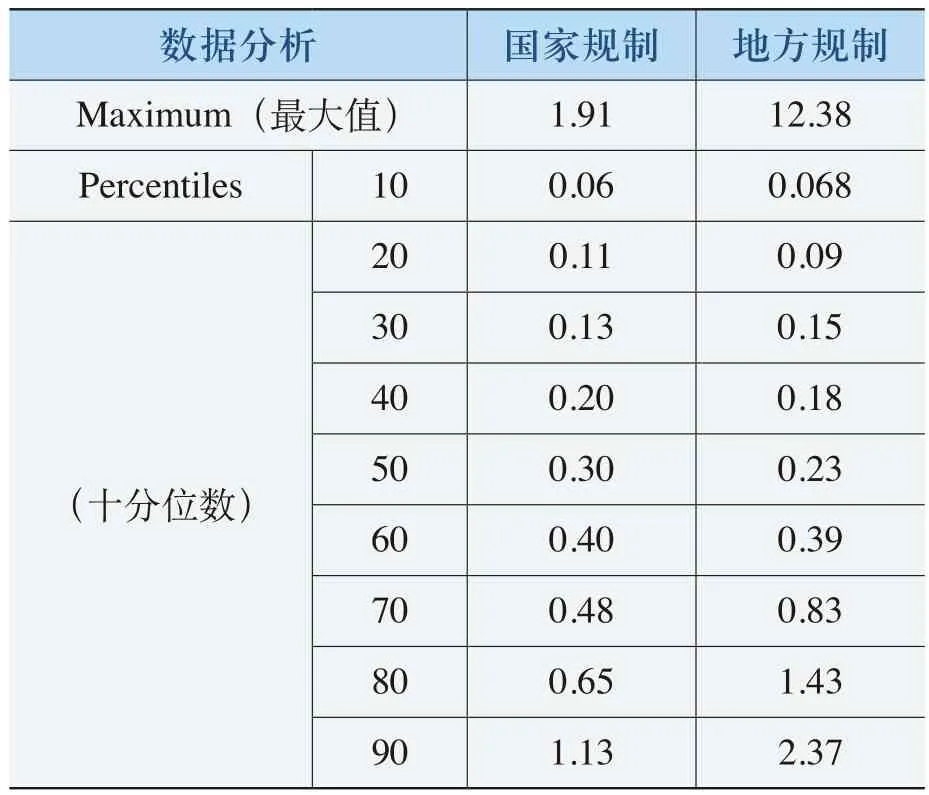
数据分析 国家规制 地方规制Maximum(最大值) 1.91 12.38 Percentiles 10 0.06 0.068(十分位数)20 0.11 0.09 30 0.13 0.15 40 0.20 0.18 50 0.30 0.23 60 0.40 0.39 70 0.48 0.83 80 0.65 1.43 90 1.13 2.37
4.《规则》实施对中药价格的影响
《规则》实施对中药的价格产生了与化药相似的影响,即价格降低、价格持平和价格上升,但反映出不同的特征(见表4-21、表4-22和表4-23)。
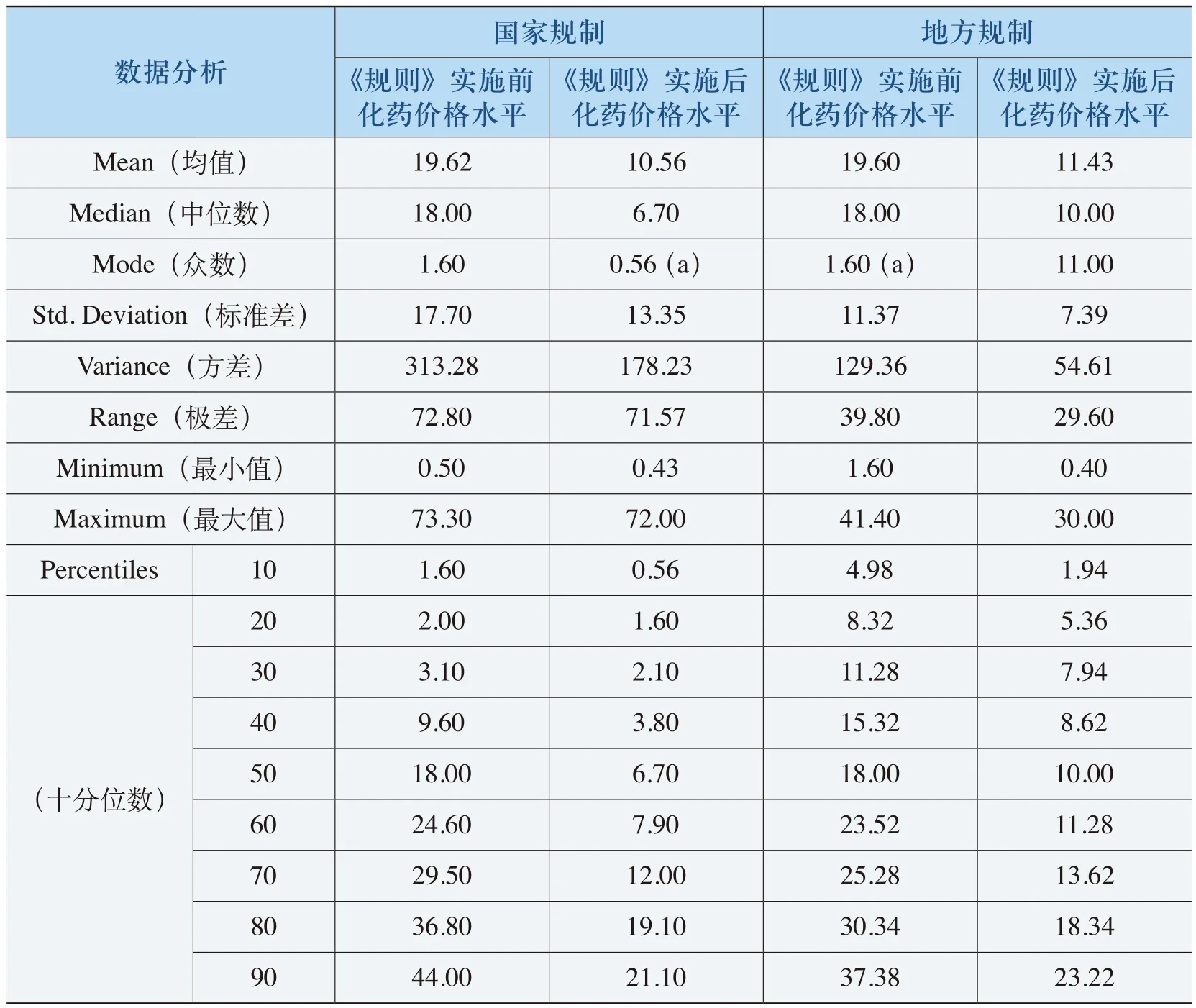
表4-21 《规则》降低价格的中药特征表
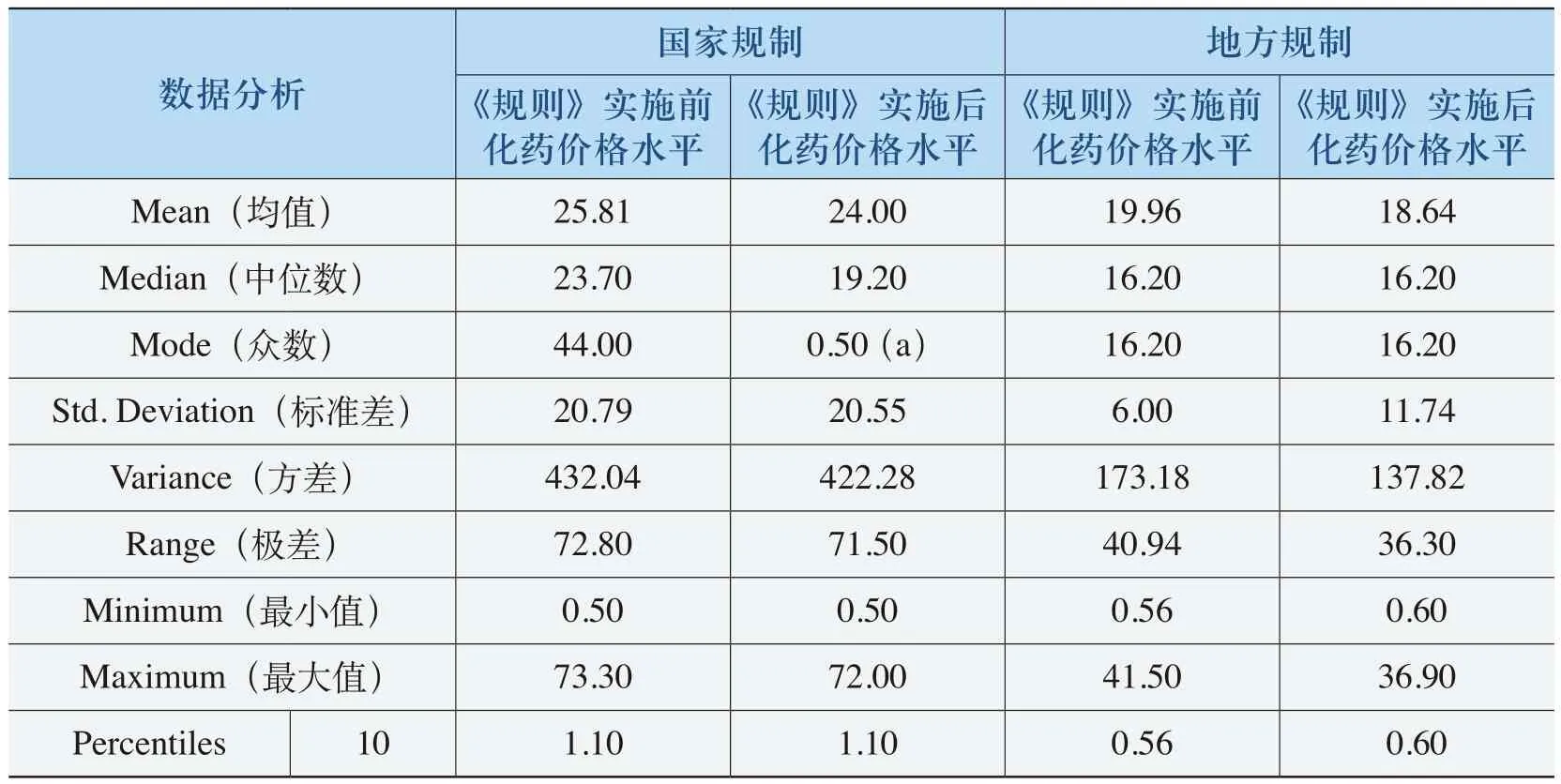
表4-22 价格持平的中药特征表
(表4-22续)
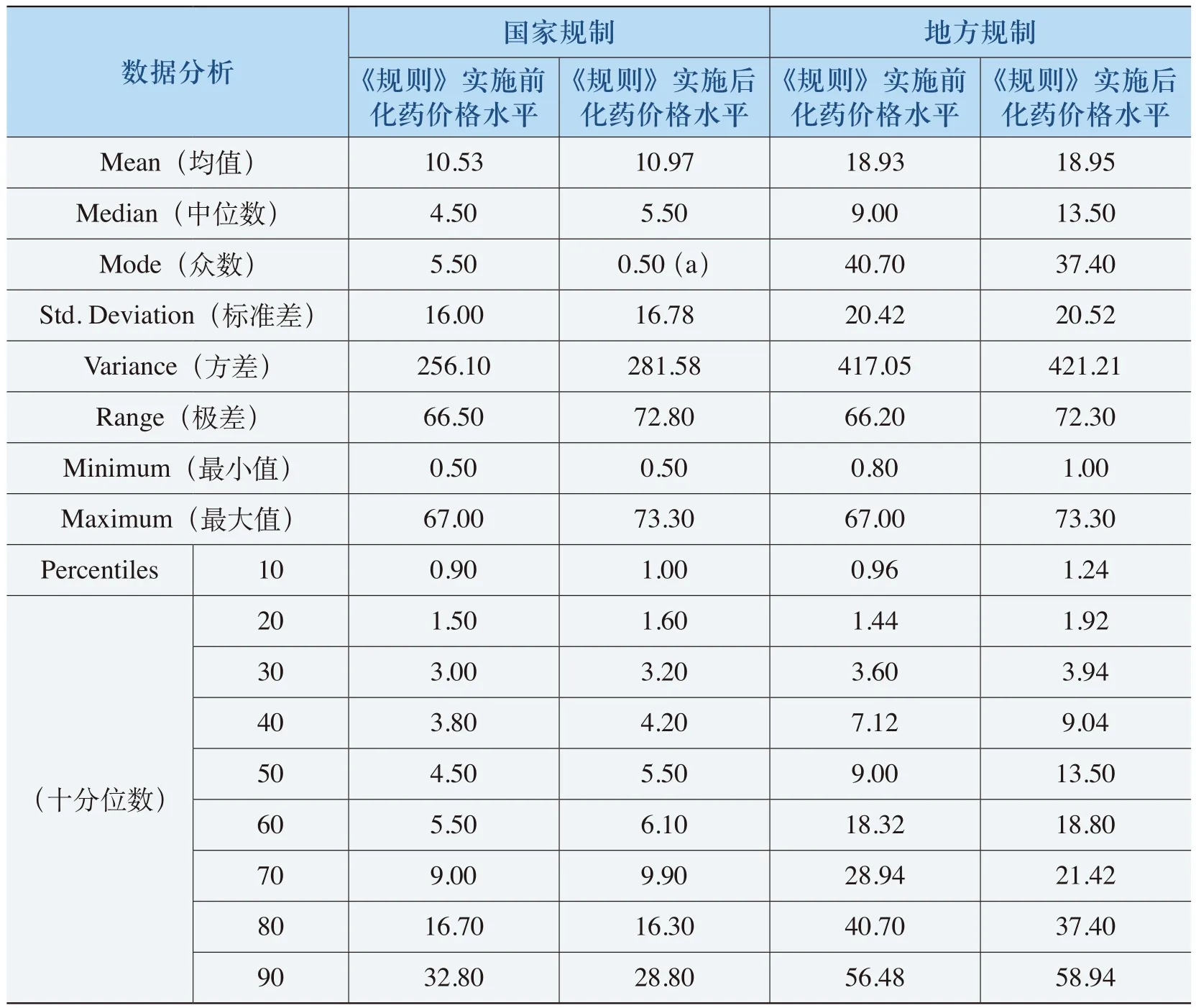
表4-23 《规则》提高价格水平的中药特征表
从表4-21、表4-22和表4-23可以看出,出现价格下降和价格持平的中药的均价在19元以上,50%以上中药单价平均在25元以上。而出现价格上升的中药单价平均在4.5元(“国家规制”)和18.93元(“地方规制”),国家规制的这类中药单位均价近70%的在10元以下,地方规制的这类中药单位均价50%以上的在10元以下。例如,牛黄解毒丸(片、胶囊、软胶囊等)原价格为1.20元(24片/盒),价格上升了66.67%;复方丹参颗粒(胶囊、片、滴丸等)原有价格为5.20元(50片(薄膜衣)/瓶),价格上升了17.31%。这反映了《规则》对低价格、高疗效的中药的价格保护。
《规则》实施对降低中药价格方面,“国家规制”的中药价格平均降幅达32%,“地方规制”的中药价格平均降幅达35%,最高降价率达83%以上(见表4-24),这说明了《规则》对高价格的中药具有明显的降价效果。

表4-24 《规则》降低中药价格表
《规则》实施对提高中药价格方面,“国家规制”的中药价格平均升幅达16%,“地方规制”的中药价格平均升幅达30%;最高降价率达50%(“国家规制”)和80%(“地方规制”)以上(见表4-25)。这说明了《规则》对低价格、高疗效的中药具有明显的价格保护效果。

表4-25 《规则》提高中药价格表
通过对化药和中药的价格数据分析可以看出《规则》对于高价格的药品起到降价效果,提高部分低价而差比价不合理的药品的价格,理顺了这部分药品的价格关系,进而鼓励了低价药品的生产和使用。
(三)《规则》对改剂型和增规格的制衡
2002年到2007年9月底,我国改剂型和增规格药品的申报数量在总体上呈现先升后降的态势(见图4-3)。
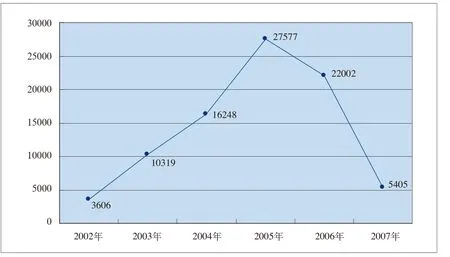
图4-3 2002-2007年(9月底)我国改剂型和增规格的申报数量
2003年—2005年,我国药品改剂型和增规格的申报数量呈逐年上升趋势,每年分别增长186.16%、57.45%和69.73%。而2005年实施规则》后,到2006年和2007年9月底申报数量呈明显下降趋势,分别为-20.22%和-75.43%。这充分地说明了《规则》对于遏制改剂型、增规格和改包装等申报药品数量发挥了积极作用,即规范了药品的价格关系,在一定程度上引导制药企业进行更高水平的新药研发,遏制了改剂型、改规格和改包装等新药审批行为。这一作用在图4-4和图4-5中得到充分体现。
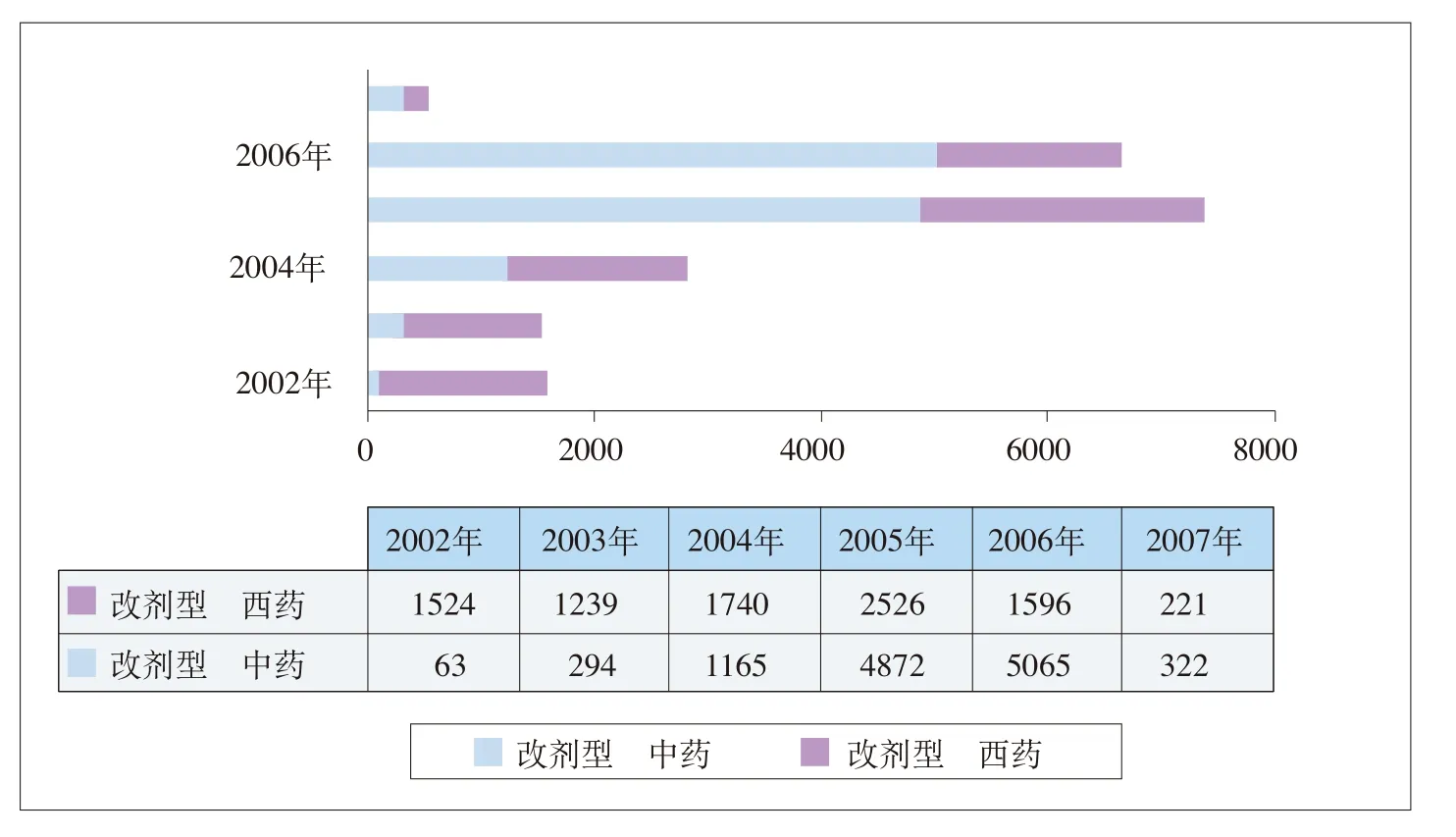
图4-4 2002-2007年中药和化药改剂型的申报数量
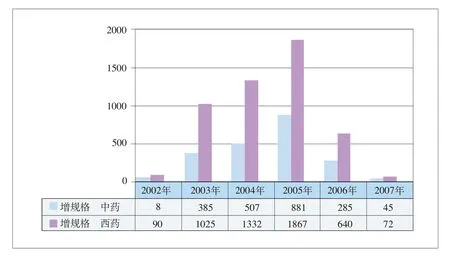
图4-5 2002—2007年中药和化药增规格的申报数量
(四)《规则》覆盖剂型和系数的评价
对《规则》覆盖剂型和系数的评价主要从《规则》所辖剂型范围是否需要扩大和差比价系数是否需要重新测算与调整这两个方面进行评价分析,具体数据的统计分析见表4-26。

表4-26 《规则》覆盖剂型和系数的评价表
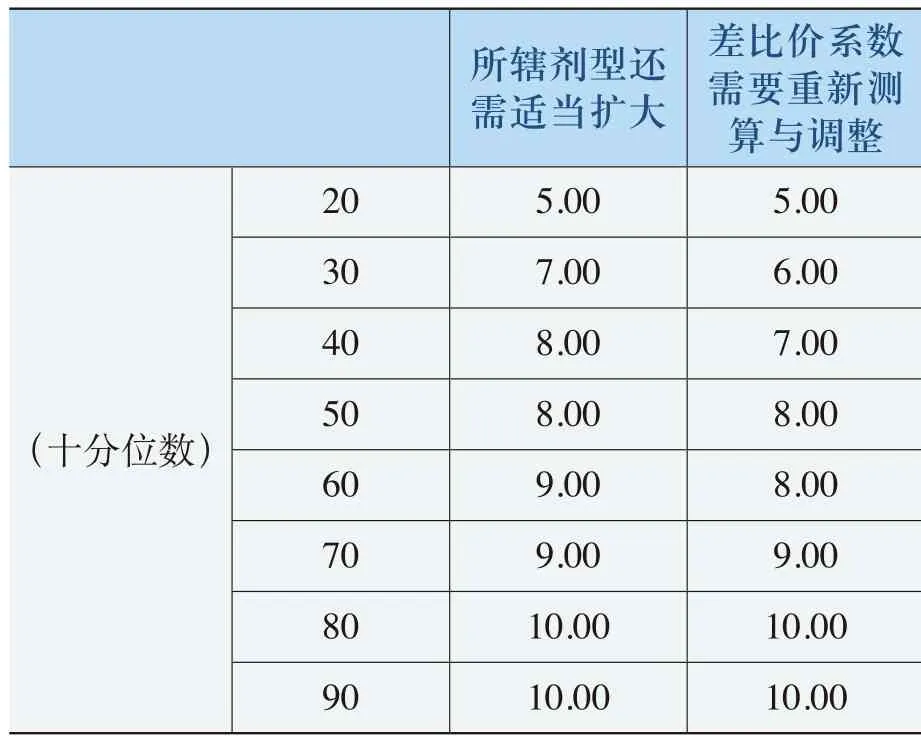
所辖剂型还需适当扩大差比价系数需要重新测算与调整(十分位数)20 5.00 5.00 30 7.00 6.00 40 8.00 7.00 50 8.00 8.00 60 9.00 8.00 70 9.00 9.00 80 10.00 10.00 90 10.00 10.00
从表4-26中的统计数据可以看出,对《规则》完整性评价中所辖剂型需要适当扩大和差比价系数需要重新测算和调整两方面的评价均值分别为7.88和7.47。标准差分别为2.125和2.253中位数和众数都为8.00。在对前者的评价中,从百分位数P30开始均在7.00以上(即70%以上被调查者评价在7.00以上);对后者的评价,从百分位数P30开始在6.00以上(即70%以上被调查者评价在6.00以上)。这表明,全社会对《规则》适当扩大所辖剂型的要求较高,同样,对差比价系数的重新测算与调整提出了较高的要求。表4-26中的统计数据进一步强调了全社会对《规则》完整性程度的关注,因此,《规则》所辖剂型的范围需要在某种程度内进一步扩大,同时,对差比价系数进行更加精细的测算和调整。
(五)《规则》对政府职能部门的影响
《规则》对政府职能部门的影响的评价主要从政府职能部门运用《规则》对药品定价、价格管理和医药行业管理等方面的影响进行分析和评价。对政府职能部门在《规则》实施后的工作效果的评价主要从改变政府定价部门信息弱势地位、提高政府部门行政效率、巩固政府降价效果、降低医疗保障支出这几个角度进行分析(详见表4-27)。
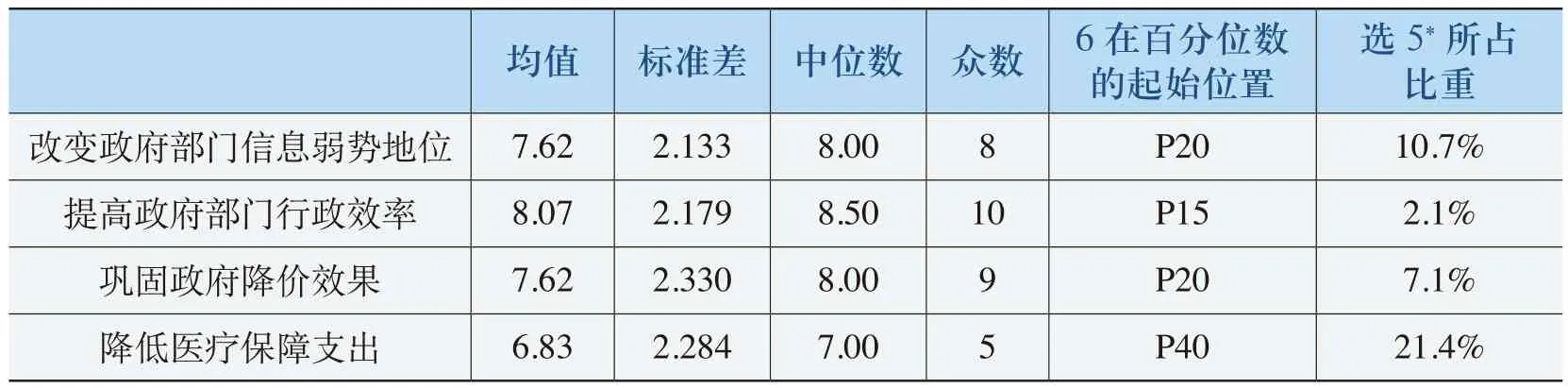
表4-27 《规则》实施对政府职能部门工作效果的影响表
从表4-27中数据可以看出,除了在降低医疗保障支出方面外,《规则》的实施在改变政府部门信息弱势地位、提高政府部门行政效率、巩固政府降价效果三方面的评价均值都在7.62以上,标准差分别为2.133、2.179、2.330,中位数和众数都在8以上,“6”在百分位数的起始位置都在P20以上(即超过80%的被调查者认为《规则》的实施提高了政府职能部门的工作效率)。在降低医疗保障支出方面,均值都在6.83,标准差分别为2.284,中位数和众数为7和5,“6”在百分位数的起始位置都在P40以上(即超过60%的被调查者认为《规则》的实施对降低医疗保障支出具有积极影响)。从表中的统计数据可以明确地看出,《规则》的实施对于改变政府定价部门信息弱势地位、提高政府部门行政效率、巩固政府降价效果和降低医疗保障支出具有明显的促进作用。
(六)《规则》的实施对医药产业的影响
关于《规则》的实施对医药产业的影响,主要从以下几个方面进行调查:(1)《规则》实施遏制药品生产的盲目投资和重复建设;(2)合理地引导新药研发;(3)促进制药企业经营管理水平的提高;(4)规范医药市场的竞争秩序;(5)推动我国医药产业的健康发展;(6)引导制药企业的药品品牌建设和品牌管理。《规则》实施的影响力程度分析具体见表4-28。
从表4-28中可以看出,《规则》的实施对医药行业的影响在上述几方面的影响程度评价的均值分别为6.98、6.78、6.82、7.13、7.04、6.58,都在6.58以上;标准差分别为2.463、2.338、2.284、2.183、2.220、2.422;“6”在百分位数的起始位置都在P40以上(即超过60%的被调查者认为《规则》的实施对医药产业的发展起到正强化的作用)。从表中的统计数据可以看出,《规则》的实施对规范和促进医药产业的健康发展在一定程度上起到了较为理想的效果。
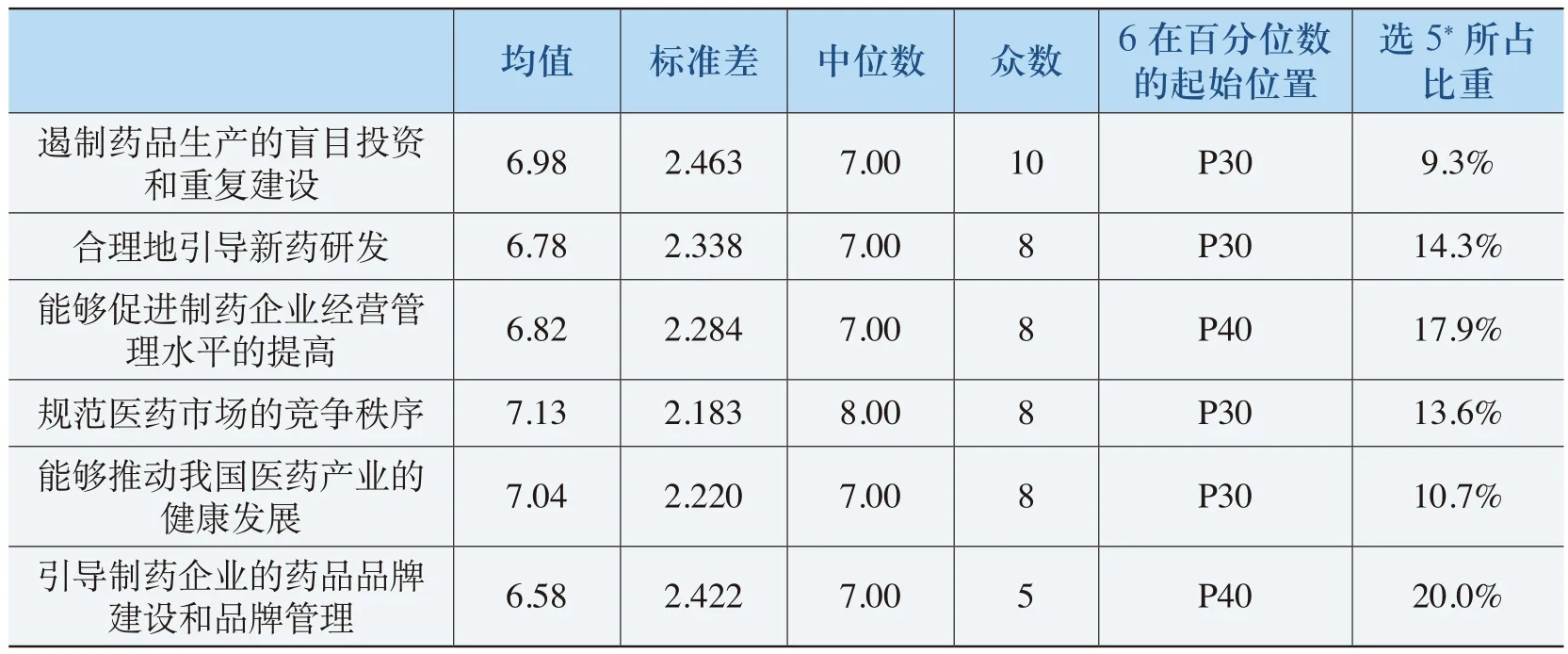
表4-28 《规则》的实施对医药产业发展的影响表
(七)《规则》实施的理论基础评价
《规则》实施的理论基础评价主要从《规则》的制定与实施是否与药物经济学、社会平均成本理论、政策、法律、理论基础等方面进行分析评价,详见表4-29。
从表4-29中可以看出,对《规则》的实施在与药物经济学有密切联系、与社会平均成本理论关系密切、有明确政策依据三方面的评价均值分别为7.14、7.18和7.27,明显高于“有明确的法律依据”、“有坚实的理论基础”的评价均值6.66 6.61。标准差分别为2.280、1.963、2.053、2.106 2.102。“6”在百分位数的起始位置都在P40以上,即超过60%的被调查者认为《规则》的实施存在理论基础。
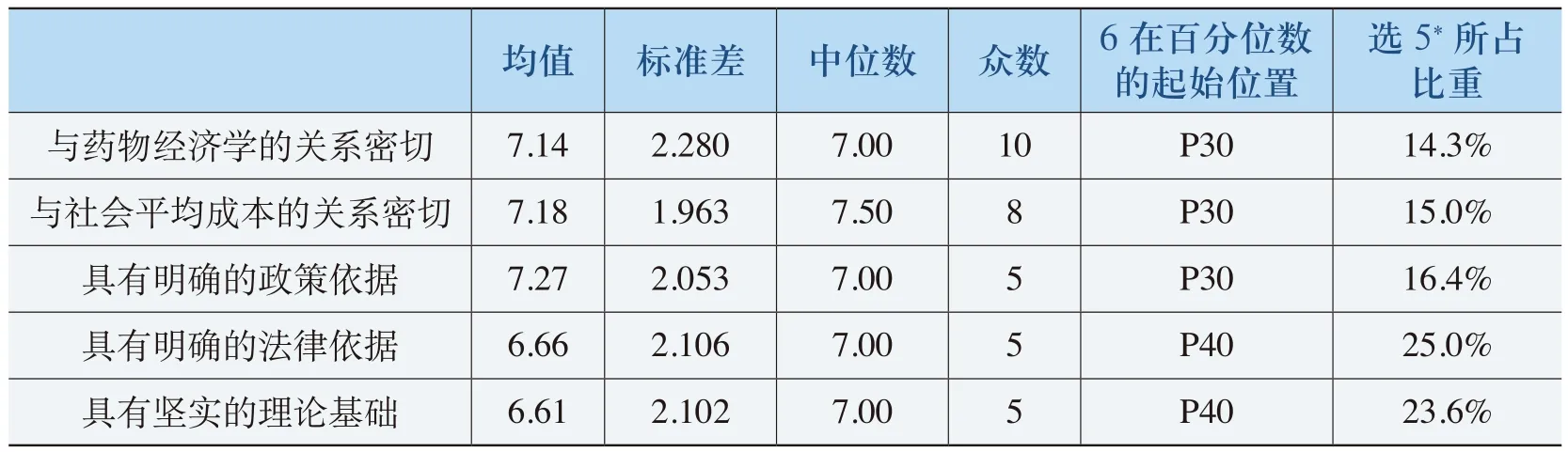
表4-29 《规则》实施的理论基础评价表
通过对“无明确意见”(即因不了解而无法评价《规则》对药品进行规制合理性)的样本进行数据净化,统计分析结果见表4-30。
从表4-30看出,对《规则》实施理论的基础评价在五个方面的评价均值都在7.10以上,且中位数都为8.00,众数都在8以上,“6”在百分位数的起始位置都在80%以上。从统计数据可以看出,《规则》的实施具有较为扎实的理论基础、法律依据和政策基础。
(八)《规则》实施的社会影响评价
《规格》实施的社会影响评价主要从三方面进行调查和分析:(1)《规则》的实施对医患关系的影响;(2)《规则》的实施对价格环境的影响;(3)《规则》的实施对保护广大患者权益的影响。具体分析数据见表4-31。

表4-30 《规则》实施的理论基础评价(净化)表
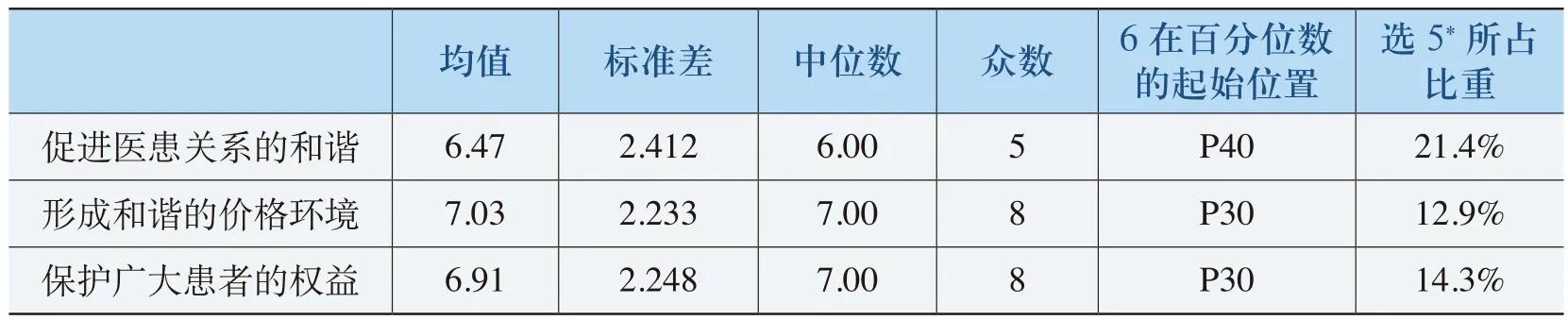
表4-31 《规则》实施对社会的影响表
从表4-31中可以看出,《规则》实施有助于促进医患关系的和谐、有助于形成和谐的价格环境和有效地保护广大患者的权益的评价均值分别为6.47、7.03、6.91。标准差分别为2.412、2.233、2.248。“6”在百分位数的起始位置都在P40以上。
通过对“无明确意见”(即因不了解而无法评价《规则》对药品进行规制合理性)的样本进行数据净化,而得到表4-31的统计分析结果(见表4-32)。

表4-32 《规则》实施对社会的影响效果评价(净化)表
从表4-32中可以看出,《规则》实施对社会影响效果三方面的评价均值分别为6.90、7.34、7.24,标准差分别为2.587、2.241、2.277,中位数都为8.00,众数都为8,“6”在百分位数的起始位置都在P30以上,即70%以上的被调查者认为《规则》的实施对社会成积极的影响。
(九)《规则》的独创性和长期适用的可能性评价
《规则》的独创性评价是从世界范围内来看待《规则》的原创、独创程度;《规则》的长期适用性评价是对《规则》在将来一段时期内是否可以继续执行问题的评价。具体分析数据见表4-33。

表4-33 《规则》的独创性和长期适用的可能性评价表
从表4-33中可以看出,对于《规则》独创性的评价均值为6.90,对《规则》可以长期使用的评价均值为7.28。标准差分别为2.459和2.363。中位数分别为7.00和8.00。“6”在百分位数的起始位置都在P40以上。
通过对“无明确意见”(即因不了解而无法评价《规则》对药品进行规制合理性)的样本进行数据净化,结果见表4-34。

表4-34 《规则》的独创性和长期适用的可能性评价(净化)表
表4-34的统计分析数据表明对《规则》独创性和可以长期适用的评价均值都在7.70以上,标准差分别为2.535和2.337,中位数分别为8.50和8.00,众数都为10,“6”在百分位数的起始位置都在P20以上,即超过80%的被调查者认为《规则》是一种独创的药品价格管理模式且《规则》可以长期适用。
