乳腺癌中 β-catenin、cyclinD1、c-myc表达及意义
2011-04-28何艳姣刘朝霞
何艳姣 乔 超 刘朝霞 俞 进 李 光
(首都医科大学附属北京天坛医院病理科,北京 100050)
乳腺癌是女性最常见的恶性肿瘤之一,发病率在我国逐年增高并逐渐趋于年轻化,严重威胁妇女生命健康。从信号转导途径治疗肿瘤是目前生物治疗的新兴领域。Wnt信号通路是目前已知的胚胎发育所必需的信号通路,经典Wnt信号转导通路致癌的关键是该途径任何一个信号分子异常导致β-catenin在细胞质/核内累积,研究[1-2]表明,在多种人类肿瘤均发现 βcatenin异常表达和β-catenin基因突变,并与肿瘤发生相关,cyclinD1、c-myc是Wnt信号转导通路非常重要的靶基因,本研究拟通过检测正常乳腺组织、乳腺增生症和乳腺癌中β-catenin、cyclinD1、c-myc的表达情况,评价它们的异常表达与临床病理指标的关系,同时做β-catenin异常表达与cyclinD1、c-myc过表达相关性研究,旨在初步探讨Wnt信号转导通路中重要因子β-catenin及其靶基因cyclinD1、c-myc与乳腺癌发生发展的作用。
1 材料和方法
1.1 材料
取自首都医科大学附属北京天坛医院病理科40例正常乳腺组织、72例乳腺增生症及119例乳腺癌标本及临床资料,所有病例均经病理证实。常规10%中性甲醛固定、石蜡包埋。切片厚度4 μm,常规HE染色。
1.2 免疫组化染色
石蜡切片常规脱蜡至水,染色方法按S-P试剂盒说明书步骤进行,0.01 mol/L枸橼酸缓冲液(pH 6.0)微波修复18 min行抗原修复,第一抗体(鼠抗人β-catenin、cyclinD1、c-myc单克隆即用型抗体均购自北京中杉金桥公司)4℃过夜。经DAB显色后,苏木素复染,中性树胶封片。阴性对照采用0.01 mol/L PBS(pH=7.4)液体代替一抗,其他步骤不变。S-P及DAB试剂盒均购自北京中杉金桥公司。
1.3 结果判定标准
在正常情况下β-catenin阳性染色定位于细胞膜,即连续的细胞膜染色。染色结果判断标准按Maruyama K等[3]的方法,分别从细胞膜、细胞质、细胞核3方面判断β-catenin在细胞内的分布:细胞膜>70%细胞阳性为正常表达,反之为表达缺失;细胞质或细胞核>10%细胞阳性为胞质或胞核阳性表达,胞质或胞核表达为异位表达。异位表达和表达缺失统归为异常表达。
cyclinD1表达于细胞核,c-myc在细胞核和细胞质均可出现阳性,随机选取10个高倍视野,每个视野计数100个瘤细胞,计数阳性细胞百分比,>10%为过度表达。
1.4 统计学方法
采用SPSS 11.0统计分析软件进行分析,采用卡方检验和确切概率法,以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌、乳腺增生症及正常乳腺组织中β-catenin、cyclinD1、c-myc的表达情况
119例乳腺癌中26例 β-catenin正常表达(图1A),正常表达率为21.85%。93例β-catenin异常表达(图1B),异常表达率为78.15%;69例cyclinD1阳性表达(图1C),阳性表达率为57.98%;67例 c-myc阳性表达(图1D),阳性表达率为56.30%。
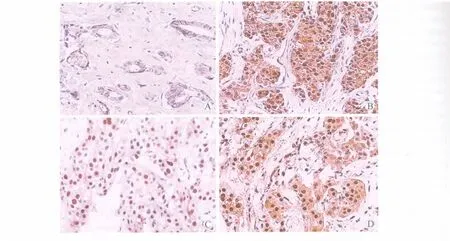
图1 乳腺浸润性导管癌组织SP法免疫组化染色结果Fig.1 Breast infiltrating ductal cancer by immunohistochemistry SP method(200×)
72例乳腺增生症中β-catenin的异常表达率为44.44%(32/72),cyclinD1 的阳性表达率为 33.33%(24/72),c-myc的阳性表达率为 27.78%(20/72)。
40例正常乳腺组织中β-catenin在细胞膜中强表达,cyclinD1及c-myc阴性表达。乳腺癌β-catenin异常表达率明显高于乳腺增生症,组间比较差异有统计学意义(P<0.01),乳腺癌cyclinD1阳性表达率高于乳腺增生症,组间比较差异有统计学意义(P=0.001),乳腺癌c-myc阳性表达率高于乳腺增生症,组间比较差异有统计学意义(P<0.01)。
2.2 β-catenin、cyclinD1、c-myc的表达与乳腺癌临床病理资料相关性
β-catenin、cyclinD1的表达与淋巴结转移相关(P=0.031,P=0.003),与年龄、部位、肿瘤大小、组织学类型无关,c-myc的表达与肿瘤大小和淋巴结转移相关(P均=0.041),与年龄、部位、组织学类型无关,见表1。
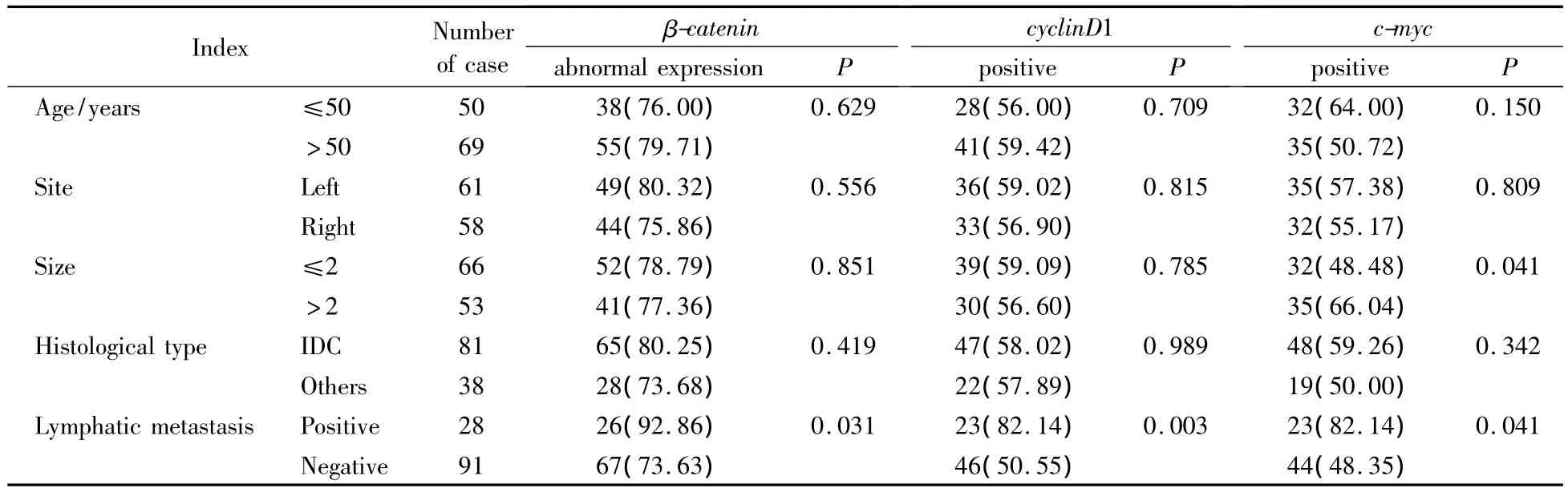
表1 β-catenin、cyclinD1、c-myc的表达与乳腺癌临床病理资料相关性Tab.1 The relationship between β-catenin,cyclinD1,c-myc and clinicopathological index in breast carcinoma n(%)
2.3 乳腺癌中 β-catenin的异常表达与cyclinD1、cmyc的表达相关性
β-catenin的异常表达与 cyclinD1的表达相关(P=0.006),与 c-myc的表达无关,见表2。

表2 乳腺癌中β-catenin的异常表达与cyclinD1、c-myc的表达相关性Tab.2 The relationship between expression of β-catenin and cyclinD1,c-myc in breast carcinoma
3 讨论
经典Wnt信号转导通路致癌的关键是该途径任何一个信号分子异常致β-catenin在细胞质/核内累积。β-catenin是一种多功能细胞质内的可溶性蛋白,由于它在细胞黏附和增生过程中的双重作用,已成为肿瘤发生发展机制研究中的热点。近来研究[4]表明,β-catenin在细胞质和核内的累积是恶性肿瘤中的常见事件之一,在结直肠腺瘤和癌等多种肿瘤中均发现β-catenin异常表达并与肿瘤发生相关,但在乳腺癌中的报道结果不一致。Bankfalvi A等[5]发现从乳腺正常组织到浸润癌的发展过程中β-catenin膜表达下调,认为β-catenin的改变是乳腺癌发生过程中的早期事件。Lin S Y等[6]、Lim S C 等[7]、López-Knowles E 等[8]报道了乳腺癌中β-catenin的异常表达与预后不良有关,可以作为乳腺癌的独立预后因子。而Chung G G等[9]研究表明β-catenin异常表达与预后无关,只有同时存在β-catenin异常表达和p53高表达时才与预后不良有关,因此,βcatenin不能作为乳腺癌的独立预后因子。王珂等[10]研究表明β-catenin异常表达与Her2阳性表达有关,二者异常表达协同促进乳腺癌细胞的淋巴结转移。本研究发现乳腺癌β-catenin异常表达率明显高于乳腺增生症,组间比较差异有统计学意义,表明β-catenin异常表达在乳腺癌发生发展过程中起重要作用。同时发现βcatenin的异常表达与淋巴结转移相关,表明其可以用于评价乳腺癌的预后。
CyclinD1和c-myc作为原癌基因,参与细胞的增生、分化与凋亡,并且与多种肿瘤发生发展有关。近来研究[1-2]显示,cyclinD1、c-myc是Wnt信号转导通路非常重要的靶基因,免疫组化研究证实在多种肿瘤中cyclinD1、c-myc过表达与β-catenin异常表达和Wnt突变有关。在乳腺癌中,仅有少数研究报道了β-catenin异常表达与cyclinD1、c-myc过表达的相关性,且意见不一致,如 Ozaki S等[11]研究显示β-catenin异常表达与 cyclinD1、c-myc过表达有关,Roh M S 等[12]研究显示β-catenin异常表达可上调c-myc表达,Lin S Y等[6]证实β-catenin异常表达与cyclinD1高表达相关,Lim S C等[7]研究显示 β-catenin异常表达与 cyclinD1过表达无关。本研究显示cyclinD1、c-myc的过表达与淋巴结转移相关,表明它们也可以作为评价乳腺癌转移、预后的重要因子。同时β-catenin异常表达与cyclinD1过表达相关,而与c-myc过表达无关,表明β-catenin在乳腺癌发生过程中的作用可能是通过上调cyclinD1的表达,导致细胞外基质降解和细胞增生分化失控而实现的。
[1]Miller J R.The Wnts[J].Genome Biology,2002,3(1):reviews 3001.Epub 2001 Dec.28.Review.
[2]Polakis P.Wnt signaling and cancer[J].Genes Dev,2000,14(15):1837-1851.
[3]Maruyama K,Ochiai A,Akimoto S,et al.Cytoplasmic beta-catenin accumulation as a predictor of hematogenous metastasis in human colorectal cancer[J].Oncoloby,2000,59(4):302-309.
[4]Bienz M,Clevers H.Linking colorectal cancer to Wnt signaling[J].Cell,2000,103(2):311-320.
[5]Bankfalvi A,Terpe H J,Breukelmann D,et al.Immunophenotypic and prognostic analysis of E-cadherin and betacatenin expression during breast carcinogenesis and tumourprogression:a comparative study with CD44[J].Histopathology,1999,34(1):25-34.
[6]Lin S Y,Xia W,Wang J C,et al.Beta-catenin,a novel prognostic marker for breast cancer:its roles in cyclin D1 expression and cancer progression[J].Proc Natl Acad Sci USA,2000,97(8):4262-4266.
[7]Lim S C,Lee M S.Significance of E-cadherin/beta-catenin complex and cyclin D1 in breast cancer[J].Oncol Rep,2002,9(5):915-928.
[8]López-Knowles E,Zardawi S J,McNeil C M,et al.Cytoplasmic localization of beta-catenin is a marker of poor outcome in breast cancer patients[J].Cancer Epidemiol Biomarkers Prev,2010,19(1):301-309.
[9]Chung G G,Zerkowski M P,Ocal I T,et al.beta-catenin and p53 analyses of a breast carcinoma tissue microarray[J].Cancer,2004,100(10):2084-2092.
[10]王珂,任予,何建军,等.人乳腺癌组织中 Wnt/β-catenin信号传导通路的异常表达与Her2阳性表达间的关系[J].西安交通大学学报(医学版),2009,30(5):587-591.
[11]Ozaki S,Ikeda S,Ishizaki Y,et al.Alterations and correlations of the components in the Wnt signaling pathway and its target genes in breast cancer[J].Oncol Rep,2005,14(6):1437-1443.
[12]Roh M S,Hong S H,Jeong J S,et al.Gene expression profiling of breast cancer with emphasis of beta-catenin regulation[J].J Korean Med Sci,2004,19(2):275-282.
