尼可地尔预处理保存大鼠离体心脏的实验研究
2011-04-28张国彬刘亚楠
张国彬 刘亚楠 张 宇
(1.河北联合大学研究生学院,唐山 063000;2.河北联合大学免疫学教研室,唐山 063000;3.华北煤炭医学院附属医院胸心外科,唐山 063000)
离体心脏的保存效果很大程度上决定心脏移植的成功与否[1],目前主要通过改良心脏保存液的成分来延长心脏保存时间[2-4]。有研究[5-7]表明缺血预处理(ischemic preconditioning,IP)能显著增强心脏对缺血的耐受性,但它是一种损伤性的预适应。药物预处理[8-11](pharmacological preconditioning)安全有效,通过药物激发或模拟机体内源性的保护机制起作用。研究[12]表明七氟烷预处理对心肌细胞的保护作用可能与HSP70表达有关。本研究旨在探讨非选择性KATP通道开放剂尼可地尔预处理诱导心肌细胞HSP70表达的改变,从而揭示离体供心的可能保护机制。
1 材料和方法
1.1 实验动物
选取24只成年SD雄性大鼠,体质量250~350 g,购自北京维通利华试验动物技术有限公司〔动物许可证号:SYXK(冀)2005-0038〕,温度22℃,湿度50%饲养。12 h光照/黑暗,自由摄食进水。
1.2 实验样品和试剂
尼可地尔购自美国Sigma公司,丙二醛(malonaldehyde,MDA)测定试剂盒购自南京建成生物工程研究所,兔多克隆HSP70一抗、生物素化山羊抗兔IgG二抗、SP-9000免疫组化试剂盒购自福州迈新生物技术开发有限公司。
1.3 St-Thomas心肌保存液配方

Component Concentration/(mmol·L -1)__NaCl 100.0 NaHCO3 10.0 KCl 16.0 MgCl2·6H2 O 16.0 CaCl2·2H2 O 1.2______pH___________________________________________________7.8±0.02
1.4 动物分组及标本取材
大鼠采用抽签法随机分为2组,每组12只。对照组与实验组均注射相同剂量的0.9%氯化钠注射液或尼可地尔(0.1 mg/kg),每天1次,第9次注射结束后10%水合氯醛麻醉并肝素化。剪开胸骨暴露心脏,阻断升主动脉,在主动脉根部注射4℃ St-Thomas液4~6 mL,待心脏完全停搏,心外膜变白后,摘除心脏,迅速修剪后放入4℃心肌保存液中。
1.5 心肌组织MDA含量测定
分别在2、4、6、8、10、12、16、20、24 h 取左心室前壁心肌组织制成匀浆液,离心取上清。硫代巴比妥酸法测定MDA含量,具体操作过程按照试剂盒。
1.6 心肌组织电镜超微结构测定
各时间点取0.1 cm ×0.1 cm ×0.1 cm 体积的大鼠离体心肌,并置于电镜固定液,超薄切片电镜观察。
1.7 免疫组化法检测
各时间点标本取材置于10%中性甲醛4℃固定24 h常规脱水、透明、浸蜡、石蜡包埋。全层心肌连续切片,厚度约5 μm,用经粘片剂处理过的载玻片捞片,置于60℃烤箱烘烤3 h后行S-P法免疫组化染色。滴加HSP70一抗4℃过夜(1∶150),滴加二抗37℃孵育1 h,DAB显色。多媒体彩色病理分析系统计数,取均值。
1.8 蛋白质印迹法检测
标本取材加3倍体积细胞裂解液,冰浴中匀浆,4℃离心5 min,12 000 r/min离心取上清。考马斯亮蓝法测定各时间点样本的蛋白含量后,取蛋白样品40 μg与等体积上样缓冲液混合,95℃煮沸10 min,10%SDS-PAGE胶分离蛋白,转膜,封闭液室温下震荡1 h,加入HSP70一抗(1∶1 000),4℃孵育过夜。TBST洗膜,二抗37℃孵育1 h,TBST洗涤并曝光,洗膜敷βactin并作定量分析。
1.9 统计学方法
采用计算机图像分析系统对免疫组化阳性细胞数进行定量分析。所有数据采用SPSS 13.0软件进行统计分析,数据以均数±标准差()表示,同一时间点不同处理组间比较采用双因素方差分析,组间比较采用Bonferroni检验;同一处理组不同时间点比较采用单因素方差分析,组间比较采用Dunnett t检验,相关性采用Spearman等级相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 心肌组织MDA含量测定
供心置入保存液后,实验组及对照组MDA含量均表现为逐渐升高,同一时间点相比差异有统计学意义(P<0.01)。实验组供心保存8 h MDA含量明显增加,与保存6 h相比差异无统计学意义;10 h MDA含量增加趋势显著,与8 h相比差异有统计学意义(P<0.01)。对照组供心保存4 h MDA含量即明显增加,保存6 h后MDA含量增加显著,差异有统计学意义(P<0.01)。结果见表1及图1。
表1 2组中各时间点MDA的含量测定Tab.1 The concentrations of MDA in the two groups of control and NCR at different time points()(nmol/mg)

表1 2组中各时间点MDA的含量测定Tab.1 The concentrations of MDA in the two groups of control and NCR at different time points()(nmol/mg)
** P <0.01 vs control group;MDA:malonaldehyde;NCR:nicorandil.
Time/h Control group NCR group 2 1.98 ±0.55 0.35 ±0.09**2.13 ±0.57 0.37 ±0.09**6 2.94 ±0.55 0.53 ±0.10**8 4.02 ±0.97 1.28 ±0.24**10 5.31 ±1.34 2.70 ±0.42**12 6.34 ±0.11 3.29 ±0.12**16 7.15 ±0.17 4.42 ±0.14**20 7.70 ±0.17 4.36 ±0.22**______24___________________________________________________8.24_±0.17_5.19±0.18 4**________
2.2 心肌组织电镜超微结构观察
对照组保存6 h的供心可见心肌细胞水肿明显,局灶性肌丝断裂溶解消失,染色体边集,线粒体嵴模糊、部分消失、线粒体间空泡较多、线粒体内出现空泡及致密颗粒(图1A)。实验组低温保存8 h的离体心脏心肌细胞尚完整,肌丝、肌节排列稍紊乱,线粒体轻度肿胀有空泡化,增生明显,嵴较乱(图1B)。

图1 实验组和对照组离体心肌组织的超微结构Fig.1 The ultrastructure of myocardial tissue in two groups(6 600×)
2.3 尼可地尔组和对照组各时间点心肌组织HSP70免疫组化测定结果
对照组各时间点心肌组织仅见少量HSP70阳性细胞,各时间点HSP70表达量明显少于实验组(P<0.01)(表2,图2A)。与对照组比较,尼可地尔预处理组离体后2 h可见中量胞核呈棕黄色的HSP70阳性细胞;6 h达到高峰,可见大量胞核呈黄褐色阳性细胞,明显高于其他时间点(P<0.05)(图2B);随离体心脏保存时间延长,HSP70阳性细胞数逐渐减少,最终24 h时仅见胞核少量阳性细胞,数量明显减少。
表2 2组不同时间点HSP70阳性细胞数Tab.2 The HSP70 positively stained cells in the two groups of control and NCR at different time point()(n=12)

表2 2组不同时间点HSP70阳性细胞数Tab.2 The HSP70 positively stained cells in the two groups of control and NCR at different time point()(n=12)
* P <0.05,** P <0.01 vs control group;NCR:nicorandil.
Time/h Control group NCR group 2 1.02 ±0.16 67.01 ±5.04**1.31 ±0.21 66.60 ±4.66**6 1.72 ±0.42 79.68 ±6.18**8 1.89 ±0.33 74.45 ±4.46**10 1.68 ±0.35 65.99 ±5.80**12 0.84 ±0.29 43.27 ±4.07*16 0.80 ±0.19 25.49 ±3.27*20 0.78 ±0.27 15.41 ±2.88*______24___________________________________________________0.66_±0.32_2.25_±0.72 4*_________
2.4 尼可地尔预处理组及其对照组心肌组织HSP70蛋白印迹测定结果
与实验组相比,对照组各时间点只有微量HSP70蛋白表达(表3,图3A)(P<0.01)。尼可地尔预处理组离体后2 h HSP70蛋白中量表达;至6 h即可见大量HSP70蛋白表达,表达量大于同组其他时间点(图3B)(P<0.01);随离体心脏保存时间延长,HSP70表达水平逐渐下降,但离体24 h后仍高于对照组(P<0.01)。
2.5 心脏损伤指标MDA与HSP70表达的相关关系比较
Spearman相关分析显示:MDA与HSP70阳性细胞数、HSP70蛋白表达量之间均有明显负相关性(r1= -0.724,P <0.05;r2= -0.715,P <0.05),差异具有统计学意义。
3 讨论
1967年首例人类心脏移植成功以来,心脏移植效果随着心脏保存技术的改进有了显著提高[1,13]。缺血预处理和热预处理作为有效的心脏保存方式毕竟是一种损伤性过程,而且最佳时间、安全时限及个体差异等问题使其临床应用受到限制。使用药物替代缺血进行预处理来保存离体心肌具有更大的临床意义。
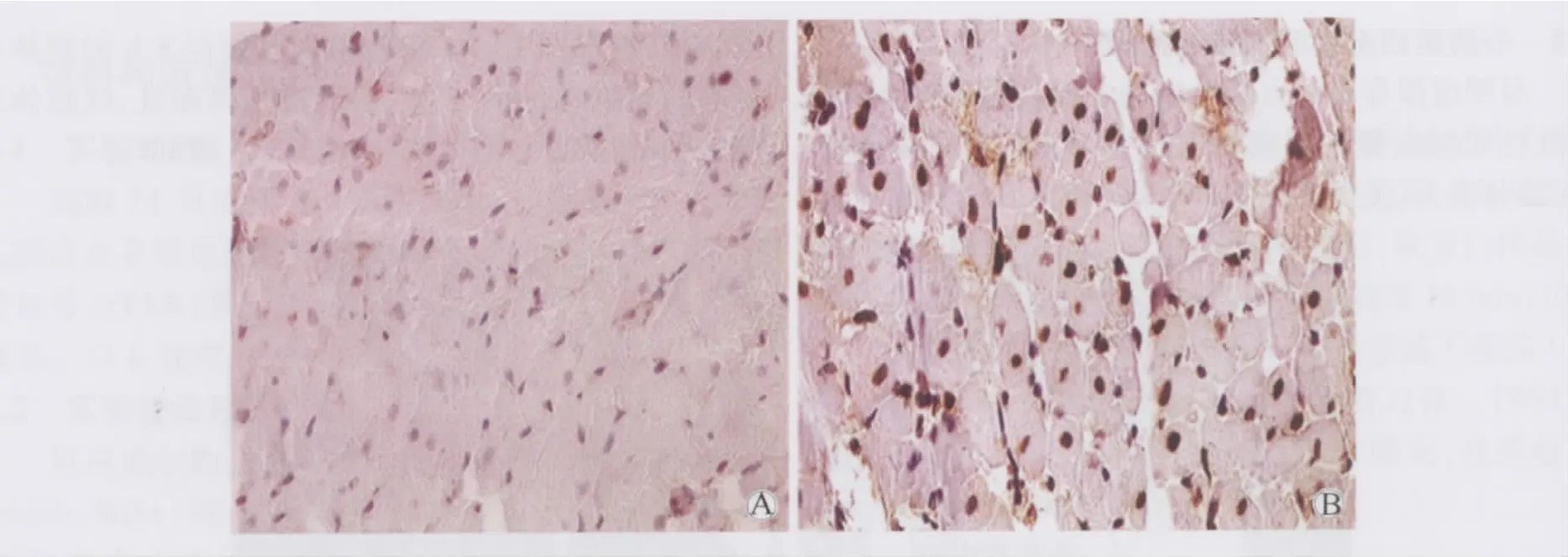
图2 对照组和实验组HSP70蛋白免疫组化图Fig.2 The expression of HSP70 in two groups(400×)
表3 2组不同时间点HSP70蛋白印记结果Tab.3 The expression of HSP70 protein in the two groups of control and NCR at different time point()(n=12)

表3 2组不同时间点HSP70蛋白印记结果Tab.3 The expression of HSP70 protein in the two groups of control and NCR at different time point()(n=12)
** P <0.01 vs control group;NCR:nicorandil.
Time/h control group NCR group 2 0.98 ±0.10 4.51 ±0.31**1.05 ±0.15 3.67 ±0.41**6 1.15 ±0.21 5.28 ±0.33**8 1.58 ±0.34 4.71 ±0.46**10 1.17 ±0.18 3.92 ±0.43**12 0.89 ±0.12 2.88 ±0.33**16 1.02 ±0.16 3.51 ±0.21**20 0.81 ±0.12 0.93 ±0.25**24 0.72 ±0.11 1.52 ±0.61 4**
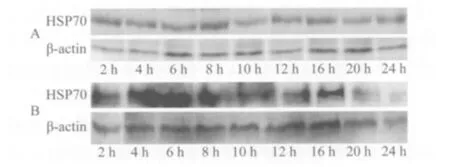
图3 2组不同时间点HSP70蛋白水平表达Fig.3 The expression of HSP70 protein in two groups at different time point
研究[14]表明七氟烷预处理新生大鼠心肌细胞过程中,钾离子ATP通道抑制剂可以抑制HSP70的表达。为了进一步研究钾离子ATP通道与HSP70在离体心肌保存中的关系,我们使用钾离子ATP通道开放剂尼可地尔预处理大鼠。与对照组相比,尼可地尔预处理组过氧化产物丙二醇MDA含量增加不多,随着保存时间的延长其心肌超微结构也有所改善。这提示尼可地尔预处理和低温保存离体心脏可以使供心的心肌结构改变较轻微,对大鼠离体心脏的保存有利。本研究前期试验提示,尼可地尔、去甲肾上腺素、黄芪、硝酸甘油、倍他乐克、三七、川芎嗪等都能诱导在体心肌表达内源性HSP70,而尼可地尔的诱导作用最强。本实验进一步动态观察了尼可地尔预处理诱导离体心脏HSP70的表达规律。免疫组化和免疫印记结果表明在低温保存条件下,实验组各时间点HSP70蛋白表达量均显著大于对照组,实验组在6 h就达到高峰,而且主要定位于细胞核。相关分析结果表明心脏损伤程度指标MDA与HSP70表达呈显著负相关,进一步提示HSP70为离体心肌的保护因素之一。有研究[15]认为细胞内HSP70短暂高表达可减轻因ATP耗竭引起的细胞毒性和蛋白毒性效应。另外由于冷存离体心脏仍保持低水平的新陈代谢,所以仍可表达痕量HSP70,但由于代谢缓慢和底物不足,随时间延长,其表达量也明显降低。本实验证实在体尼可地尔诱导后离体心脏仍能表达保护性HSP70,并且呈现一定的表达规律,提示药物预处理确能对离体心脏提供一定的保护作用。
尼可地尔预适应的机制非常复杂,本文仅初步探讨了诱导型HSP70所起的作用,具体的分子机制如HSP70与KATP的关系有待进一步研究。
[1]Hatayama N,Yoshida Y,Seki K.A study on the perfusion preservation,resuscitation,and transplantation of a rat heart isolated for 96 hours[J].Cell Transplant,2009,18(5):529-534.
[2]Michel P,Hadour G,Chiari P,et al.Evaluation of a new preservation solution for hypothermic heart transplant[J].Ann Cardiol Angeiol(Paris),2000,49(6):367-376.
[3]Yang Q,Zhang R Z,Yim A P,et al.Histidine-tryptophanketoglutarate solution maximally preserves endothelium-derived hyperpolarizing factor-mediated function during heart preservation:comparison with University of Wisconsin solution[J].J Heart Lung Transplant,2004,23(3):352-359.
[4]Kajihara N,Morita S,Tanoue Y,et al.The UW solution has greater potential for longer preservation periods than the Celsior solution:comparative study for ventricular and coronary endothelial function after 24-h heart preservation[J].Eur J Cardiothorac Surg,2006,29(5):784-789.
[5]Takagi H,Hsu C P,Kajimoto K,et al.Activation of PKN mediates survival of cardiac myocytes in the heart during ischemia/reperfusion[J].Circ Res,2010,107(5):642-649.
[6]Basgut B,Kayki G,Bartosova L,et al.Cardioprotective effects of 44Bu,a newly synthesized compound,in rat heart subjected to ischemia/reperfusion injury[J].Eur J Pharmacol,2010,640(1-3):117-123.
[7]Shackebaei D,Godini A,Reshadat S.The effects of diazepam in cardio depressant concentration on the function of isolated rat heart in ischemia-reperfusion[J].Saudi Med J,2008,29(6):847-853.
[8]Naderi R,Imani A,Faghihi M.Phenylephrine produces late pharmacological preconditioning in the isolated rat heart[J].Eur J Pharmacol,2010,627(1-3):203-208.
[9]Wisel S,Khan M,Kuppusamy M L,et al.Pharmacological preconditioning of mesenchymal stem cells with trimetazidine(1-〔2,3,4-trimethoxybenzyl〕piperazine)protects hypoxic cells against oxidative stress and enhances recovery ofmyocardial function in infarcted heart through Bcl-2 expression[J].J Pharmacol Exp Ther,2009,329(2):543-550.
[10]Khanna G,Diwan V,Singh M,et al.Reduction of ischemic,pharmacological and remote preconditioning effects by an antioxidant N-acetyl cysteine pretreatment in isolated rat heart[J].Yakugaku Zasshi,2008,128(3):469-477.
[11]Joyeux-Faure M,Ramond A,Beguin P C,et al.Early pharmacological preconditioning by erythropoietin mediated by inducible NOS and mitochondrial ATP-dependent potassium channels in the rat heart[J].Fundam Clin Pharmacol,2006,20(1):51-56.
[12]Tang Y,Wang Q Y.Effects of sevoflurane-induced and anoxia-induced preconditioning on HSP70 expression in neonatal rat cardiomyocytes[J].Hunan Yi Ke Da Xue Xue Bao,2003,28(2):129-132.
[13]Hing A J,Watson A,Hicks M,et al.Combining cariporide with glyceryl trinitrate optimizes cardiac preservation during porcine heart transplantation[J].Am J Transplant,2009,9(9):2048-2056.
[14]Tang Y,Wang Q,Li J.Influence of KATP channel inhibitor on the changes of HSP70 expression in sevoflurane-induced neonatal rat cardiomyocytes[J].Sichuan Da Xue Xue Bao Yi Xue Ban,2003,34(4):653-655.
[15]Kabakov A E,Budagova K R,Latchman D S,et al.Stressrful preconditioning and HSP70 over-expression attenuate proteotoxicity of cellular ATP depletion[J].Am J Physiol Cell Physiol,2002,283(2):521-534.
