6-取代乙酰化烯糖的合成
2011-04-25赵晋忠邵华武
赵晋忠,邵华武
(1.山西农业大学 文理学院,山西 太谷030801;2.中科院成都生物研究所,天然产物中心,四川 成都610041)
烯糖是重要的合成中间体,具有碳碳双键官能团,可以发生加成、重排、取代、氧化等糖苷化反应,常用来合成活性天然产物、低聚多糖[1~3]、C-糖苷[4]、O-糖苷[5]、S-糖苷[6]、N-糖苷[7]以及1,2-环丙烷糖[8]等糖类化合物。此外,烯糖还可以合成2-氨基糖、环氧丙烷类糖和内酰胺糖等具有重要生物活性的糖类化合物[9]。6-O-甲磺酰基、6-O-对甲苯磺酰基和6-叠氮乙酰化烯糖不仅具有碳探双键官能团,在6-位上还具有离去基团甲磺酰基、对甲基苯磺酰基以及叠氮官能团,这样利于构建更多的糖类化合物。Spencer[10]等人用三价铬催化溴代糖合成了乙酰化烯糖,Hansen[11]等人三价钛的络合物与溴代糖反应合成了乙酰化单糖烯糖和二糖烯糖,Parrish[12]等人用电化学的方法还原溴代糖制得乙酰化单糖烯糖和二糖烯糖。Tius[13]等人以乙酰化葡萄烯糖为原料经过三步合成了6-O-甲磺酰基乙酰化葡萄烯糖。Crotti[14]等人同样以乙酰化葡萄糖烯糖为原料,经过磷脂酶CCL催化,选择性地脱去了6-位乙酰基,再与对甲基苯磺酰氯反应生成6-O-对甲苯磺酰基乙酰化烯糖,上述合成6-O-甲磺酰基、6-O-对甲苯磺酰基乙酰化烯糖的方法的缺点就是先合成烯糖,然后再在6-位发生甲磺酰化和对甲基苯磺酰化反应,反应步骤多,增大了合成成本。本研究以游离糖为原料首先合成6-O-甲磺酰基、6-O-对甲苯磺酰基乙酰化溴代糖(见图1)和6-叠氮乙酰化溴代糖(见图2),再以溴代糖为原料合成烯糖。从而提供了一种步骤少、成本低的合成烯糖的方法。

图1 6-O-甲磺酰基、6-O-对甲苯磺酰基乙酰化溴代糖的合成Fig.1 Synthesis of 6-O-mesyl and 6-O-tosyl acetylated glycosyl bromides
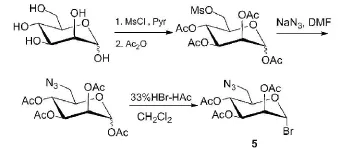
图2 6-叠氮乙酰化溴代糖的合成Fig.2 Synthesis of 6-azide acetylated glycosyl bromides
1 实验部分
1.1 仪器与试剂
RE-2000A旋转蒸发仪(上海亚荣生化仪器厂),Brucker-600型核磁共振仪,BioTOF Q型质谱仪,Perkin-Elmer-341型自动旋光仪,葡萄糖、甘露糖、半乳糖、对甲苯磺酰氯为分析纯,甲磺酰氯为化学纯。
1.2 实验步骤
1.2.1 化合物1和3的合成
称取D-葡萄糖(或D-半乳糖)1.0 g,加20 mL吡啶溶解,在-10℃加入甲磺酰氯0.6 mL,反应16 h后再加入乙酸酐10 mL,继续反应2 h,薄层色谱(T LC,Thin Layer Chromatography)检测反应完全。反应混合液加乙酸乙酯稀释,依次用水、饱和碳酸氢钠洗涤,有机相用无水硫酸镁干燥,浓缩,得粗产物用于下一步反应。
将上一步反应得到的粗产物溶于CH2Cl2(30 mL),在0℃下加33%HBr-HAc(2.0 mL),0℃反应2 h,T LC检测反应完全后,加二氯甲烷稀释,分别用水、饱和碳酸氢钠、饱和盐水洗,然后用无水硫酸镁干燥,浓缩,经硅胶柱纯化,得溴代葡萄糖(溴代半乳糖)1.24 g,50%。
1.2.2 化合物2和4的合成
称取D-葡萄糖(或D-半乳糖)1.0 g,加20 mL吡啶溶解,在-10℃加入对甲苯磺酰氯1.8 g,反应16 h后再加入乙酸酐10 mL,继续反应2 h,T LC检测反应完全。反应混合液加乙酸乙酯稀释,依次用水、饱和碳酸氢钠洗涤,有机相用无水硫酸镁干燥,浓缩,得粗产物用于下一步反应。将上一步反应得到的粗产物溶于CH2Cl2(30 mL),在0℃下加33%HBr-HAc(2.0 mL),0℃反应2 h,T LC检测反应完全后,加二氯甲烷稀释,分别用水、饱和碳酸氢钠、饱和盐水洗,然后用无水硫酸镁干燥,浓缩,经硅胶柱纯化,得溴代葡萄糖(溴代半乳糖)1.63 g,56%。
1.2.3 化合物5的合成
称取D-甘露糖1.0 g,加20 mL吡啶溶解,在-10℃加入甲磺酰氯0.6 mL,反应16 h后再加入乙酸酐10 mL,继续反应2 h,T LC检测反应完全。反应混合液加乙酸乙酯稀释,依次用水、饱和碳酸氢钠洗涤,有机相用无水硫酸镁干燥,浓缩,得粗产物用于下一步反应。将得到的粗产物溶于DMF(10 mL),加NaN3(0.45 g),80℃反应5 h,T LC检测反应完全后,加二氯甲烷稀释,用水、饱和盐水洗,然后用无水硫酸镁干燥,浓缩后加CH2Cl2(30 mL)溶解,在 0℃下加 33%HBr-HAc(2.0 mL),0℃反应2 h,TLC检测反应完全后,加二氯甲烷稀释,分别用水、饱和碳酸氢钠、饱和盐水洗,然后用无水硫酸镁干燥,浓缩,经硅胶柱纯化,得溴代甘露糖0.86 g,40%。
1.2.4 烯糖的合成
在100 mL圆底烧瓶中加入溴代糖20 mmol,再加 20 mL PEG-600和 60 mmol锌粉,超声震荡反应1 h,T LC检测反应完全后过滤,滤液用二氯甲烷萃取3次,合并二氯甲烷萃取液,用饱和碳酸氢钠溶液洗涤3次,饱和氯化钠溶液洗涤1次,加无水硫酸钠干燥,过滤,减压浓缩,经硅胶柱纯化得烯糖。
1.2.5 化合物数据
2,3,4-三-O-乙酰基-6-O-甲磺酰基-α-D-溴代葡萄糖(1)
1H NMR(CDCl3,600 MHz):δH2.04(s,3H,COCH3),2.08(s,3H,COCH3),2.10(s,3H,COCH3),3.06(s,3H,CH3),4.30-4.38(m,3H,H-5,H-6,H-6′),4.84(dd,1H,H-4,J=9.8,3.9),5.16(dd,1H,H-2,J=9.7,9.7),5.56(dd,1H,H-3,J=9.8,9.7),6.62(d,1H,H-1,J=4.0).
2,3,4-三-O-乙酰基-6-O-对甲苯磺酰基-α-D-溴代葡萄糖(2)
1H NMR(CDCl3,600 MHz):δH2.00(s,3H,COCH3),2.01(s,3H,COCH3),2.08(s,3H,COCH3),2.46(s,3H,CH3),4.16-4.17(m,2H,H-6,6′),4.28(m,1H,H-5),4.71(dd,1H,J=14.0,4.0,H-4),5.09(dd,1H,J=9.8,9.7,H-2),5.49(dd,1H,J=9.9,9.7,H-3),6.48(d,1H,H-1,J=4.1).
2,3,4-三-O-苯甲酰基-6-O-对甲苯磺酰基-α-D-溴代半乳糖(4)
1H NMR(CDCl3,600 MHz)δH1.99(s,3H),2.08(s,3H),2.09(s,3H),2.46(s,3H),4.05-4.12(m,2H),4.43(dd,1H,J=6.3,6.1),4.99(dd,1H,J=10.7,4.0),5.34(dd,1H,J=10.5,3.2),5.47(d,1H,J=3.1),6.60(d,1H,J=4.0),7.36(d,2H,J=8.0),7.77(d,2H,J=8.2).
2,3,4-三-O-苯甲酰基-6-叠氮-α-D-溴代甘露糖(5)
1H NMR(CD3COCD3,600 MHz)δH1.95(s,3H),2.08(s,3H),2.11(s,3H),3.60(dd,1H,J=11.6,5.8),3.71(dd,1H,J=11.8,2.3),4.25(m,1H),5.36(dd,1H,J=10.1,10.1),5.43(m,1H),5.63(dd,1H,J=10.1,3.5),6.11(s,1H).
3,4-二-O-乙酰基-6-O-甲磺酰基-D-葡萄烯糖(6)
[α]D25-4(c 0.3,CHCl3).1H NMR(CDCl3):δH2.06(s,3H),2.10(s,3H),3.07(s,3 H),4.35(m,2H),4.47(dd,1H,J=11.6,6.2),4.89(dd,1H,J=6.2,3.5),5.21(dd,1H,J=7.4,5.6),5.35(m,1H),6.48(d,1H,J=6.2).
3,4-二-O-乙酰基-6-O-对甲苯磺酰基-D-葡萄烯糖(7)
[α]D25+16(c 1.5,CHCl3).1H NMR(CDCl3):δH2.03(d,3H),2.04(d,3H),2.46(s,3H),4.23(m,3H),4.82(dd,1H,J=6.2,3.5),5.13(dd,1H,J=3.7,3.7),5.27(dd,1H,J=6.2,5.5),6.35(d,1H,J=6.0),7.35(d,2H,J=7.9),7.80(d,2H,J=8.4).
3,4-二-O-乙酰基-6-O-甲磺酰基-D-半乳烯糖(8)
[α]D25-5(c 0.4,CH2Cl2).1H NMR(CDCl3):δH2.06(s,3H),2.10(s,3H),3.07(s,3H),4.33-4.37(m,2H),4.48(dd,1H,J=6.0,2.9),4.89(dd,1H,J=6.0,3.3),5.21(dd,1H,J=7.2,5.5),5.35(dd,1H,J=4.3,3.5),6.48(d,1H,J=6.2).13C NMR(CDCl3):δC20.8,20.9,37.8,65.6,66.9,67.0,73.6,99.4,145.3,169.8,170.3.HRESIMS:calcd for C11H16Na1O8S1[M+Na]m/z 331.0458,found m/z 331.0474.
3,4-二-O-乙酰基-6-O-对甲苯磺酰基-D-半乳烯糖(9)
[α]D25+3(c 1.8,CH2Cl2).1HNMR(CDCl3):δH2.01(s,3H),2.05(s,3H),2.46(s,3H),4.14(dd,1H,J=10.5,4.4),4.28(dd,1H,J=10.6,7.7),4.32(m,1H),4.72(dd,1H,J=6.1,3.1),5.37(s,1H),5.48(s,1H),6.35(d,1H,J=6.1),7.36(d,2H,J=8.2),7.79(d,2H,J=8.2).13C NMR(CDCl3):δC20.5,20.7,21.7,63.5,63.8,66.7,72.4,98.9,128.0,129.9,132.6,145.2,169.8,170.1.HR-ESIMS:calcd for C17H20 Na1O8S1[M+Na]m/z 407.0771,found m/z 407.0779.
3,4-二-O-乙酰基-6-叠氮-D-葡萄烯糖(10)
[α]D25-46(c 0.1,CH2Cl2).1H NMR(CDCl3):δH2.06(s,3H),2.10(s,3H),3.56(dd,1H,J=11.0,6.5),3.61(dd,1H,J=11.2,5.0),4.29(dd,1H,J=11.8,6.0),4.87(dd,1H,J=6.0,3.5),5.28-5.31(m,2H),6.50(d,1H,J=6.1).
2 结果与讨论
以葡萄糖和半乳糖为原料,与甲磺酰氯(MsCl)和对甲苯磺酰氯(TsCl)反应,在6-位上选择性加上Ms和Ts基团,再经乙酰化和溴代合成了乙酰化溴代糖1~4,经三步反应产率在50%~56%之间,在第一步反应中需要在冰盐浴(大约为-10℃)中加T sCl和MsCl,如果反应温度高就会引起其它位上Ts化或Ms化,生成多取代的化合物。此外,我们又设计合成了6-叠氮乙酰化溴代糖(图2),在实验过程中发现,以葡萄糖和甘露糖原料根据图2的合成路线进行反应,可以制得6位Ms和Ts取代的乙酰化糖,再与叠氮化钠反应时,6-C上的MsO-和T sO-基团不会被叠氮基取代,而以甘露糖为原料可以制得6-N3乙酰化溴代甘露糖。其原因可能是2-C上的取代基位置不同所致,甘露糖2-C上的取代基在吡喃环的上方,而葡萄糖和半乳糖2-C上的取代基在吡喃环的下方。根据我们课题组最近报道的合成烯糖的方法[15],将生成的溴代糖转化成6-O-甲磺酰基、6-O-对甲苯磺酰基和6-叠氮乙酰化烯糖,结果见表1。
总之,本研究设计合成了6-O-甲磺酰基、6-O-对甲苯磺酰基和6-叠氮乙酰化烯糖,具有反应步骤短、成本低的优点。
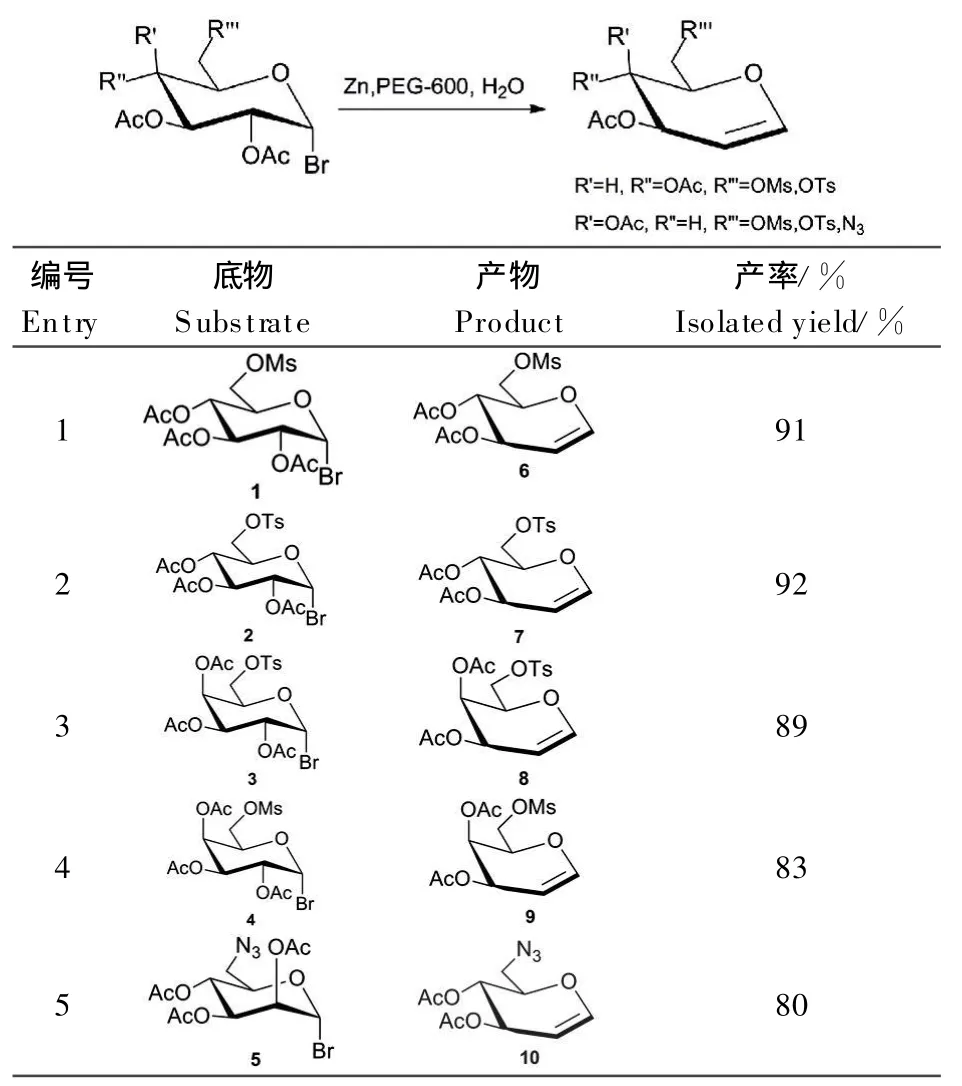
表1 6-取代乙酰化烯糖的合成Table 1 Synthesis of 6-substitued acetylated glycals
[1]Ganesan M,Ramesh N G.A new and short synthesis of naturally occurring 1-deoxy-L-gulonojirimycin from tri-O-benzyl-D-glucal[J].Tetrahedron Lett,2010,51:5574-5576.
[2]Denmark S E,Regens C S,Kobayashi T.Total synthesis of papulacandin D[J].J Am Chem Soc,2007,129:2774-2776.
[3]Saquib M,Gupta M K,Sagar R,et al.C-3 alkyl/arylalkyl-2,3-dideoxy hex-2-enopyranosides as antitubercular agents:Synthesis,biological evaluation,and QSA R study[J].J M ed Chem,2007,50:2942-2950.
[4]Ayed C,Palmier S,Lubin-Germain N,et al.Indium-mediated alkyny lation of sugars:Sy nthesis of C-glycosyl compounds bearing a protected amino alcohol moiety[J].Carbohydr Res,2010,345:2566-2570.
[5]Sirion U,Purintawarrakun S,Sahakitpichan P,et al.An efficient method for the selective synthesis of 2-deoxy-2-iodo-g lycosides by O-g lycosidation of D-glucal using I2-Cu(OAc)2[J].Carbohydr Res,2010,345:2401-2407.
[6]Seeberger P H,Eckhard M,Gutteridge C E,et al.Coupling of Glycal derived thioethyl glycosyl donors with glycal accepto rs.An advance in the scope of the glycal assembly[J].J Am Chem Soc,1997,119:10064-10072.
[7]Ding F Q,William R,Gorityala BK,et al.A mild and efficient sy nthetic protocol for Ferrier azagly cosylation promoted by ZnCl2/Al2O3[J].Tetrahedron Lett,2010,51:3146-3148.
[8]Cousins G S,Hoberg J O.Synthesis and chemistry of cy clopropanated carbohydrates[J].Chem Soc Rev,2000,29:165-174.
[9]Lemieux R U,Ratcliffe R M.The azidonitration of tri-O-acetyl-D-galactal[J].Can J Chem,1979,57:1244-1251.
[10]Spencer R P,Cavallaro C L,Schwartz J.Rapid preparation of variously protected glycals using titanium(III)[J].J Org Chem,1999,64:3987-3995.
[11]Hansen T,Daasbjerg K,Skrydstrup T.Development of a catalytic cycle fo r the generation of C1-glycosyl carbanions with Cp2TiCl2:application to glycal synthesis[J].T etrahedron Lett,2000,41:8645-8649.
[12]Parrish J D,Little R D.Electrochemical formation of g lycals in THF[J].Tetrahedron Lett,2001,42:7371-7374.
[13]Tius M A,Galeno J G,Gu X,et al.C-glycosy lanthraquinone synthesis:Total sy nthesis of vineomycinone B2 methyl ester[J].J Am Chem Soc,1991,113:5775-5183.
[14]Crotti P,Bussolo V D,Favero L,et al.Regiochemical control of the ring opening of 1,2-epoxides by means of chelating processes.Part 17:Synthesis and opening reaction of cis-and trans-oxides derived from(2S,6R)-2-benzyloxy l-6-methyl-3,6-dihydro-2H-pyran,(2R,6R)-and(2S,6R)-2-methoxy-6-methyl-5,6-dihydro-2H-py ran[J].Tetrahedron,2002,58:6069-6091.
[15]Zhao J Z,Wei S Q,Ma X F,et al.A mild and environmentally benign method for the synthesis of gly cals in PEG-600/H2O[J].Green Chem,2009,11:1124-1127.
