一株拮抗细菌拮抗性能的测试与评价
2011-04-25贾翠英王秀梅张玉辉
贾翠英,王秀梅,张玉辉
(1.河南科技学院,河南新乡 453003;2.三门峡市湖滨果汁有限公司,河南三门峡 472000)
拮抗细菌(antagonistic bacteria)是指对某种细菌的生长繁殖有抑制作用的细菌,它主要通过产生拮抗物质来发挥拮抗作用.目前应用较多的拮抗细菌主要有芽孢杆菌Bacillus subtilis、假单胞杆菌Pseudomonasspp、土壤放射杆菌Agrobacterium radiobacter以及其它一些细菌[1].
拮抗细菌在代谢活动中通过分泌抗菌物质直接对病原菌的生长和繁殖产生抑制是自然界普遍存在的现象,也是众多拮抗细菌应用的物质基础.拮抗细菌发挥作用的抗菌物质多种多样,但主要有2类:一是小分子的抗生素;二是大分子的拮抗蛋白或细胞壁降解酶类[2-3].随着越来越多对拮抗细菌的关注,拮抗细菌的抑菌机制逐渐清楚,现在所熟悉的抑菌机制有拮抗作用、竞争作用、寄生作用和诱导系统抗性(ISR).拮抗作用是指拮抗细菌的同化作用产生能抑制病原菌的抑菌物质,一般在低浓度下就能对病原菌的生长和代谢产生抑制,引起细胞内溶现象.测定拮抗细菌抑菌效果的主要方法有定性测定的扩散法(如抑菌圈试验)和定量测定的稀释法(如最低抑菌浓度试验).大量研究表明[4-6],拮抗细菌菌株生长量与其抗菌物质分泌成正相关,可见菌株抗菌物质是在菌株生长过程中分泌的代谢产物.
本研究通过抑菌圈试验测定抑菌圈直径大小作为判定拮抗细菌的拮抗性能指标,考查培养基组分及发酵条件对拮抗细菌拮抗性能的影响,筛选出该拮抗细菌的最佳发酵培养基及合适的发酵条件,以期为进一步研究和利用拮抗细菌更好地发挥其拮抗性能提供前提和参考.
1 材料和方法
1.1 菌种
试验所用拮抗细菌由本实验室分离所得,并经生理生化及分子生物学鉴定属于肠杆菌属Enterobactersp.中的一种.
1.2 培养基
斜面培养基:牛肉膏3 g/L,蛋白胨10 g/L,氯化钠5 g/L,琼脂18 g/L,pH7. 0;发酵培养基:牛肉膏3 g/L,蛋白胨10 g/L,氯化钠5 g/L,pH7.0.
1.3 方法
1.3.1 菌种活化 将4℃冰箱内保存的拮抗细菌转接到斜面培养基,28℃培养24 h,备用.
1.3.2 液体种子的制备 取2~3环活化的菌种,接入内盛100mL种子培养基的250mL三角瓶中,28℃,160 r/min培养24 h.
1.3.3 拮抗试验的设计与优化 取10mL拮抗细菌液体种子,接入内盛100mL发酵培养基的250mL三角瓶中,28℃,180 r/min振荡培养24 h,进行最适碳源、最适氮源、最适无机盐的筛选与优化试验,确定最佳发酵培养基,然后利用所确定的最佳发酵培养基进行拮抗试验进一步确定最佳的抗菌条件.
1.3.4 抑菌活性的测定方法 利用移液枪吸取200μL枯草芽孢杆菌发酵液转入内盛100mL灭菌冷却至50℃的斜面培养基中,混匀,倒平板,冷却至凝固,然后用内径为8mm的打孔器在平板上打孔,用移液枪吸取150μL拮抗细菌发酵液注入孔内,于28℃恒温箱内培养24 h,测量抑菌圈大小,抑菌圈直径越大表示抑菌活性越大[7-8].
2 结果与分析
2.1 最适发酵培养基确定
2.1.1 最适碳源的筛选 在初始发酵培养基基础上,分别添加不同的碳源,质量浓度为均3 g/L,所加碳源分别为葡萄糖、淀粉、玉米淀粉和蔗糖,以原始培养基发酵后进行拮抗试验为对照,然后参照1.3.4所述进行拮抗发酵试验,通过测定发酵液对病原菌拮抗所产生的抑菌圈大小,确定最适碳源,实验结果见表1.

表1 不同碳源对拮抗细菌拮抗性能的影响
由表1可知,该拮抗细菌的抑菌效果因碳源的有无及碳源的种类不同而变化,当培养基中添加不同碳源时,其抑菌效果明显增大,且以淀粉和玉米淀粉为碳源时抑菌效果要优于蔗糖和葡萄糖.根据抑菌圈直径大小顺序,可知最适碳源为淀粉,其抑菌圈直径为2.89 cm,与不加碳源相比抑菌效果提高了100.49%.此外,由表还可知,多糖作为碳源时比单糖更有利于拮抗细菌拮抗性能的表达.
2.1.2 最适氮源的筛选 最适氮源筛选试验中所加氮源分别为酵母膏、尿素、氯化胺和蛋白胨,质量浓度均为10 g/L,其余方法同2.1.1,实验结果见表2.

表2 不同氮源对拮抗细菌拮抗性能的影响
由表2可知,不同氮源的添加对拮抗菌的抑菌效果均有促进作用,但不同氮源所产生的抑菌效果不同,比较抑菌圈直径大小可知最适氮源为蛋白胨,其抑菌圈直径为3.25 cm,由表中结果可知,有机氮源的添加比无机氮源更有利于拮抗细菌拮抗性能的表达,其原因可能是无机氮源的部分挥发造成微生物的利用率较低.
2.1.3 最适无机盐的筛选 最适无机盐筛选试验中,分别用5 g/L的氯化钙、硫酸镁、硫酸锰、硫酸亚铁代替原始发酵培养基中的氯化钠制成发酵培养基,并以原始培养基发酵后进行拮抗试验为对照,其余方法同2.1.1,实验结果见表3.
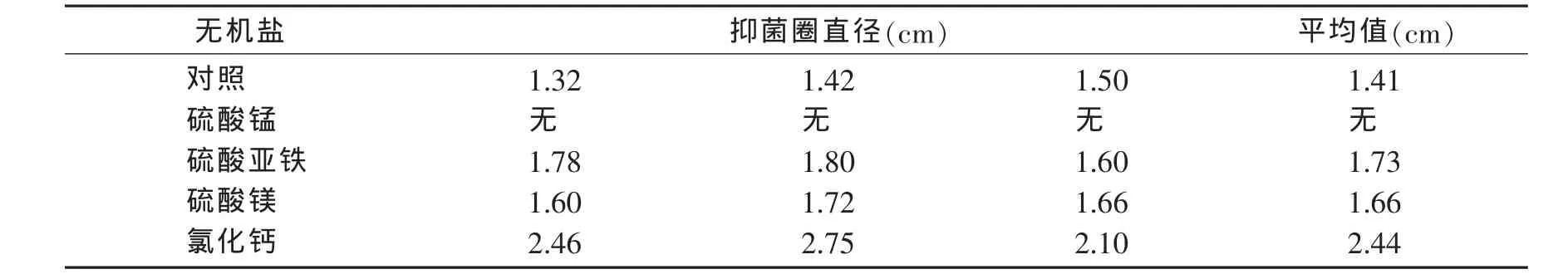
表3 不同无机盐对拮抗细菌拮抗性能的影响
由表3可知,除锰离子对拮抗菌的抑菌效果没有作用外,其它无机盐离子如铁、镁、钙和钠离子对拮抗菌的抑菌效果均有促进作用,比较抑菌圈直径大小可知最适无机盐离子为钙离子,其抑菌圈直径为2.44 cm.
2.1.4 发酵培养基组分优化 以筛选出的最佳碳源、氮源和无机盐为3个重要因素,选用三因素三水平L9(34)正交表进行试验[9],正交试验因素及水平见表4、表5和表6.

表4 正交试验因素水平
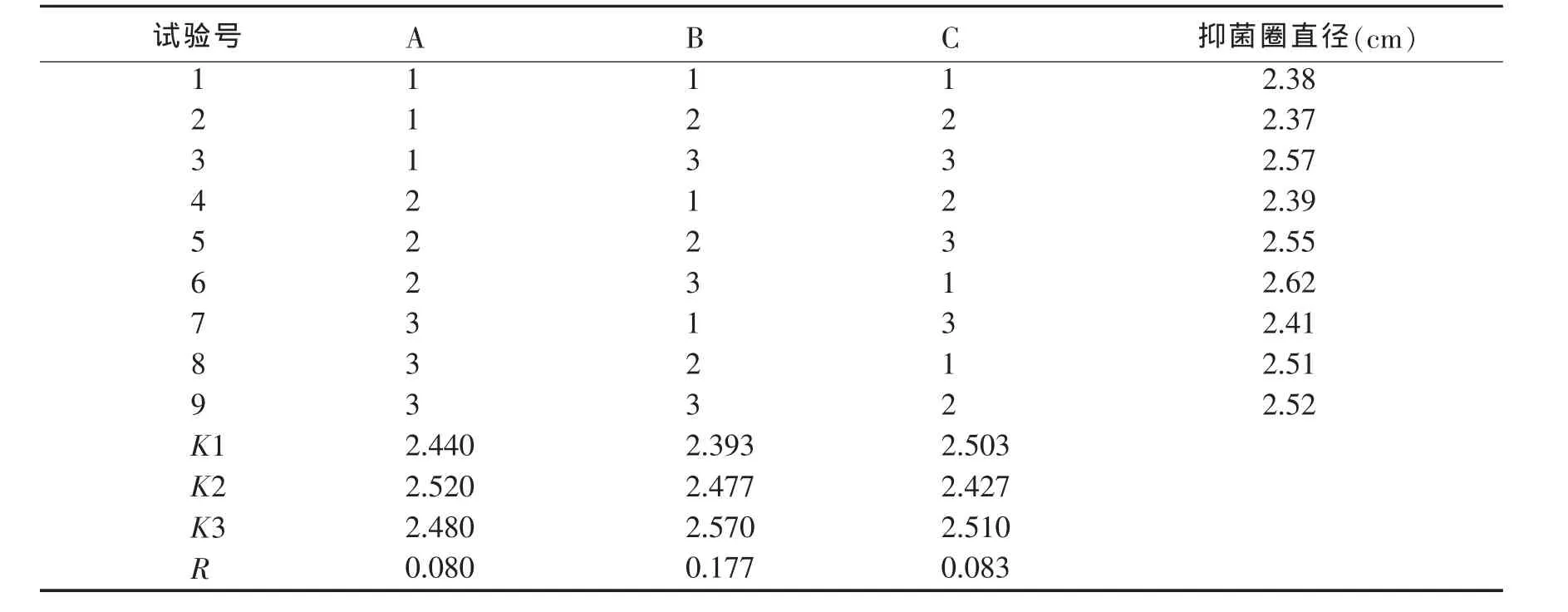
表5 发酵培养基优化正交试验结果

表6 方差分析
由表5可知,试验条件下优化水平的最佳组合为A2B3C1,即该拮抗细菌的最佳发酵培养基配方为淀粉3 g/L,蛋白胨12 g/L和氯化钙3 g/L,极差分析可知,RB>RC>RA,各因子对抑菌活性影响大小为蛋白胨>氯化钙>淀粉.其中,由表6方差分析进一步可知,蛋白胨为显著差异,氯化钙和淀粉为不显著差异.
2.2 最佳发酵条件的确定
利用上述最佳发酵培养基进行拮抗细菌的发酵培养,培养过程中主要考查了培养时间、发酵培养基的初始pH、接种量及装液量,通过进一步拮抗试验确定最佳发酵培养的条件.其中除考查不同单因素试验外,所有发酵培养试验均在250mL三角瓶中进行,均采用10%接种量,40%装液量,初始pH 7.0,28℃,180 r/min,24 h的培养条件.
2.2.1 培养时间的考查 分别对发酵培养12 h、24 h、36 h、48 h、60 h的拮抗细菌发酵液进行拮抗试验,通过测定抑菌圈直径大小来判断拮抗性能,确定最适发酵培养时间,试验结果见表7.

表7 不同发酵培养时间对拮抗细菌拮抗性能的影响
由表7可知,拮抗细菌的抑菌效果随发酵培养时间的延长逐渐增强,并于发酵培养24 h抑菌效果最佳,继续延长发酵时间,抑菌效果开始减弱,其原因可能是该拮抗细菌所分泌的抑菌物质是一种初级代谢产物,在细胞生长的对数期和稳定期前期产量最高.发酵培养的后期,由于营养物质的缺乏和一些次级代谢物质及毒素副产物的积累对细胞生长产生不利影响,导致抑菌效果不明显甚至下降.
2.2.2 初始pH的考查 将拮抗细菌分别接种到初始pH值为5.0、6.0、7.0、8.0、9.0的优化培养基中,并进行抑菌活性的测定,并考查最适pH值.

表8 初始pH值对拮抗细菌拮抗性能的影响
由表8可知,发酵培养基初始pH为弱酸强碱都会引起拮抗细菌拮抗性能的下降,这主要是拮抗细菌自身的生理生化特性决定,即通常细菌生长的最适pH为中性偏碱.由表还可知,发酵培养基的初始pH为7.0~8.0之间时抑菌效果较明显,抑菌圈直径最大为2.67 cm.
2.2.3 接种量的考查 当接种量分别为6%,8%,10%,12%,14%时,拮抗细菌的抑菌效果见表9.

表9 发酵接种量对拮抗细菌拮抗性能的影响
由表9可知,当接种量为8%时抑菌圈直径最大,为2.64 cm,而低于或高于8%接种量时抑菌效果都呈现下降的趋势,可能是由于菌种浓度过高,营养物质受限制所致.
2.2.4 装液量的考查 分别将50mL、75mL、100mL、125mL、150mL的最适发酵培养基注入250mL的三角瓶中,进行发酵试验,然后进一步进行拮抗试验,结果见表10.
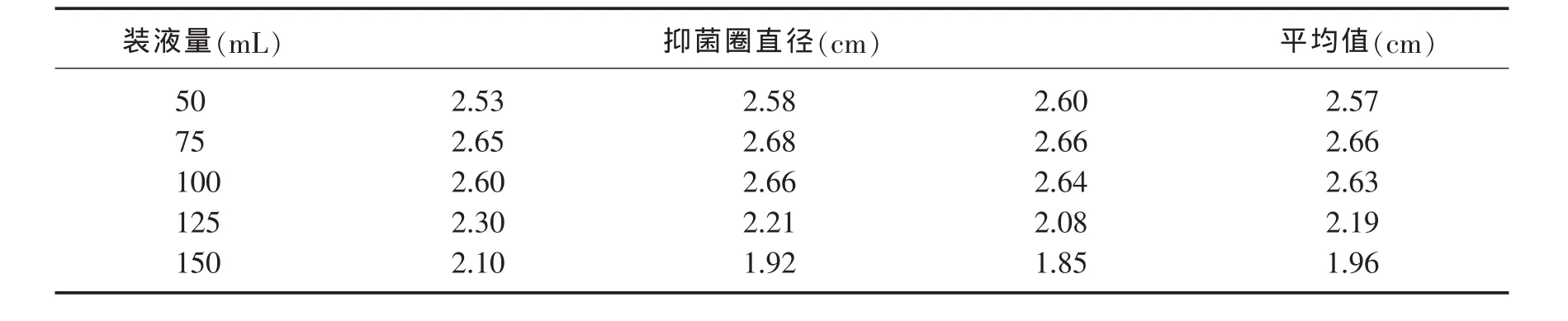
表10 装液量对拮抗细菌拮抗性能的影响
由表10可知,随着装液量的增加,拮抗细菌的拮抗性能逐渐增强,当装液量为75mL~100mL之间时,拮抗性能变化不明显,但继续增加装液量,拮抗性能呈下降趋势.表明该拮抗细菌是需氧型细菌,培养基内溶氧水平越高,越适合产生更多抑菌物质.
3 结论与讨论
菌体发酵是一个复杂的过程,受诸多因素的影响[10].为了使拮抗菌株具有较高的拮抗性能,不仅需要对其产拮抗物质的培养基进行必要的优化,而且还需要合适的发酵条件,以便促进拮抗物质更好地分泌.本研究通过采用单因素及正交试验法对拮抗菌株发酵培养基进行设计优化,并利用最适发酵培养基进行发酵条件的考查,通过测定所产生的抑菌圈直径大小作为评价拮抗菌株拮抗性能优劣的指标.研究表明,该拮抗菌株最适的发酵培养基组分为:淀粉3 g/L,蛋白胨12 g/L,氯化钙3 g/L,培养条件为接种量8%,装液量75mL/250mL,培养时间24 h,初始pH值为8.0,在此条件下,拮抗细菌表现出理想的拮抗性能,其抑菌圈直径达2.6 cm左右.此研究将为更好地利用拮抗细菌进行生防研究提供理论参考价值.
[1]程亮,游春平,肖爱萍,等.拮抗细菌的研究进展[J].江西农业大学学报,2003,25(5):733-737.
[2]张威,张明,白震.土壤中几丁质酶的研究进展[J].土壤通报,2007(6):569-575.
[3]Rajasekaran K,Stromberg KD,Cary JW,et al.Broad-spectrum antimicrobialactivity in vitro of thesynthetic peptideD4E1[J].Journal of agriculturaland food chemistry,2001,49(6):2799-2803.
[4]刘邮洲,陈志谊,刘永锋,等.拮抗菌株C8-8控病促生作用机制初探[J].中国生物防治,2007,23(4):397-400.
[5]何红,沈兆昌,邱思鑫,等.内生拮抗枯草芽孢杆菌BS-2菌株的发酵条件[J].中国生物防治,2004,20(1):38-41.
[6]赵晓燕,武硕,杨海清,等.桃褐腐病菌的拮抗细菌CE的发酵条件研究[J].中国农学通报,2008,24(10):413-418.
[7]张子俊,张元亮.棉花黄萎病拮抗菌发酵条件的初步研究[J].安徽农学通报,2006,12(11):68-69.
[8]任争光,张志勇,李丹,等.芽孢杆菌BJ-6产抗菌物质发酵条件初探[J].中国农学通报,2007,23(5):321-325.
[9]李春喜,姜丽娜,邵云,等.生物统计学[M].北京:科学出版社,2005:315-343.
[10]孔建.影响抗菌物质产生积累的主要因素[J].中国生物防治,2000,6(2):65-69.
