荷兰小黄瓜“欧宝1617”的组培快繁技术研究
2011-04-25张希太谢淑芹张彦波肖磊
张希太,谢淑芹,张彦波,肖磊
(邯郸市农业科学院生物技术中心,河北邯郸 056001)
“欧宝1617”是荷兰新近育成的雌性系(所开花均为雌性花,坐果率高)无刺水果型鲜食小黄瓜品种.植株生长旺盛,果实圆柱形,果肉厚,品质佳,表皮光滑、无刺,有光泽,果色绿,口味清香脆嫩,风味浓郁.果长12~15 cm,每节可坐2~3条瓜,瓜条生长迅速,产量高,耐贮运、耐高温,高抗病毒病和白粉病,抗疮痂病.适宜春夏季节种植.近年来,我国各地栽培面积不断增加,但所用种子几乎全部为国外进口,每粒种子在1元左右,价格昂贵,生产成本很高.通过组培快繁技术生产“欧宝1617”组培苗应用于生产是降低其种植成本的有效途径,关于黄瓜的组织培养技术已多有报道[1-6],但都是经愈伤组织途径的不定芽再生系统,遗传稳定性不能保证,不能应用于黄瓜优良种苗的快速繁殖.为此我们对“欧宝1617”小黄瓜的腋芽再生组织培养系统进行了研究.
1 材料与方法
1.1 试验材料
小黄瓜“欧宝1617”种子(从山东寿光蔬菜种子公司购买).
1.2 培养基
种子萌发培养基:MS0(不含任何激素的 MS),MS+GA3(0、1.0、2.0、3.0、4.0)mg/L;茎尖启动与继代培养基:MS+6-BA(0、0.5、1.0)mg/L+IBA(0、0.2、0.5、0.8、1.0)mg/L.
1.3 试验方法
培养基制备后,均经121℃,1.5大气压灭菌20min备用.在超净工作台上将“欧宝1617”种子,用0.1%的升汞(加入2滴吐温-20)灭菌10~15min,再用无菌水反复冲洗6~10遍,分别接种到以上5种种子萌发培养基上.每瓶接种30粒“欧宝1617”种子,每种培养基接种10瓶,置于25℃的培养室中培养.种子发芽前进行暗培养,种子发芽后每天进行2 000 lx的光照10 h.种子萌发阶段注意观察“欧宝1617”种子在各种培养基上的萌发情况,每隔2 d调查1次“欧宝1617”种子在各种培养基上的萌发率,并记录污染情况.将发芽后的“欧宝1617”种子苗在25℃,每天2 000 lx光照10 h条件下培养7 d后,在超净工作台上,用无菌的剪刀、镊子剪掉子叶,然后切取0.5 cm长的茎尖接种到以上15种组合的启动培养基上,每瓶接种1个茎尖,每种培养基接种10瓶.置于25℃每天进行2 000 lx光照10 h的条件下培养.观察记录“欧宝1617”种苗茎尖在各种培养基上的生长与分化情况,30 d后调查各种激素配比培养基上“欧宝1617”试管苗的株高、茎节数、生根情况等.将启动培养基上生长健壮的“欧宝1617”试管苗剪成单茎节段,分别接种到继代培养基组合上继代培养,将单茎节段斜插入培养基中,腋芽位于培养基表面,每瓶接3个茎段,每种培养基接种10瓶.在25℃每天2 000 lx光照10 h的条件下培养.观察记录“欧宝1617”茎段腋芽的萌发率和生长情况,30 d后调查“欧宝1617”试管苗的株高、茎节数、根长、根数等.
1.4 小黄瓜试管苗的移栽方法
将生根良好,生长健壮,茎长为2~3个节间的“欧宝1617”试管苗从试管中取出,用自来水洗净根部的残留培养基,移栽入营养钵中.移栽基质采用以下几种处理.①双层基质法,即在营养钵的底部装入2/3体积经消毒处理的肥沃的腐质土,上面1/3部分装入蛭石.②全部使用蛭石.③全部使用经消毒的腐质土,移栽后将基质用自来水浇透.放入温室中,初期用塑料膜罩住保湿,以后逐渐通风使“欧宝1617”试管苗慢慢适应外界环境,一般7~10 d后移去塑料膜,15 d后取样调查“欧宝1617”试管苗的成活率,新根生长情况,进行大田移栽.
2 试验结果与分析
2.1 不同培养基对“欧宝1617”种子萌发的影响

表1 “欧宝1617”种子在各种培养基上的萌发情况
由表1可见,由于“欧宝1617”小黄瓜种子的胚具有种皮的保护,在升汞中的灭菌时间可以相对长一些,因此其灭菌效果较好,接种后种子的污染率较低,几个处理均不超过10%.“欧宝1617”小黄瓜种子发芽相对容易,种子接种3 d后开始陆续发芽,种子的发芽率对赤霉素很敏感,从第4天的发芽率可以看出,随着培养基中赤霉素浓度的提高,小黄瓜种子的发芽率显著提高,7 d后小黄瓜种子几乎都能发芽.
2.2 不同培养基对“欧宝1617”茎尖生长分化的影响
“欧宝1617”小黄瓜种子苗的茎尖在只含有6-BA不含有IBA的MS培养基上,均不能成苗,但均能产生愈伤组织,出愈率为100%,且愈伤组织分化出不定芽率很低;在0.5mg/L 6-BA和IBA配合使用的培养基上“欧宝1617”小黄瓜种子苗的茎尖直接生长成苗率很低,茎基部产生愈伤组织率为100%,由于大块愈伤组织的存在使苗生根不良,生长缓慢,营养不良,30 d的生长量仅有2.3~2.6 cm,以后随着愈伤组织块的生长,苗子因营养不良而死亡.当1.0mg/L浓度的6-BA和IBA配合使用时,“欧宝1617”小黄瓜种子苗的茎尖均不能直接成苗,但基部均能产生愈伤组织,出愈率为100%,愈伤组织分化出不定芽率随6-BA浓度的提高而提高,其中以MS+6-BA1.0mg/L+IBA(0.5~1.0)mg/L分化不定芽率较高;在不含任何激素的MS0培养基上和只含IBA不含6-BA的MS培养基上“欧宝1617”小黄瓜种子苗的茎尖100%均能生长成苗且基部不产生愈伤组织,苗生根良好,茎生长健壮,随着IBA浓度的提高,“欧宝1617”小黄瓜试管苗的茎生长受到抑制,株高逐渐降低,茎节数也逐渐减少,生根的长度逐渐变短,生根数量减少.本试验浓度范围内,在MS+IBA(0.2~0.5)mg/L培养基上“欧宝1617”小黄瓜试管苗生长与生根最好(见表2).

表2 “欧宝1617”茎尖在不同培养基上的生长分化情况
2.3 不同培养基对“欧宝1617”单茎节段生长分化的影响
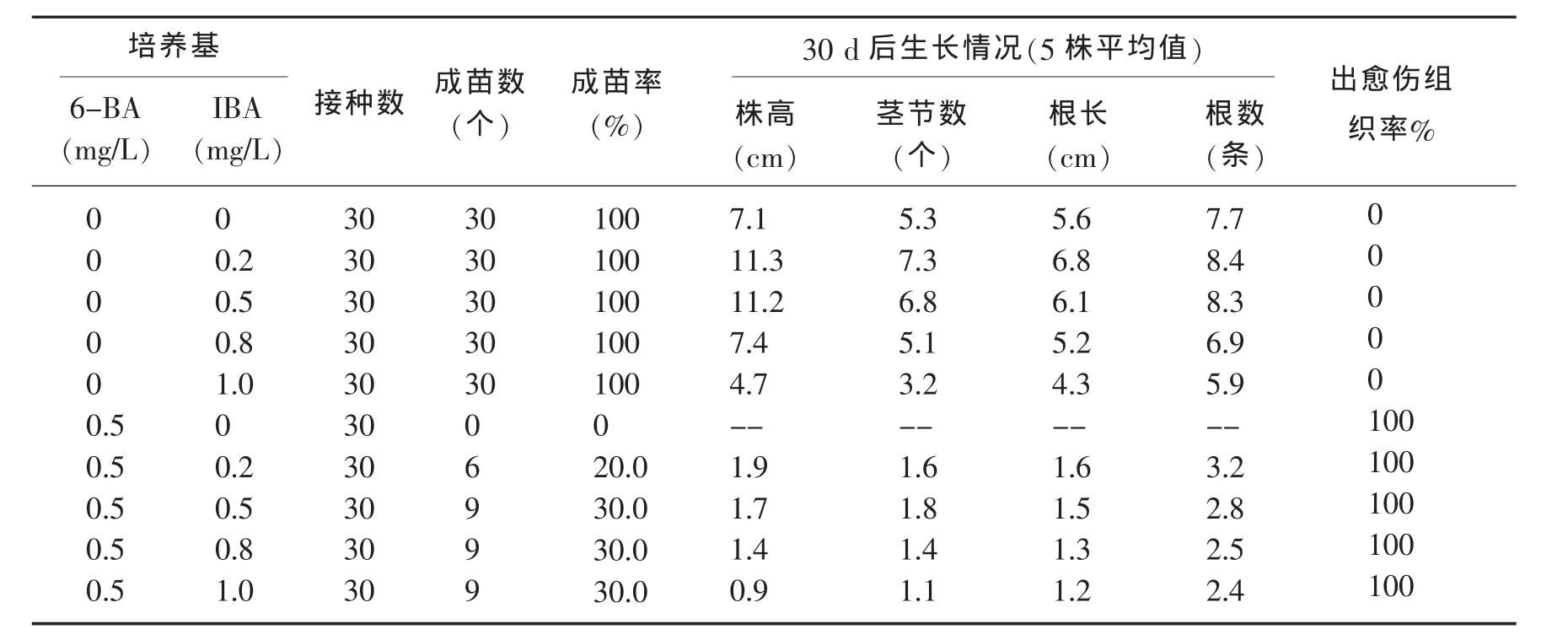
表3 “欧宝1617”单茎节段在不同培养基上的生长分化情况
表3数据显示,“欧宝1617”试管苗的单茎节段,在只含有6-BA的MS培养基上其腋芽都不能萌发成苗,而是全部愈伤组织化,形成的愈伤组织在原培养基上分化出少量不定芽;在含有0.5mg/L 6-BA和IBA的MS培养基上“欧宝1617”试管苗的单茎节段的腋芽萌发成苗率很低,长成的苗基部产生大块的愈伤组织而生根差使苗生长不良,愈伤组织在原培养基上能分化出少量不定芽;在不含有6-BA只含IBA各浓度处理的MS培养基上,“欧宝1617”小黄瓜试管苗基部不产生愈伤组织,苗生根良好,茎生长健壮,综合比较“欧宝1617”小黄瓜试管苗单茎节段再生植株在MS+IBA0mg/L~1.0mg/L各种培养基上的生长情况知,适合“欧宝1617”小黄瓜试管苗单茎节段继代增殖的IBA浓度范围为0.2~0.5mg/L,其中以MS+IBA0.2mg/L为最佳.
2.4 不同移栽基质对“欧宝1617”试管苗移栽成活率和生长的影响

表4 “欧宝1617”试管苗移栽后在不同基质中的成活率与新根生长情况
表4数据显示,在基质处理Ⅰ和基质处理Ⅱ上,“欧宝1617”试管苗移栽后的驯化成活率均高达98%,而在基质处理Ⅲ上,“欧宝1617”试管苗移栽后的驯化阶段出现大量的试管苗腐烂死亡现象,驯化成活率仅为67%.主要原因是基质处理Ⅲ为腐质土,杂菌含量较高,“欧宝1617”试管苗的根系直接栽入腐质土中,在驯化阶段由于湿度过大,诱生杂菌大量繁殖侵染幼嫩的试管苗造成腐烂.在基质处理Ⅰ和基质处理Ⅱ上,“欧宝1617”试管苗的根系栽入蛭石中,杂菌含量较少,蛭石基质不利于杂菌的生长,因此驯化成活率高.“欧宝1617”试管苗移栽后在基质处理Ⅰ和基质处理Ⅱ上新生根较多,新根生长较快,在基质处理Ⅲ上新生根数较少且生长缓慢.这是因为蛭石疏松通气性好,有利于“欧宝1617”试管苗的生根,而腐质土通气性差不利于“欧宝1617”试管苗的生根.从移栽后“欧宝1617”苗的生长状况来看,基质处理Ⅰ上的植株叶色鲜绿,生长健壮.基质处理Ⅱ上“欧宝1617”苗叶色黄,生长细弱.基质处理Ⅲ上“欧宝1617”苗生长一般.这是因为单纯的蛭石中缺乏植物生长的营养元素,所以基质处理Ⅱ上的“欧宝1617”苗生长较差.腐质土中虽然富含植物生长的营养元素,但其上“欧宝1617”苗的根系较差,所以生长一般.基质处理Ⅰ中,上层的蛭石有利于“欧宝1617”试管苗的驯化与生根,生出的新根又能扎入下层的腐质土中吸取营养,所以生长健壮.因此采用上层为蛭石下层为腐质土的双层基质最适合“欧宝1617”试管苗的驯化与生长.
3 小结与讨论
(1)“欧宝1617”小黄瓜种子苗的茎尖直接生长成完整的生根良好,茎生长健壮的试管植株的必要条件是培养基中不含有6-BA.培养基中补加适量的IBA对“欧宝1617”种子苗茎尖长成完整的试管植株有很好的促进作用,本试验浓度范围内,在MS+IBA(0.2~0.5)mg/L培养基上“欧宝1617”小黄瓜试管苗生长与生根最好.
(2)“欧宝1617”小黄瓜试管苗的单茎节段,在含有6-BA的MS培养基上其腋芽不能很好地萌发成苗,在MS0培养基上或只含适量IBA的MS培养基上其腋芽才能很好地萌发成苗,适合“欧宝1617”小黄瓜试管苗的单茎节段腋芽生长增殖的培养基为MS+IBA(0.2~0.5)mg/L.
(3)上层为1/3蛭石下层为2/3腐质土的双层基质最适合“欧宝1617”小黄瓜试管苗的驯化与生长.
(4)本试验为了保持“欧宝1617”小黄瓜试管苗的遗传稳定性,只对其顶芽和腋芽再生系统进行了研究.虽然一些试验处理诱导产生了愈伤组织且有不定芽的分化,但未进一步研究.
[1]李伟华,于树宏,王曼,等.黄瓜子叶外植体龄对子叶生根的影响[J].生物学杂志,1998,15(1):19-20,23.
[2]赵秀娟,吴定华.黄瓜的组织培养[J].华南农业大学学报,1998,19(4):125-126.
[3]钟华鑫,杜勒,周利民,等.黄瓜子叶有丝分裂与离体培养反应关系的研究[J].科学通报,1993,38(16):1506-1509.
[4]赵泓,刘凡,姚磊.简单快捷建立高频黄瓜子叶离体再生体系[J].生物技术,2000,10(2):10-12.
[5]侯爱菊,朱延明,杨爱馥,等.诱导黄瓜直接器官发生主要影响因素的研究[J].园艺学报,2003,30(1):58-60.
[6]汪祖程,何丹,许跃进.黄瓜子叶外植体组培成株研究[J].北方园艺,2008(6):187-189.
