白三叶叶蛋白提取及纯化工艺
2011-04-25吕宗友赵国琦苏衍菁邬彩霞王小山
吕宗友,赵国琦,苏衍菁,邬彩霞,陆 银,王小山
(扬州大学动物科学与技术学院,江苏 扬州 225009)
蛋白质缺乏是世界性的[1]。高等植物的叶片被认为是最有前途的蛋白质资源。植物蛋白因其廉价、资源丰富并能满足人类和家畜对蛋白质的需求,引起了人们极大的关注[2-3]。开发植物蛋白质资源成为食品业和饲料业一个亟待解决的问题。
叶蛋白又称绿色蛋白浓缩物(leaf protein concentration,LPC),是以新鲜牧草或其他青绿植物的生长组织(茎、叶)为原料,经打浆压榨后利用蛋白质等电点原理从其汁液中提取的高蛋白浓缩物[4]。白三叶(Trifoliumrepens)是一种豆科牧草,其青饲利用期长、粗蛋白质含量高、管理粗放、柔软细嫩,是重要的种植牧草和观赏草坪草[5-7]。目前,牧草中的苜蓿(Medicagosativa)[8]、聚合草(Symphytumperegrinum)[9]、串叶松香草(Silpniumperfoliatum)[10]、酸模(Rumexacetosa)[11]、黑麦草(Loliumperenne)[12]的叶蛋白开发均有报道,而白三叶叶蛋白的研究较少。本试验通过对白三叶叶蛋白提取和纯化条件的探讨,为其开发利用提供参考。
1 材料与方法
1.1材料 白三叶于2010年4月中旬采自扬州大学动物科技学院草业科学牧草标本区。
1.2仪器 SGL-300食品料理机(天津达康电器公司);101型电热鼓风干燥箱(上海市实验仪器总厂);凯式定氮仪(天津玻璃仪器厂),用于粗蛋白质的测定,按照张丽英[13]提供的方法进行;HSS-I(B)恒温浴槽(成都仪器厂);Sartorius酸度计[赛多利斯科学仪器(北京)有限公司];SHB循环水式多用真空泵(郑州长城科工贸有限公司)。
1.3试验步骤
1.3.1叶蛋白的提取步骤 均匀称取鲜样50 g,剪成1 cm左右的小段,按试验要求加入规定量的水,打浆4 min,用3层滤布压滤浆液,弃草渣,将滤液调节到规定的pH值后于水浴中快速加热至规定的温度,恒温不同的时间,得絮凝物,过滤得叶蛋白膏,65 ℃烘干得叶蛋白浓缩物成品(图1)。

图1 叶蛋白的提取步骤[1]
1.3.2叶蛋白提取单因素设计 分别以加热时间、加热温度、pH值、料液比和酸的种类(表1)作为影响白三叶叶蛋白提取率及沉淀率的因素,每个处理重复3次。
1.3.3叶蛋白提取的正交设计 在单因素试验的基础上,选4因素3水平作正交试验设计(表2)。由于料液比1∶5太浪费水,所以舍弃该比例。
1.4计算及分析 叶蛋白提取率及蛋白提取率计算,采用张垚等[4]的研究方法。采用SPSS 16.0和Excel分析处理数据。

表1 单因素设计

表2 正交试验设计
1.5叶蛋白的纯化 分别使用四氯化碳、甲醇、无水乙醇、蒸馏水、丙酮5种试剂以料液比为1∶3浸洗新鲜提取的叶蛋白粗提物3 h,3 000 r/min离心10 min,沉淀烘干后测定其纯化蛋白质含量。每个设计重复3次。
2 结果
2.1加热时间对提取率的影响 提取率随加热时间的延长而提高,但各处理间差异不显著(P>0.05)。当加热时间为9 min时,叶蛋白和蛋白提取率的增长均达到了最大,随着提取时间的延长,两项指标均下降然后保持恒定(图2)。

图2 加热时间对叶蛋白纯化和提取率的影响
2.2加热温度对提取率的影响 随着温度的升高,叶蛋白和蛋白的提取率和提取量逐渐增加,当提取的温度增加到90 ℃时,其提取率均达最大值,但差异不显著(P>0.05)。当温度继续升高时,叶蛋白和蛋白提取率下降(图3),但各温度之间差异不显著。

图3 加热温度对叶蛋白和蛋白提取率的影响
2.3pH值对提取率的影响 当pH值为4.0时,叶蛋白和蛋白提取率最大,差异均显著(P<0.05),之后随着pH值的升高,其提取率均减少;在pH值升高到6.5时,提取率均最小,随着pH值的进一步升高,提取率基本不变(图4)。
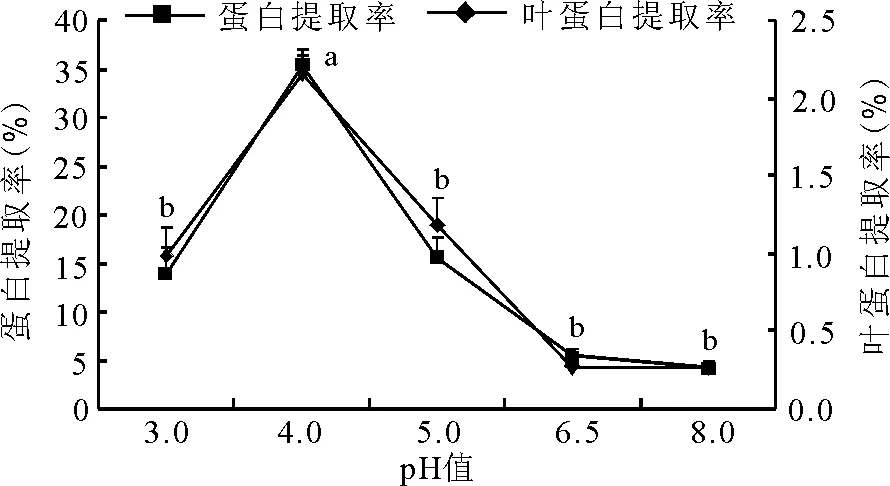
图4 pH值对叶蛋白和蛋白提取率的影响
2.4料液比对蛋白提取率的影响 料液比对叶蛋白和蛋白提取率的影响不大,差异不显著(P>0.05)。但当料液比为1∶5时,蛋白和叶蛋白提取率最大(图5)。
2.5酸的种类对蛋白提取率的影响 当试验中用硝酸调pH值时,叶蛋白和蛋白提取率均达最大值,但差异不显著(P>0.05)。醋酸和硫酸的提取效果最差(图6)。

图5 料液比对叶蛋白和蛋白提取率的影响

图6 酸对叶蛋白和蛋白提取率的影响
2.6正交设计试验 通过正交试验和极差分析可知:对于叶蛋白提取率来说,按照极差R的大小可得出影响主次因素为C>B>A>D,即pH值>温度>时间>料液比;对叶蛋白沉淀率来说,影响主次因素为C>A>B>D,即pH值>时间>温度>料液比(表3)。表中得出的最优结果是加热时间9 min,温度80 ℃,pH值4.0,料液比1∶2。经试验验证,当按照最优结果进行提取时,叶蛋白提取率可达2.44%,叶蛋白沉淀率可达38.94%,正交设计所得出的为最优工艺。
2.7不同纯化剂对叶蛋白纯化的影响 未使用纯化剂时,叶蛋白的纯度在50%左右。使用纯化剂时,叶蛋白纯度达到了70%左右。其中,纯化剂对叶蛋白纯度的影响依次为甲醇>乙醇>丙酮>四氯化碳>水,但各种纯化剂之间差异不显著(P>0.05)(图7)。

表3 正交试验设计结果
3 讨论
3.1单因素对白三叶叶蛋白提取率的影响 叶蛋白的提取方法有水溶液提取法、加热法、酸碱法、纯蛋白质沉淀法、盐析法、凝聚剂沉淀法、超滤法、电浓缩法、反胶团相转移法、有机溶剂沉淀法、发酵酸法等等。其中,直接加热法和酸化加热法是最常用的方法,两种方法的蛋白提取率均较高,成本均较低,适合大剂量叶蛋白的提取[14-15]。有研究[16]表明,酸化加热法能终止脱镁叶绿素的形成而避免动物食用后产生过敏反应,但该方法提取的叶蛋白絮凝物结构疏松,不易过滤分离,同时还加速不饱和脂肪酸的氧化,使胡萝卜素的损失增多。本试验在酸化加热时发现,低pH值适合蛋白质在等电点沉淀及加热钝化了蛋白酶活性,从而使叶蛋白的提取率最高。叶蛋白的提取率与酸的种类有关,盐酸沉淀的叶蛋白的量较硫酸,硝酸,醋酸大[17];高莉[14]的研究也表明,盐酸絮凝的情况下,马齿苋(Portulacaoleracea)的叶蛋白提取率及沉淀率均增大,这与本试验中硝酸能提高叶蛋白的提取率的结果不一致,可能与植物种类不同有关。
加热时间的长短影响叶蛋白的提取。试验中当加热时间小于9 min时,由于加热时间过短,蛋白质沉淀不完全,当加热时间大于9 min时,叶蛋白的沉淀不再增加,反而有减少的趋势,这与王桓[16]的研究结果一致。因为蛋白质的絮凝是一个需要能量的反应,随着加热时间的延长,沉淀所需的能量才能达到峰值,但当达到所需能量的峰值之后,对反应会造成负影响,使絮凝速度和絮凝的积累量都减少[4]。由于试验各种处理中得到的未纯化叶蛋白蛋白质含量基本一致,所以纯化蛋白提取率的趋势和叶蛋白也基本一致[4]。
温度的高低影响蛋白质的沉淀。本试验中当温度为90 ℃时,叶蛋白的提取率达到最大,当温度继续升高时,叶蛋白的提取率反而下降,这可能是温度升高杂质沉淀量增加而导致叶蛋白的提取率下降[12]。
蛋白质分子的电荷和溶解度可随环境的pH值的变化而变化。pH值较低时,碱性氨基酸的支链功能基及酸性氨基酸的羧基质子化,蛋白质带正电荷;pH值较高时,碱性与酸性功能基中的质子被移除,蛋白质带负电荷;在某一特定pH值时,蛋白质为电中性[8]。试验中当pH值为4.0时,叶蛋白提取量达最大值,此时叶蛋白的溶解度最小;当pH值接近中性时,大量的叶蛋白溶解,这与Dalev等[2]的研究结果一致。当pH值继续增加时,更大量的叶蛋白溶解[14]。
影响叶蛋白提取率的最主要原因是其叶蛋白能否提取完全。理论上,当料液比越大时,叶蛋白提取越完全,而适中的料液比能以最少的提取液获得最大的叶蛋白。本试验中当料液比小于1∶2时,叶蛋白未完全溶解,叶蛋白的提取率低;当料液比为1∶3时,叶蛋白提取率较高;之后随着料液比的增加,叶蛋白提取率不再增加。
3.2正交设计对叶蛋白提取的优化 本试验中正交设计影响的主次因素为C>B>A>D,即pH值>温度>时间>料液比。pH值在试验中占主要因素,这与吴峰华等[18]的研究结果一致。pH值在4.0时,叶蛋白质处在等电点,蛋白质分子以双极离子存在,总净电荷为零,颗粒无电荷间的排斥作用,易凝集成大颗粒,因而最不稳定,溶解度最小,易沉淀析出。当温度为80 ℃时,能迅速使最适温度分别为55 ℃及45 ℃的血红蛋白水解酶和羧肽酶钝化,降低了蛋白质的降解;当温度低于80 ℃时,由于温度太低,部分巯基蛋白酶的活性仍很高,导致蛋白质降解损失升高;当温度高于80 ℃时,蛋白质又被溶解,导致溶解损失。但张垚等[4]的研究结果表明,温度的影响较pH值的大,可能是因为植物种类不同,其组成蛋白质的氨基酸的酸碱性不同,受pH值的影响不同。
3.3叶蛋白的纯化 叶蛋白中含脂化合物、叶绿素以及类胡萝卜素等植物色素和导致叶蛋白有不良风味和颜色的多酚类物质,烘干后发黑,影响了其利用。有机溶剂可除去这些化合物[19],且纯化剂的使用能提高叶蛋白的纯度近20%,粗制得到的叶蛋白呈墨绿色,经过不同纯化剂的纯化后,产品色泽变浅,青草味消失,叶蛋白的蛋白质含量明显提高[20]。本试验的纯化剂为醇类物质时纯化效果最好。黄威[21]也认为醇类的浓度越高,蛋白质的含量也越高,醇提法可除掉类脂化合物、叶绿素以及类胡萝卜等植物色素和多酚化合物。水的效果最差,是因为叶绿素类物质不溶于水。
4 结论
白三叶叶蛋白单因素提取的最佳参数为加热时间9 min,温度90 ℃,pH值4.0,料液比1∶2,沉淀的酸为硝酸。通过正交试验设计可知叶蛋白提取的最佳工艺为加热时间为9 min,温度为80 ℃,pH值为4.0,料液比为1∶2。纯化叶蛋白的最佳试剂是甲醇,以料液比1∶3纯化叶蛋白粗提取物最有效。
[1]Ghaly A E,Alkoaik F N.Extraction of protein from common plant leaves for use as human food[J].American Journal of Applied Sciences,2010,7(3):323-334.
[2]Dalev P,Ljubomirova A,Ivanov I.Enzyme extraction, functional properties and application of leaf protein fractions of nettle[J].Biotechnology Letters,1996,18(1):107-110.
[3]Yust M M,Pedroche J,Megías C,etal.Improvement of protein extraction from sunflower meal by hydrolysis with alcalase[J].Grasasy aceites,2003,54(4):419-423.
[4]张垚,白志明,董宽虎,等.苜蓿鲜草提取叶蛋白最适条件的研究[J].中国草地学报,2007,29(6):69-72.
[5]梁哲,姜三杰,未丽,等.三叶草基因工程研究进展[J].草业学报,2009,18(2):205-211.
[6]张婧源,彭燕,罗燕,等. 不同产地白三叶种质遗传多样性的SRAP分析[J].草业学报,2010,19(5):130-138.
[7]王友生,王瑛,李阳春.三叶草愈伤组织诱导及分化的研究[J].草业学报,2009,18(2):212-215.
[8]韩鲁佳,阎巧娟,李道娥,等.苜蓿叶蛋白提取工艺条件对蛋白质含量的影响[J].中国农业大学学报,1997,2(6):92-95.
[9]李凤玲,何金环.聚合草鲜草叶蛋白提取条件研究[J].中国草地学报,2009,31(2):76-80.
[10]姚爱兴,崔慰贤,王玲.串叶松香草和紫花苜蓿叶蛋白提取技术研究[J].中国饲料,2000(3):33.
[11]韩丽琴,刘建华,董顺福.鲁梅克斯叶蛋白提取的研究[J].吉林医药学院学报,2007,28(1):20-21.
[12]杨超英,刘艳,薛正莲,等.黑麦草叶蛋白提取工艺研究[J].中国农学通报,2007,23(5):14-17.
[13]张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2002:52-53.
[14]高莉,刘捷,张平,等.从马齿苋中提取叶蛋白工艺的研究[J].食品与机械,2007,23(1):90-92.
[15]杨林.新疆紫花苜蓿叶蛋白的提取及应用研究[D].乌鲁木齐:新疆大学,2008:16-18.
[16]王桓.四翅滨藜叶蛋白的提取及物性学研究[D].乌鲁木齐:新疆大学,2009:34-35.
[17]Fernández S S,Padilla A P,Mucciarelli S.Protein extraction fromAtriplexlampaleaves:potential use as forage for animals used for human diets[J].Plant Foods for Human Nutrition (Formerly Qualitas Plantarum),1999,54(3):251-259.
[18]吴峰华,杨虎清,何志平.豆腐柴叶蛋白提取工艺研究[J].食品工业科技,2010(2):240-241.
[19]杨春波.苜蓿叶蛋白的提取与应用研究[D].无锡:江南大学,2007:14-17.
[20]田丽萍,李宪刚,张静,等.乙醇纯化苜蓿叶蛋白效果初探[J].安徽农学通报,2007,13(5):38-39.
[21]黄威.南瓜叶蛋白加工方法及其制品的安全性评价研究[D].重庆:西南大学,2010:17-21.
