水杨酸浸种对高羊茅在干旱胁迫下萌发的影响
2011-04-25赵春旭刘芳芳刘照辉
赵春旭,刘芳芳,赵 韦,刘 欣,柴 琦,刘照辉
(兰州大学草地农业科技学院 农业部草地农业生态系统学重点开放实验室,甘肃 兰州 730020)
随着我国国民经济的快速发展,人们对城市绿化、生活环境有了更高的要求,对休闲运动、户外旅游等的需求量也在加大,而在这些项目中,草坪扮演着重要的角色。草坪的种植通常有两种方法:种子繁殖和营养繁殖。而在北方,大多数冷季型草坪草采用的是种子繁殖[1]。对于种子繁殖,其成坪后的草坪质量很大程度上取决于草坪种子的选取和草坪种子的萌发[2]。然而,我国西北地区属于温带大陆性气候,昼夜温差大,降水量少但蒸发量很大,水资源十分缺乏。因此,在西北地区建植草坪,干旱成了制约因素之一。萌发阶段,种子及幼苗十分脆弱,在干旱胁迫下,萌发受到严重影响导致草坪应用受到很大限制[3],进而影响草坪的成坪质量,造成经济损失。为了避免类似情况的发生,在播种前,对种子进行适当处理,可以节约成本,减少经济损失,加快成坪速度和提高成坪质量。
水杨酸(邻羟基苯甲酸)是一种简单的酚类化合物。许多试验证明水杨酸是重要的能够激活植物过敏反应和系统获得抗性的内源信号分子[4]。近些年来,有关水杨酸提高植物抗逆性的试验很多[5-10],水杨酸在植物抗逆性中所起的作用也越来越被人们所重视。但是,有关水杨酸浸种对草坪草在逆境条件下萌发影响的研究较少,而干旱胁迫又是在北方地区尤其是西北地区影响草坪草萌发的主要因素之一。
高羊茅(Festucaarundinacea)是禾本科羊茅属多年生草本植物。在美国,高羊茅是应用最为广泛的冷季型草[11]。目前,在我国已建植的大面积的高羊茅草坪,不仅用于公园、机关和住宅的绿化,也用于较高质量的运动场,是我国目前使用量增长最快的草种[12]。作为草坪草,高羊茅具有抗旱性强、耐践踏、耐粗放管理、耐盐碱和成坪速度快等特性,是我国北方重要的草坪草种。因此,通过PEG-6000溶液模拟干旱胁迫条件,研究6种不同浓度水杨酸对草坪草种在干旱条件下萌发的影响,寻找能够提高高羊茅萌发时期抗旱性的最佳浓度,为在干旱地区直播草坪提供理论和生产依据具有重要意义。
1 材料与方法
1.1试验材料 试验采用3个高羊茅常用品种为材料,分别是:盆景2000、猎狗5号、红宝石,种子由兰州绿景源草坪绿化工程有限公司提供。试验前,选择成熟、饱满且大小适中、均匀一致的种子作为萌发试验材料。PEG-6000由天津光复精细化工研究所提供。水杨酸由天津化学试剂三厂提供。
1.2试验方法 种子发芽试验参照国家标准[13],采用纸上发芽(TP)方法[14],将种子置于直径为9 cm的培养皿中进行培养。试验开始前,将种子用10 g/L的HgCl2溶液浸种15 min进行消毒[15]。
1.2.1浸种处理 用6个不同浓度水杨酸溶液在25 ℃下进行浸种处理,溶液浓度分别为0.12、0.25、0.50、1.00、2.00、3.00 mmol/L,以蒸馏水浸种为对照(CK),浸种时间均为24 h。浸种后,用蒸馏水冲洗3次备用。
1.2.2干旱胁迫萌发试验 萌发试验采用PEG-6000作为干旱胁迫的渗透调节剂,模拟土壤干旱胁迫条件。模拟干旱胁迫采用的PEG-6000溶液浓度为25%,其相对应的胁迫强度为-0.9 MPa[16]。PEG溶液的配制按照Michel和Kaufmann[17]的方法配制。用配制好的等量PEG-6000溶液浸透培养皿里的2层滤纸,然后放入经过处理的种子,每培养皿100粒,每处理3次重复。人工智能气候培养箱的光照强度为5 500 lx,湿度50%,温度25 ℃[15]。每天向滤纸中加等量PEG-6000溶液,每4 d换1次滤纸,以尽量减少水势变动。每天记录发芽种子的数量。
1.2.3测定项目与方法 参照国家标准,高羊茅在第7天、第14天分别统计发芽势、发芽率,发芽试验的最后一天,测量胚芽长和胚根长[13]。
1.3数据分析 所有数据均用Microsoft Excel录入,采用SPSS 15.0 统计分析软件进行差异显著性分析。其中发芽势和发芽率的数据均采用反正弦转换后再进行数据统计分析。
2 结果与分析
2.1不同浓度水杨酸浸种对高羊茅在模拟干旱胁迫下萌发的影响 不同浓度水杨酸浸种处理对高羊茅3个品种在PEG模拟干旱胁迫下的种子萌发均有一定影响(表1)。盆景2000在模拟干旱条件下,0.12~1.00 mmol/L水杨酸浓度处理相比对照提高或显著(P<0.05)提高了种子的发芽势和发芽率,其中以0.50 mmol/L浓度处理效果最好,发芽势和发芽率分别比对照(34.0%、60.7%)高26.3和22.6百分点;而高浓度的2.00、3.00 mmol/L水杨酸处理对盆景2000种子的萌发有抑制作用,其中3.00 mmol/L有显著抑制(P<0.05)。猎狗5号在模拟干旱条件下,0.12~2.00 mmol/L水杨酸浓度处理相比对照均提高或显著提高了种子的发芽率和发芽势,仍以0.50 mmol/L浓度处理效果最好,发芽势和发芽率分别比对照(12.7%、57.0%)高30.6和22.0百分点;其中3.00 mmol/L对种子发芽率有显著抑制(P<0.05)。红宝石在模拟干旱下,0.12~1.00 mmol/L浓度处理比对照提高或显著(P<0.05)提高了种子的发芽势和发芽率,发芽势最高的处理浓度为0.50 mmol/L,比对照(18.0%)高9.3百分点;发芽率最高的处理浓度为0.25 mmol/L,比对照(57.3%)高23.4百分点;其中2.00、3.00 mmol/L浓度处理相比对照抑制或显著抑制(P<0.05)了种子的萌发(表1)。
试验结果表明,高羊茅3个品种,除红宝石的发芽率在0.25 mmol/L浓度处理下呈现最高以外,其他在水杨酸0.12、0.25、0.50 mmol/L浓度浸种后,发芽势和发芽率均随着水杨酸浓度的增大而提高,而在1.00、2.00、3.00 mmol/L浓度浸种后,发芽势和发芽率随水杨酸浓度增大呈逐渐下降趋势,高浓度2.00、3.00 mmol/L水杨酸浸种处理反而对高羊茅种子的萌发产生了抑制作用,其中3.00 mmol/L相比对照呈显著抑制作用(P<0.05)。因此,在干旱条件下,低浓度水杨酸处理能促进种子萌发,尤以0.50 mmol/L效果好。
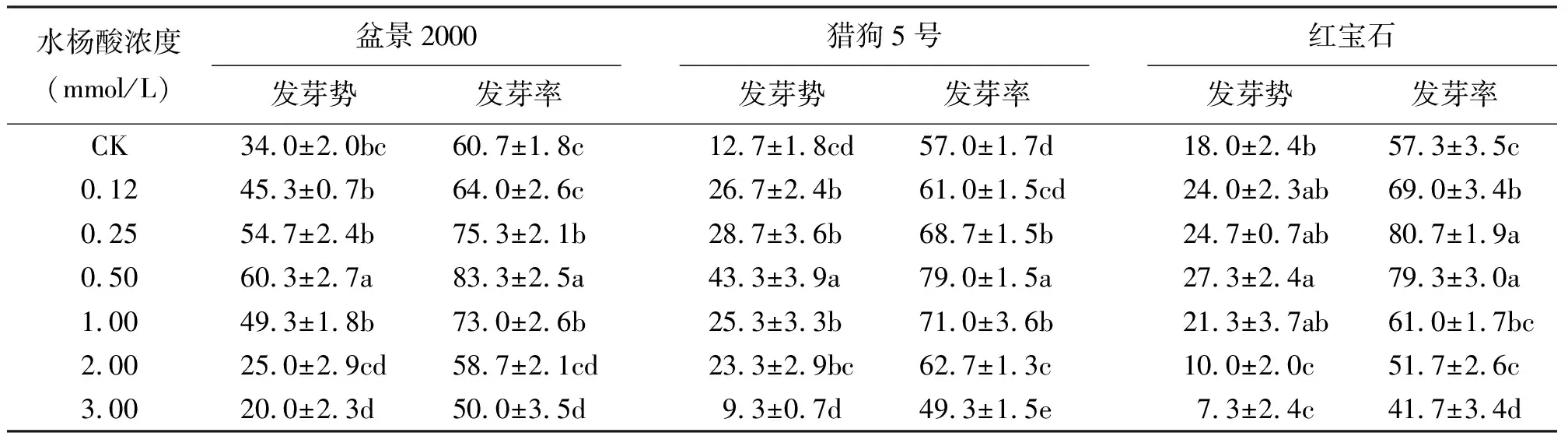
表1 不同浓度水杨酸浸种对高羊茅在模拟干旱胁迫下萌发的影响 %
2.2不同浓度水杨酸浸种对高羊茅在模拟干旱胁迫下胚芽的影响 高羊茅3个品种在干旱胁迫条件下,水杨酸0.12~1.00 mmol/L浓度处理,胚芽长度均高于对照,其中0.25、0.50、1.00 mmol/L 3个浓度处理显著高于对照(P<0.05),所有处理当中0.50 mmol/L浓度处理效果最好(表2)。水杨酸2.00 mmol/L浓度处理下,盆景2000胚芽长低于对照,但差异不显著(P>0.05)。水杨酸3.00 mmol/L浓度处理均显著抑制了胚芽的生长(P<0.05),胚芽长度显著低于对照(P<0.05)。由此可见,在干旱胁迫条件下,低浓度水杨酸处理促进胚芽生长,高浓度水杨酸处理对幼苗的生长产生了抑制作用。

表2 不同浓度水杨酸浸种对高羊茅在模拟干旱胁迫下胚芽长的影响 cm
2.3不同浓度水杨酸浸种对高羊茅在模拟干旱胁迫下胚根的影响 由表3可以看出,在模拟干旱胁迫条件下,0.12~1.00 mmol/L水杨酸浓度处理比对照均能促进胚根的生长,其中0.25、0.50和1.00 mmol/L 3个浓度处理下的胚根长度显著高于对照(P<0.05)。3个品种在干旱条件下促进胚根生长的最佳浓度分别是:盆景2000和猎狗5号均为0.50 mmol/L,但盆景2000与1.00 mmol/L处理差异不显著(P>0.05);红宝石为1.00 mmol/L,与0.50 mmol/L浓度处理差异不显著(P>0.05)。高浓度水杨酸处理也同样呈现出抑制作用,3.00 mmol/L处理的胚根长度均显著低于对照(P<0.05)。因此,不同浓度水杨酸浸种对高羊茅在模拟干旱胁迫下胚根的生长有一定影响,综合分析,其中0.50 mmol/L浓度处理效果最好,能显著促进高羊茅在干旱胁迫条件下根的生长(P<0.05),有利于幼苗根系深扎,提高抗旱性。
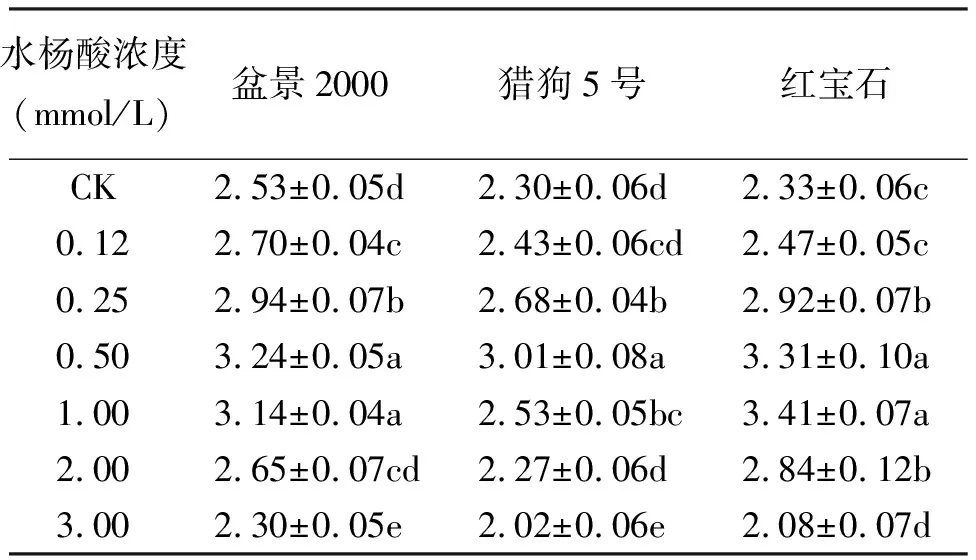
表3 不同浓度水杨酸浸种对高羊茅在模拟干旱胁迫下胚根长的影响 cm
3 讨论
水杨酸是中等脂溶性的酚类化合物,可以在细胞膜的疏水区积累,从而影响与膜相关的一系列生理生化反应[18]。池春玉等[19]研究认为,通过水杨酸浸种可以增加细胞中脯氨酸的含量,丙二醛含量增幅减小,膜脂过氧化程度降低,减弱了对细胞膜的伤害。本研究,在PEG模拟干旱条件下,高羊茅3个品种的萌发指标均随着水杨酸处理浓度的增大先呈现出逐渐增高,后下降并且抑制的趋势。在适宜浓度水杨酸处理下能提高高羊茅种子萌发期的抗旱性,缓解干旱胁迫产生的影响,然而在高浓度水杨酸处理下,反倒产生了抑制作用。
综合本研究结论,低浓度0.12~1.00 mmol/L水杨酸处理能促进了高羊茅种子在模拟干旱胁迫下的萌发,这与何亚丽等[20]的研究结果类似。朱伟等[21]通过对抗虫棉(Gossypiumspp.)种子的研究也认为低浓度水杨酸处理能提高发芽势和发芽率。0.25和0.50 mmol/L的水杨酸显著提高了高羊茅种子在干旱条件下的发芽势、发芽率(P<0.05),从而提高种子的利用率,节约建坪成本。其中,以水杨酸浓度为0.50 mmol/L的处理效果最好,这与崔玮等[22]、杨江山等[23]的研究结果部分一致。并且低浓度水杨酸处理有利于胚芽生长,促进了根系深扎,提高了高羊茅幼苗期的抗旱能力。王晓多等[24]的研究也得出相似结论。许耀照等[25]研究结果表明,通过不同温度和不同浓度水杨酸处理,黄瓜(Cucumissativus)的根系具有显著差异,水杨酸具有促进黄瓜种子生根的作用。高夕全等[26]认为,适宜浓度的水杨酸可以诱导硝酸还原酶的活性,同时显著提高幼苗的内源细胞分裂素和生长素水平,降低脱落酸水平,从而促进根系的生长发育,因此,水杨酸具有促根壮苗的作用。有关生理机制方面的研究中,黄清泉等[7]研究水杨酸对水分胁迫下黄瓜叶片生理机制的影响得出,适量外源水杨酸与水杨酸结合蛋白(SABP)即过氧化氢酶结合,抑制过氧化氢酶和抗坏血酸过氧化物酶活性使H2O2含量上升,一方面引起轻度氧化胁迫诱导增强幼苗的抗氧化能力,另一方面降低光合色素破坏程度和缓解了暗反应相关酶类的降解,从而提高植株对水分胁迫的抗性。孙艳和王鹏[27]研究表明水杨酸是植物在胁迫反应后的信号分子,可在细胞膜的疏水区积累,影响与膜有关的一系列生理生化反应。王晓多等[24]通过对豌豆(Pisumsatium)进行水杨酸浸种试验得出,一定浓度水杨酸处理能降低幼苗电导率,有利于膜破损后的修复,并且有利于促进豌豆种子的呼吸,从而提高萌动种子呼吸释放能量,供给幼苗生长。同时,水杨酸预浸种能提高在水分胁迫下幼苗超氧化物歧化酶、过氧化物酶等保护酶的活性,从而使清除活性氧的能力增强,减轻质膜过氧化的损伤;研究结果还表明水杨酸预处理极显著地增加了幼苗叶绿素含量[28]。高羊茅经水杨酸诱导之后可以提高抗性,表明高羊茅体内可能存在有效的水杨酸信号感知和传导机制[29],这方面有待更进一步研究。
高浓度的水杨酸处理(2.00、3.00 mmol/L)则抑制了种子的萌发,3.00 mmol/L处理均达到显著抑制(P<0.05)水平,说明水杨酸溶液浓度过高,渗透胁迫严重,反倒对萌发前的种子产生了破坏作用,影响了种子吸水和一些酶的活性,导致高羊茅种子在模拟干旱胁迫下发芽势、发芽率低,幼苗生长缓慢。这与朱伟等[21]的研究结果一致。穆瑞霞等[30]采用水杨酸浸种预处理大葱(Alliumfistulosum)种子,结果也表明高浓度则抑制发芽率和发芽势。种培芳和杨江山[31]通过对甜瓜(C.melo)幼苗的研究认为高浓度的水杨酸处理能极显著提高脯氨酸的含量,但甜瓜幼苗中叶绿素含量逐渐降低,相对电导率增加,丙二醛含量的积累等说明更高浓度的水杨酸所产生的保护性应激反应趋于极限,逐渐失去了保护作用。由于植物的种类不同,水杨酸的浓度、处理方式及作用时间的不同,有可能对种子萌发产生的影响不同,具体原因还有待于进一步研究。因此,对于提高不同草坪草抗旱性的水杨酸有效浓度与最佳浓度应该作详细具体的研究,才能更好的为节约草坪建坪成本、提高草坪建坪质量服务。
[1]孙吉雄.草坪学[M].第二版.北京:中国农业出版社,2003:159.
[2]王锡信.兰州地区草坪建植与管护技术[J].草业科学,2003,20(6):56-58.
[3]徐胜,李建龙,赵德华.高羊茅的生理生态及其生化特性研究进展[J].草业学报,2004,13(1):58-64.
[4]Malamy J,Carr J P,Klessig D F,etal.Salicylic acid:a likely endogenous signal in the resistance response of tobacco to viral infection[J].Science,1990,250:1002-1004.
[5]张士功,高吉寅,宋景芝.水杨酸和阿斯匹林对盐胁迫下小麦种子萌发的作用[J].植物生理学通讯,1999,35(1):29-32.
[6]曹翠玲,刘林丽,田强兵.水杨酸对玉米幼苗抗旱性的影响[J].玉米科学,2004,12(增刊):103-104.
[7]黄清泉,孙歆,张年辉,等.水杨酸对水分胁迫黄瓜幼苗叶片生理过程的影响[J].西北植物学报,2004,24(12):2202-2207.
[8]黄爱霞,佘小平.水杨酸对黄瓜幼苗抗冷性的影响[J].陕西师范大学学报(自然科学版),2003,31(3):107-109.
[9]Dat J F,Lopez-Delgado H,Foye C H,etal.Parallel change in H2O2and catalase during thermotolerance induced by salicylic acid or heat acclimation in musturd seedlings[J].Plant Physiology,1998,116:1352-1357.
[10]王利军,李家永,战吉成.水杨酸对受高温胁迫的葡萄幼苗光合作用和同化物分配的影响[J].植物生理学通讯,2003,39(3):215-216.
[11]Funk C R,Wiley W K,King D E,etal.Registration of mustang tall fescue [J].Crop Science,1984,24:1211.
[12]余高镜,林奇田,柯庆明,等.草坪型高羊茅的研究进展与展望[J].草业科学,2005,22(7):77-81.
[13]王彦荣,孙建华,余玲,等.GB/T 2930.1-2930.11-2001 牧草种子检验规程[S].北京:中国标准出版社,2001:31-48.
[14]张海宁,张建利,冯林,等.温度和干旱胁迫对3种牧草种子萌发的影响[J].草业科学,2009,26(8):87-92.
[15]张晨妮,周青平,颜红波,等.PEG-6000对老芒麦种质材料萌发期抗旱性影响的研究[J].草业科学,2010,27(1):119-123.
[16]梁国岭,周青平,颜红波.聚乙二醇对羊茅属4种植物种子萌发特性的影响研究[J].草业科学,2007,24(6):50-54.
[17]Michel B E,Kaufmann M R.The Osmotic potential of polythylene glycol-6000[J].Plant Physiology,1973,56:914-916.
[18]杨玲,胡燕月,袁月星,等.水杨酸浸种对水稻种子萌发的影响与水杨酸浓度和萌发温度的相关性[J].浙江师大学报(自然科学版),2001,24(2):187-190.
[19]池春玉,连永权,赵岩,等.水杨酸浸种对紫羊茅抗冷性的影响[J].中国农学通报,2009,25(14):186-189.
[20]何亚丽,刘友良,陈权,等.水杨酸和热锻炼诱导的高羊茅幼苗的耐热性与抗氧化的关系[J].植物生理与分子生物学学报,2002,28(2):89-95.
[21]朱伟,李聪,马斌强,等.水杨酸浸种对抗虫棉种子萌发的影响[J].江西农业学报,2010,22(3):34-36.
[22]崔玮,张芬琴,马嘉琦,等.水杨酸浸种对高羊茅种子萌发的影响[J].四川草原,2005(8):24-26.
[23]杨江山,种培芳,费赟.水杨酸对甜瓜种子萌发及其生理特性的影响[J].甘肃农业大学学报,2005,40(1):38-41.
[24]王晓多,陆远柱,杨九英.水杨酸浸种对豌豆种子萌发及幼苗生长的影响[J].种子,2007,26(8):42-44.
[25]许耀照,郁继华,张国斌,等.水杨酸对黄瓜种子萌发的高温耐性诱导[J].甘肃农业大学学报,2004,39(3):290-294.
[26]高夕全,刘爱荣,叶梅荣,等.水杨酸对水稻幼苗硝酸还原酶和根系生长的影响[J].安徽农业技术师范学院学报,2000,14(1):13-15.
[27]孙艳,王鹏.水杨酸对黄瓜幼苗抗高温胁迫能力的影响[J].西北植物学报,2003,23(11):2011-2013.
[28]束良佐,李爽.水杨酸浸种对水分胁迫下玉米幼苗某些生理过程的影响[J].南京农业大学学报,2002,25(3):9-11.
[29]古燕翔,王代军.外源诱导物水杨酸对草坪型高羊茅弯孢霉叶斑病抗性影响的研究[J].中国草地,2003,25(4):56-60.
[30]穆瑞霞,阮云飞,王吉庆,等.不同浓度水杨酸浸种对大葱种子萌发及生理特性的影响[J].中国农学通报,2008,24(6):370-373.
[31]种培芳,杨江山.水杨酸对水分胁迫下甜瓜幼苗生理特性的影响[J].甘肃农业大学学报,2006,41(3):44-47.
