彩钼铅矿清洁提取工艺研究
2011-04-24石建兵
董 坚,石建兵,董 萌
(辽宁沈宏集团股份有限公司,辽宁大连116013)
彩钼铅矿,化学式 PbMoO4,纯钼酸铅含Mo 26.1%,是辉钼矿和钼酸钙之外最具工业价值的钼矿物。由于钼在冶金、化工各领域越来越广泛地应用以及辉钼矿资源的日渐减少,针对彩钼铅矿开发和提取技术的研究也越来越多。
彩钼铅矿产自钼矿床、铅锌矿床或铅、铁矿床的氧化带,一般为中小矿床,因含杂质呈现不同的色彩而得名,我国湖南和云南有比较集中的彩钼铅矿资源。彩钼铅矿不具可浮性与磁性,只能由重选得到含钼量较低的彩钼铅精矿,因而很难采用火法冶炼工艺,多采用湿法提取工艺。
湿法提取过程中使用大量的酸、碱、盐,会产生废气、废水和废渣,容易造成气相、液相和固相的多种污染,其中的硫化氢和重金属对环境危害极大,是湿法清洁提取工艺的研究重点。
钼酸铅PbMoO4属离子型化合物,很多酸、碱、盐如HNO3、HCl、NaOH、KOH、NaS和NaCO3等都能将其溶解,有较好的浸出效果。为了提高铅钼分离、金属回收、节约资源和能源及防止污染的综合效益,需要研究、选择和组合,以实现清洁生产。
根据联合国环境规化署的定义,清洁生产是指将综合预防的环境策略持续应用于生产过程和产品中,以便减少人类和环境的风险性。对生产过程而言,包括节约原料和能源,淘汰有毒原材料并在全部排放物和废物离开生产过程之前减少它的数量和毒性;对产品而言,清洁生产策略旨在减少产品在整个生产周期(包括从原料提炼到产品的终极处置)中对人类和环境的影响。
概括地说就是:低消耗、低污染、高产出,实现经济效益、社会效益与环境效益的统一。
清洁生产是一种理念,也是一种工艺过程和生产组织形式。它并不总是新技术的发明,更多是以一、二种新技术为核心对多种已有工艺的正确筛选与组合。
本文叙述的试验和研究,始终努力遵循了这一中心思想。
1 浸出和铅钼分离工艺的试验选择
1.1 浸出体系的选择
理论上,各种酸、碱和许多盐都能打破PbMoO4的弱离子键,用作彩钼铅矿的浸出剂都可得到较好的浸出效果。在工艺上主要是按固液分离、铅钼分离和防止污染作为选择的理由。
1.1.1 3种浸出剂的初步试验
对NaOH、Na2CO3、Na2S的浸出过程进行比较时,主要考察固液分离和铅钼分离的效果。
含钼10.24%的彩钼铅矿各100 g,磨至-180目,分别以NaOH 10g、Na2CO315g、Na2S 15 g,配成250 mL溶液在烧杯中隔水加热浸出8 h,按溶液计算一次浸出率,静止2 h沉淀后,观察固液分离情况见表1。
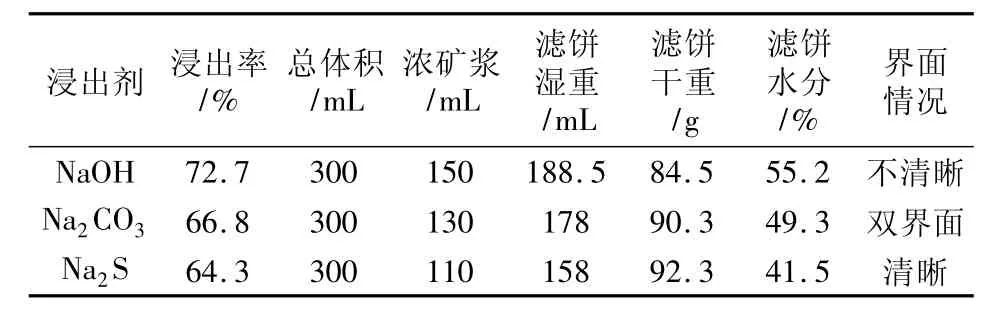
表1 浸出率与固液分离情况记录
兼顾浸出率、固液分离、铅钼分离、铅回收和防止铅污染,应综合NaOH与Na2S的优点,组成新的复碱(NaOH-Na2S)浸出体系。
1.1.2 NaOH-Na2S浸出体系模拟逆流浸出的试验
固液比(g/mL)设定为30%,根据对每次浸出量的假设,第1次浸出用计算浓度的50%,第2次浸出用计算浓度的75%,第3次浸出用计算浓度,浸出时间每次2 h,3次浸出结果为:渣干重为矿量的70%,含钼0.12%,含铅51%,钼浸出率99.18%;铅回收率83%,基本达到了试验目的,体现了NaOH-Na2S浸出体系在浸出率、铅钼分离和铅回收的综合优势。但模拟的操作条件仍难以符合逆流浸出工艺的实际情况,加热、搅拌等操作条件也达不到生产条件,决定在2~3 kg(矿)的规模上作更接近生产条件的中间试验。
1.2 中间试验
中间试验采用不锈钢桶、机械搅拌、电热控温、保持液面等措施,力求贴近蒸气加温逆流浸出的工艺条件。共进行了2种矿(花桓和云南)8批共21次浸出,每批投入-180目彩钼铅矿2 kg,浸出液6 L。
1.2.1 原矿分析
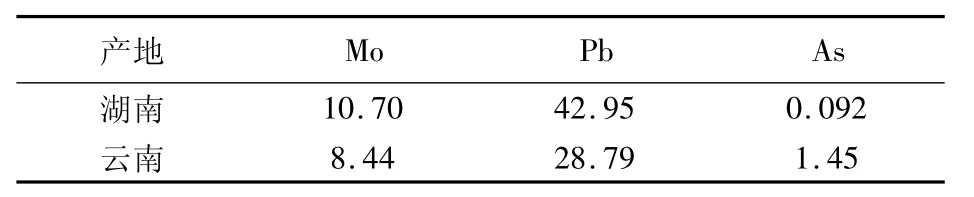
表2 彩钼铅矿主要成分检验结果 %
1.2.2 条件和结果
8批彩钼铅矿21次浸出的条件和结果见表3。
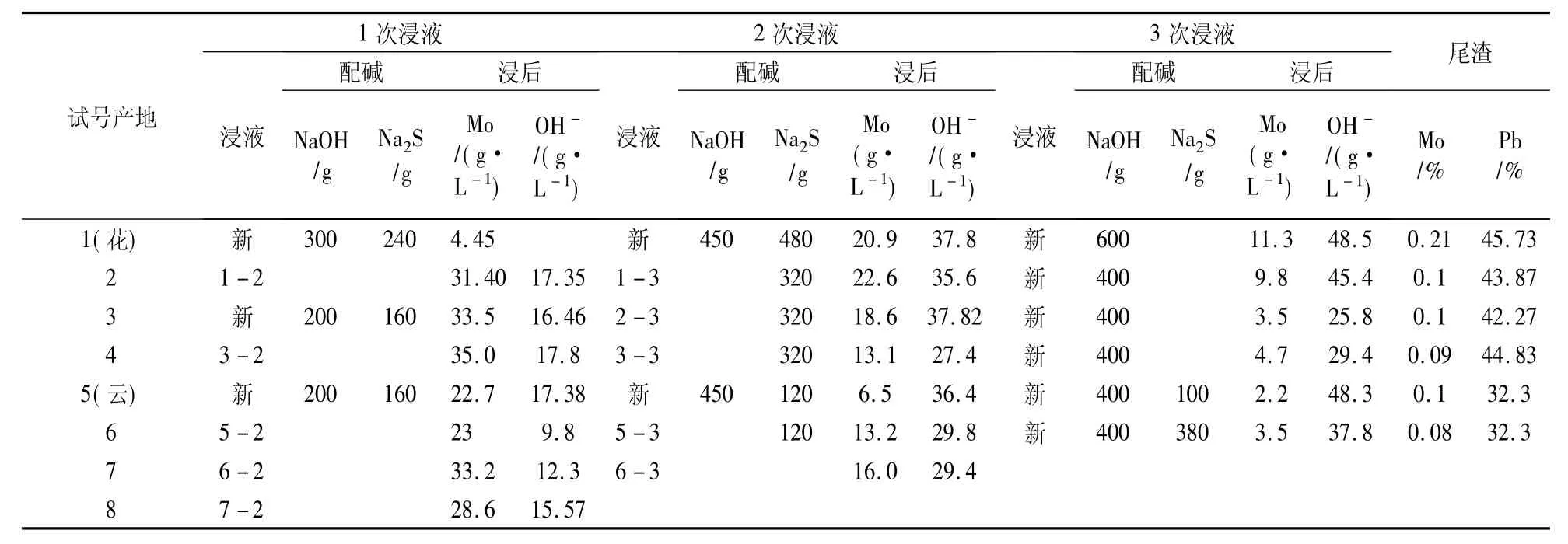
表3 复碱逆流浸出彩钼铅矿中间试验的条件和结果
1.2.3 结果分析
试验充分体现出逆流浸出的优点,最终浸出液Mo浓度最大(4-1)35.0 g/L、(7-1)33.2g/L,游离碱浓度最小(4-1)和(7-1)。
浸渣残留钼(除1号外)均≤0.1%;按渣量70%计算,浸出率99.35%;实现了高浸出率(99%以上)和较低的酸碱消耗。
1.3 试生产的验证
按照中间试验所得条件,对4.5 t彩钼铅矿分3批进行了工业浸出试验。
1.3.1 工艺条件
4.5 t原矿,含 Mo 9.14%、Pb 35.87%、As 0.77%,金属量Mo 411 kg、Pb 1 611 kg;
浸出罐φ3.0 m,h 2.8 m,初始液量4.5 m3配入NaOH 60kg,Na2S 12 kg;
机械搅拌,蒸汽加热同时有保持水平衡和辅助搅拌的作用,浸出时间从升温到80℃共计2 h。
第1次浸出液浓度减半连用2次,以后均按逆流浸出程序操作。
1.3.2 浸出结果
试生产基本上重现了中间试验的结果。如果固液分离和对浸渣的清洗加强,并大批量连续生产中完全实现多级逆流浸出,上述指标还能进一步提高。
中间检测溶液中钼浓度,1次浸液60 g/L以上,2次浸液40 g/L以上,3次浸液13 g/L左右;因为储罐不足,所有的1次浸液和最后的2、3次浸液浓缩后都存于一个罐中,混合液6.85 m3含钼54 g/L,按溶液计算浸出率 98.71%;浸出渣平均含钼量0.09%,按渣计算浸出率99.21%;相差0.51个百分点,可能与操作中溶液损失有关。
1.4 浸出体系的分析
1.4.1 高浸出率的实现
在碱浸时,一是要供给钼酸钠形成所需的钠离子,二是要保证浸出液有足够的碱度。Na2S等强碱弱酸盐电离度较低,达到一定浓度后,继续加大用量,并不能按比例提高溶液中OH-浓度,从而限制了浸出率的提高。经验认为彩钼铅矿浸出需要OH-浓度约1~2 mol,传统 Na2S浸出工艺是将Na2S过量20%来实现;为了浸出液中S-、Pb2+最小量化,在NaOH-Na2S体系中采用Na2S与Pb等当量添加,碱度则用40 g/L的NaOH浓度来解决。复碱浸出中,S-与Pb2+(及As)形成硫化物迅速沉淀,降低了溶液中离子的浓度,增加了钼酸铅的溶出速度。中间试验钼浸出率≥99%,工业试验98.71%,远远高于资料介绍的Na2S浸出率97%(渣中含Mo 0.52%)的指标。
1.4.2 避免硫化氢污染
用Na2S过量20%提高碱度来保证浸出率,溶液中存在游离的S2-,沉淀钼酸铵需要将pH值调整到1,酸化时S2-将成为剧毒的H2S析出(S2-+2H+=H2S↑),造成安全和环境问题;即使沉淀钼酸钙只将pH值调整到6.5~7,也会因为中和过程中局部过酸析出H2S,无法完全避免H2S的污染。另外溶液中硫化钠的粘度会影响固液分离,在后续工艺中还可能增加钼产品的含硫量。
既要取得良好的浸出率,又要避免硫化氢污染,新的Na2S-NaOH浸出体系严格按铅(及其他重金属)含量来计算加入Na2S,同时用一定浓度的NaOH得到相应碱度,可以满足浸出的多重要求。
1.4.3 铅钼分离、铅回收及铅污染的预防
当严格按照计算量控制浸出体系中Na2S含量时,浸出的铅几乎全部合成人造铅精矿沉淀,可以将钼酸钠溶液中的铅、硫和重金属杂质控制到极低的水平,有利于铅的回收和铅污染的控制,而且对钼产品的质量极为有利。
原料中铅的回收有很大的资源意义。复碱体系浸出,每处理1 t(Mo 10%,Pb 40%)的彩钼铅矿,就可收得600~700 kg人造铅精矿。对低品位矿,从浸出渣中浮选出合格的人造铅精矿极为易行,尾渣中铅含量可以控制到极低的水平。NaOH、Na2CO3浸出时,铅以铅酸钠进入母液、以铅杂质进入钼产品或以碳酸铅进入尾渣,都有二次污染的危险,当然不如在浸出时就将其造成稳定的铅精矿回收有效和有利。
工艺流程中每次浸出都应尽可能彻底地固液分离,需要选定高效率、高分离率的分离设备和确定合理的操作规程,虽然不影响基本反应,但对提高浸出率和作业效率以及降低酸碱耗却同样重要。
2 钼沉淀工艺的试验选择
2.1 沉钼方式的选择
若以冶炼钼合金提供原料为目的,在钼酸钠、钼酸铵和钼酸钙3种结晶(沉淀)方式中比较选择,把分离效果、产品质量和污染防治作为选择的依据。
2.1.1 钼酸钠
钼酸钠(Na2MoO4),无色或白色结晶,无水工业级钼酸钠含钼酸钠≮98.0%(Mo45.4%),不溶物≯0.05,氯化物≯0.2。溶解度15.5℃时39.27%、100℃时45.57%,溶解度曲线过缓造成结晶困难。对于含钼量较低的彩钼铅矿,浸出时的固液比限制了浸出液钼酸钠浓度提高,如前述50 g/L的溶液达到饱和需要浓缩近10倍,冷却到常温(15.5℃)也只能结晶出36%;采用蒸干浓缩方法,势必有大量的杂质共沉淀,影响钼酸钠质量。2种分离方式又都有高能耗及母液中钼的高残留问题。
2.1.2 钼酸铵
因为形成条件不同,钼酸铵具有多种化学式,是重要的钼盐产品和钼的中间产品。
从钼酸钠溶液用氯化铵沉淀钼酸铵,主要问题有:(1)分离难以彻底,母液一般有1 g/L钼残留;(2)强酸性母液,中和后形成成分复杂的高浓度盐水,难以达标排放;(3)钼酸铵需脱氨后才能用于冶炼,不仅增加工序和能耗,还会产生氨气污染。
2.1.3 钼酸钙
钼酸钙(CaMoO4),白色粉末结晶,纯CaMoO4含钼48%,是钼铁冶炼主要原料之一,又是制取其他高纯度钼盐的中间物。在钼酸钠中沉淀钼酸钙,一般是用氯化钙在中性偏下进行,中和耗用的酸只有铵沉的1/2,中性母液有循环使用的可能;另一个优点是钼酸钙在水中的溶解度极低,母液残留的钼可以降低到0.1 g/L以下,不须高强度浓缩就可以得到较高的沉淀率,能较好地避免污染、节约能源和提高分离率。
用钼酸钙或与氧化钼混合冶炼钼铁,由于渣相的碱度提高,能够大幅度降低熔点,降低熔渣黏度,提高金属沉降速度并延长沉降时间,从而使渣铁分离更充分,减少钼铁锭界面的渣嵌合,提高钼铁的回收率和质量。钼酸钙冶炼钼铁的另一个优点,在于渣的主要成分由二氧化硅变成了硅酸钙,经过水淬等适当的活化即成为很好的矿质肥料,不仅含有丰富的钙、镁、硅等植物必需的中量元素肥分,还含有丰富的钼、铁、锌、锰等重要的微量元素,对提高产量、提高品质和改良土壤有显著的作用。
传统炉外法钼铁冶炼渣,大约含有0.6%~1%的钼,其中金属态、氧化态(Mo6+)和还原态(Mo4+)大约各1/3,用跳汰等重选方法能够把绝大部分金属态钼合金回收,而其他形态的钼都随渣遗弃。年产5 000 t钼铁所抛弃的7 000余t渣中,有20~30 t未还原钼,相当于0.4%的回收率损失,或30~45 t钼酸铵肥料,价值逾600万元,是长期被忽视的钼肥资源。
2.2 钙沉工艺的试验研究
初期的钙沉小型试验,只有80%的沉淀率和30%的含钼量,铅也严重超标。认识逐渐加深之后,根据氯化钙的含钙量来计算用量,使沉淀率上升到85%以上,含钼量上升到41%以上;通过溶液净化和pH值的调整,铅、硫杂质的含量,也都达到了工业钼酸钙标准(见表4)。
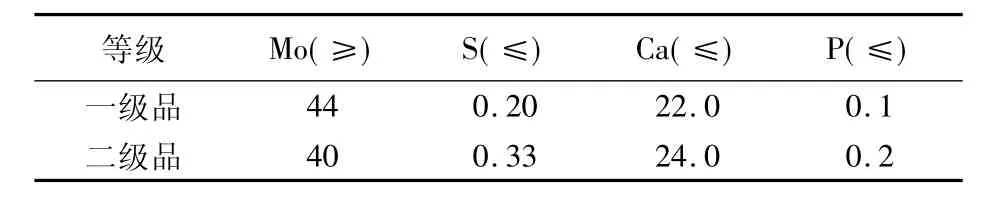
表4 工业钼酸钙指标 %
为了进一步提高沉淀率和质量,建立工艺要素对指标影响的规律性认识,设计进行了关于沉淀条件的多因子正交试验。
2.2.1 多因素正交试验的设计
从众多的影响因素中剔除了没有疑问的因素如溶液氧化、净化、钼浓度等,将尚无定论的硫酸根浓度、pH值、沉淀剂过量系数和沉淀温度作为试验因素,在经验数据范围内各取3个变量安排试验。见表5、表6。
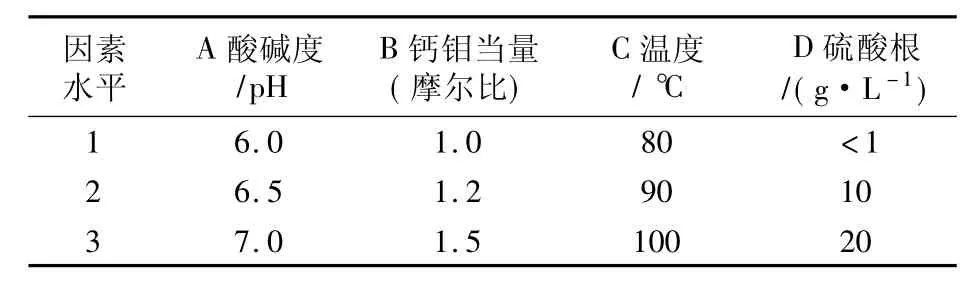
表5 试验因素水平表
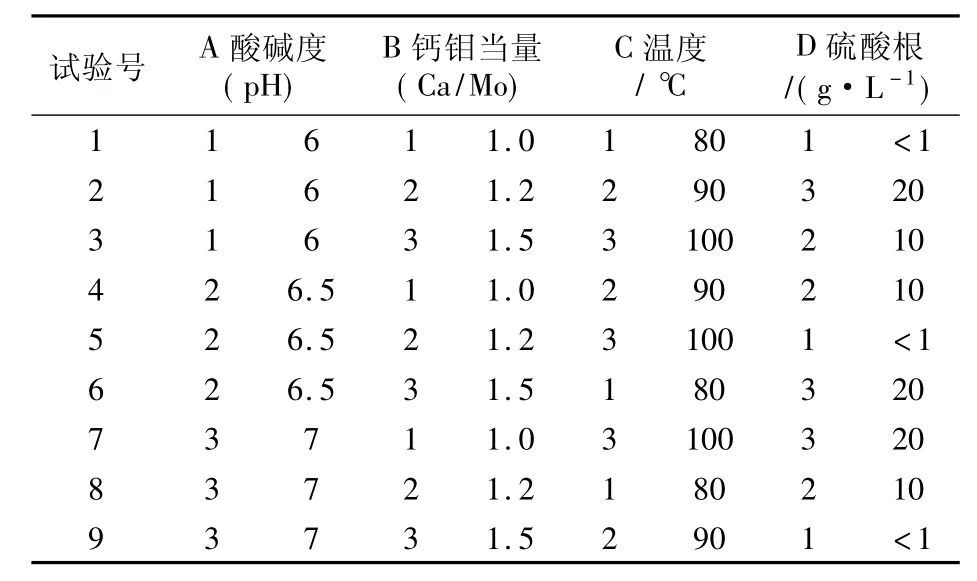
表6 采用L9(34)正交表设计的试验处理表
试验的考核指标为:①沉淀率,用母液残留钼含量(g/L)考核;②钼酸钙杂质量,用产品含S百分比考核;③钼酸钙含钼量,用产品含钼百分比考核。
试验结果的分析计算采用Lg(34)极差分析表进行。
2.2.2 试验结果与分析
试验结果直录于试验分析表7中。
2.2.3 结果分析
(1)对沉淀率的影响
①对沉淀率影响顺序为:B氯化钙加入量 >A溶液酸碱度>D硫酸根含量>C沉淀温度。
②从操作看,溶液沸腾时形成的钼酸钙结晶较粗,沉降快,操作上较易掌握。
③从提高沉淀率加上操作原因,应采取A3B3C3D1的工艺组合。
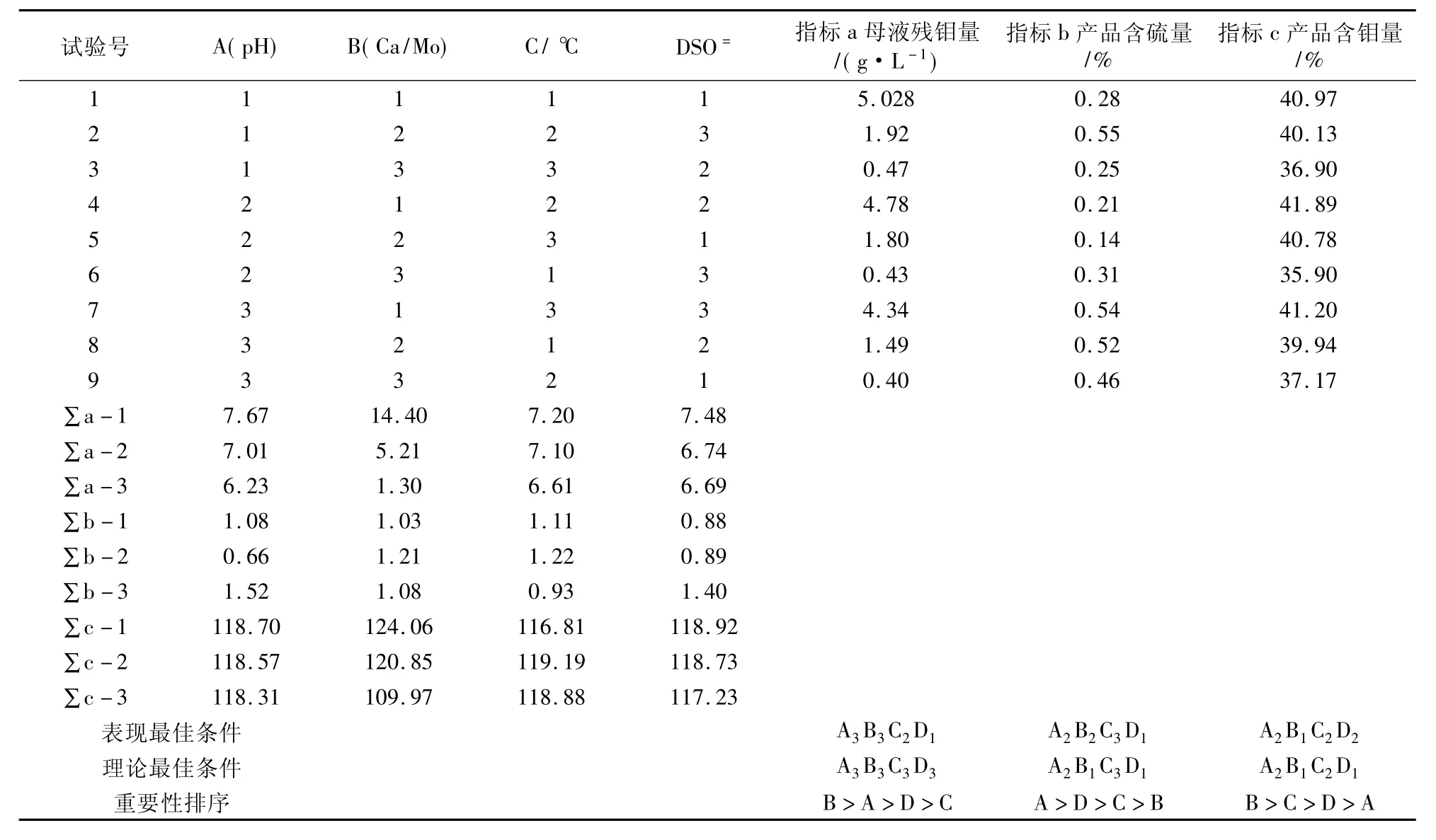
表7 L9(34)试验结果分析表
(2)对钼酸钙含钼量的影响
①各因素对含钼量影响排序为:B>C>D>A。
②当钙钼比由1.0增加到1.5时,与平均含钼量呈显著负相关;沉淀温度90℃时比80℃时平均含钼量高0.79个百分点,仍有意义。
③含钼量和沉淀率互为消长,又有很大的变量存在,不宜牺牲沉淀率片面追求高含钼量,须权衡轻重,平衡取舍,以寻求合理的平衡点。

表8 含钼量和沉淀率关系 %
实践中可以有3种取向:
第1种,确保98%以上回收率,争取36%以上含钼量;
第2种,确保40%以上含钼量,争取93%以上回收率;
第3种,2次沉淀,第1次1/1加钙,沉淀80%~90%的钼,保证41%以上含钼量,液中应留5 g/L左右钼浓度以便2次沉淀;第2次1.5/1加钙,保证90%以上回收率,残钼控制在0.5 g/L以下,总回收率可以达到98%以上,由于第2次产品仅占总量10%,即使含钼量仅35%,平均也能超过40%。
(3)对钼酸钙含硫量的影响
在溶液硫酸根1~20 g/L范围内,影响最大的因素是钙沉时溶液的pH值,pH=7时平均含硫量与6、6.5时分别为140%、230%,其次才是溶液硫酸根浓度,温度和加钙量影响很小。可见影响钼酸钙含硫量的因素相当复杂,除本次试验了解到溶液pH值比较重要,还可能有很多未知的因素。在生产上除了尽量避免硫杂质的进入(例如不使硫化钠过量),主要应将溶液pH值控制好。
2.3 试生产验证
按试验产生的思路组织试生产,对浸出试生产产生的6.85 m3含钼量54 g/L的浸出液进行沉淀钼酸钙作业。
第1次以1/1加钙,钼酸钙含钼41.6%,残钼3.9 g/L,沉淀率92.2%;第2次以1.5/1加钙,钼酸钙含钼37.0%,残钼0.4 g/L,回收率89.8%。2次总回收率 99.25%、平均含钼量 41.05%、含硫0.054%,都达到了预期目标。
钼酸钙沉淀工艺条件组合应该是:溶液pH值6.5,钙和钼的摩尔比1.2(2次沉淀时为1/1和1/1.5),温度沸腾,并注意在前期作业中防止硫杂质的进入。
3 碱的回收和母液循环利用
在钼提取的传统工艺中,碱浸之后用盐酸中和,沉淀分离之后形成高浓度的盐,为母液循环利用和无害排放造成很大的困难。如果用电化学的方法分离回收NaOH,降低pH值时不增加其他离子,则对于节约酸、碱和母液的循环利用将有非常重要的意义。
3.1 离子膜电解技术在提取冶金中的应用
3.1.1 离子膜电解原理
由钠盐(NaCl)电解生产NaOH和HCl,是酸碱工业生产的主要途径,其电化学原理亦通用于其他钠盐的分离。双膜电解Na2SO4原理见图1。
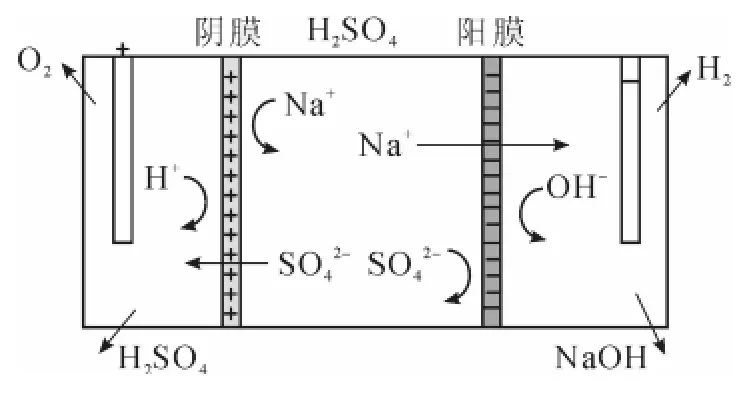
图1 双膜电解Na2SO4示意图
槽的左侧装有阴膜,右侧装有阳膜,两侧加直流电场,2种离子交换膜将电解槽分隔成阳极室、阴极室和中间室。中间室通入Na2SO4溶液,阳极室通入稀硫酸,阴极室通入苛性钠稀溶液,在直流电场的作用下,中间室的Na+通过阳膜进入阴极室与阴极上产生的OH-合成NaHO,SO2-4通过阴膜进入阳极室与阳极上产生的H+合成H2SO4。
3.1.2 在钨提取技术中的应用
已见报道,钨提取技术中,用碳酸钠浸出白钨精矿的溶液中含有过剩的碳酸钠,萃取前须用酸中和到pH 2.5~3.0,不仅浪费碱,酸的消耗也很大,采用阳离子交换膜电渗析,从阴极室回收碱,同时使阳极室溶液达到所需要的pH值条件。与传统的盐酸酸化提取钨酸相比,有碱回收、节省酸和溶液循环利用三重意义。其原理见图2。
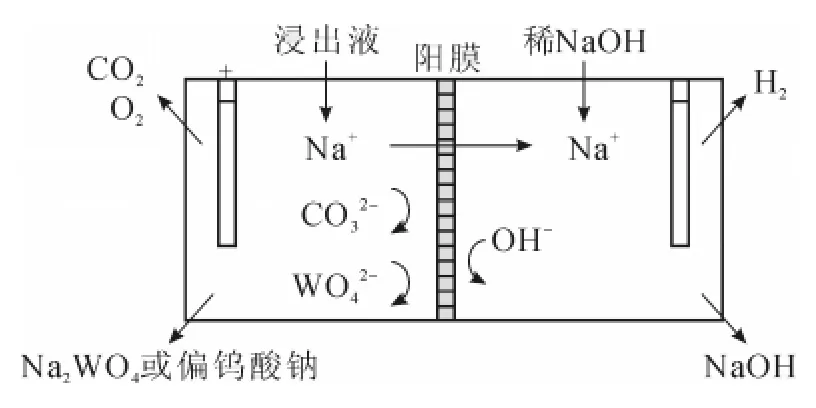
图2 电渗析回收碱示意图
3.2 从钼酸钠溶液中回收碱的试验
Cr、Mo、W、是同族元素,性质接近,MoO4-2比WO4-2的电负性还要强些,因此Na2MoO4溶液也能够采用同样的技术。
3.2.1 探索应用离子膜电解技术从碱浸钼溶液回收碱的可能性
试验条件:塑料电解槽380 mm×150 mm× 30 mm,有效容积1.7 dm3;阴、阳电极为石墨380 mm×150 mm,极间距离30 mm;中间为异相强酸型阳离子交换膜(上海产);阴极原液:碱浸液3 000 mL,成分见表9;阳极原液蒸馏水3 000 mL。
3.2.2 电解试验
电解条件和过程参数见表9,电解前后各极室成分变化见表10。
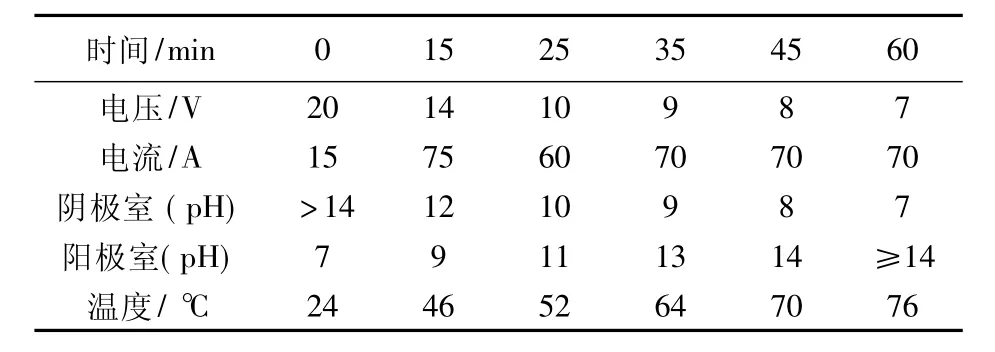
表9 电解条件和过程参数
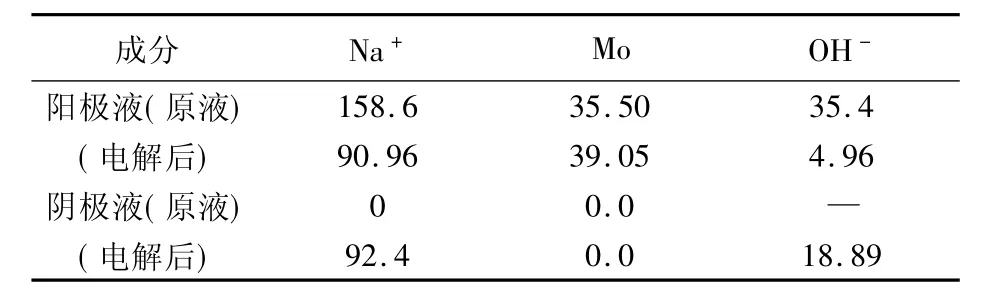
表10 电解前后各极室成分变化
3.2.3 试验结果分析
电解过程见图3。
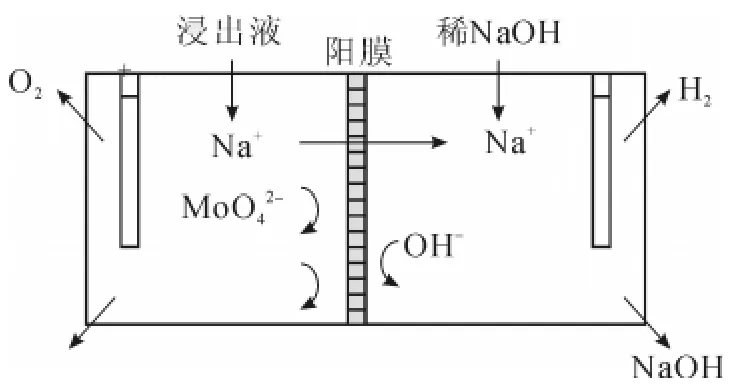
图3 膜电解从钼酸钠回收碱示意图
在直流电场作用下,Na+向阴极运动,透过阳离子膜进入阴极室,与阴极产生的OH-结合为NaOH,1.7 L超过1 mol浓度阳极室碱溶液在1 h内,pH降低到7以下,Na+由158.6 g/L降低到90.9 g/L,同时液量减少了1/5,实际上有50.4%的Na+迁移到了阴极室。因为阳离子膜的选择透性,MoO-24阴离子不会进入阴极室,在阴极室可以得到很纯的碱溶液,可以返回用于彩钼铅矿浸出液配制。
同一般电解槽两极发生的情况一样,阴极析出H2、阳极析出O2,阳极室H+使溶液pH降低,阴极室OH-与Na+合成碱,同时达到回收碱和节省酸的目的。
3.3 膜电解技术引起的提取工艺变革
采用膜电解回收碱并实现浸液循环后,彩钼铅矿碱浸提取钼酸钙的工艺流程,便完全具备了清洁生产的特征和实质,见图4。
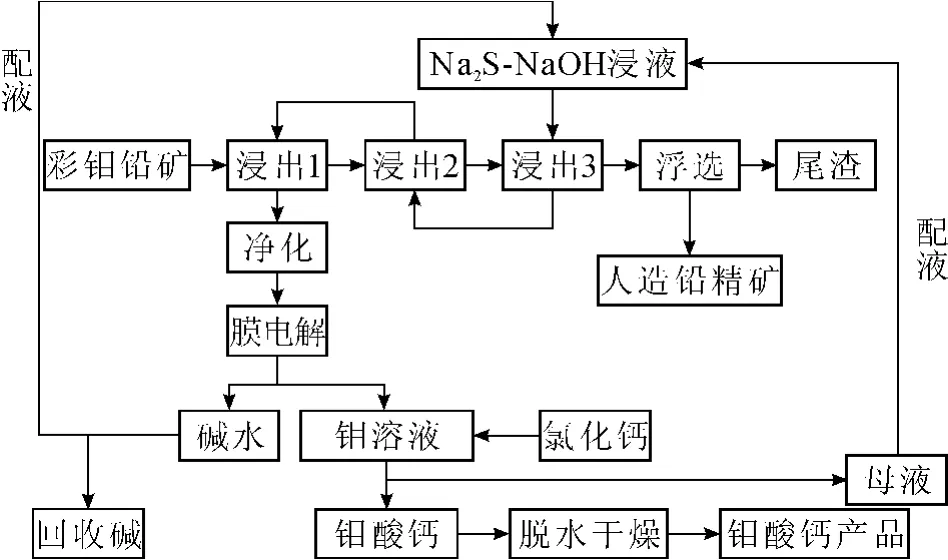
图4 彩钼铅矿碱浸提取钼酸钙的清洁工艺流程
3.3.1 浸出负碱耗、零酸耗
浸出液中配入的1 mol左右的游离NaOH,在电解中很容易回收;Na2S中的S在与PbMoO4反应中生成的 PbS沉淀,Na2MoO4在溶液中以 Na+和MoO24-存在,溶液的pH≥14,膜电解后降低到6~7,50%以上钠离子成为NaOH回收。实际回收的碱是配入的NaOH的1.5倍,原工艺用以中和的摩尔数与回收碱相同的盐酸完全节省下来。
3.3.2 浸液循环零排放
膜电解后pH约6~7的溶液,用CaCl2沉淀CaMoO4。因为不用盐酸中和,母液Cl-浓度增加缓慢,可以多次循环使用;若进一步电解到pH值更低,直接用纯度很高的消石灰沉淀钼酸钙(要根据溶液含钼量来计算和控制pH值),母液中不含氯盐,理论上补充碱液后可以无限多次继续浸出,实现浸液完全循环和废水零排放。另外在浸液完全循环的条件下,少量未沉淀的钼可以在下次浸出时收回,进一步提高回收率和CaMoO4的含钼量。
另一种可能的途径,采用阳膜进行电渗析从浸出液中回收碱,在阳极室得到酸碱度很低的Na2MoO4-H2MoO4溶液,直接得到钼酸或加入需要的阳离子沉淀为钼盐,这与从钨酸钠溶液中回收NaOH产出钨酸的原理是相同的。
3.3.3 电解效率和碱回收成本
电解效率、碱回收成本等在上述规模的试验中尚无法分析,但可以从类似的生产经济技术指标中得到近似的结果。辽宁凌海市化学试剂厂用氯化钾生产高纯氢氧化钾(33%液体产品)的主要经济技术指标为:
设备:阳离子膜14片共14 m2;
电流密度:2.4 kA/m2;
电耗:900 kWh/t,折固体KOH2 700 kWh/t。
按综合电价0.5元/度计算用电成本:液体KOH1 350元/t,
因为NaOH分子量只有KOH的40/56,电耗应为3 180 kWh/t,电费1 590元/t。液体碱产品可以直接用于浸出,不发生干燥等成本,比购买NaOH节省近50%;每回收1 t碱同时节省中和用含量36%盐酸3.0 t以上,又可节省2 000多元,加上废水处理费用和水资源的价值,经济效益十分显著。
清洁生产的实施将为企业争取到经济、社会和环境三位一体的综合效益:最大限度地将“原料全部变成产品”——钼和铅的高回收率;最大可能地“节约资源和能源”——酸、碱和水;把污染防止于工艺过程之中——防止硫化氢、氨气、氯化氢气体污染的产生、防止含碱、酸、盐废水的产生、防止铅污染的产生。
前面已经说过,在清洁生产的实现中,往往不全是新技术的发明,更多的是新技术和现有技术的合理组合。复碱(NaOH-Na2S)浸出体系、2次沉淀钼酸钙、膜电解(电渗析)回收碱与逆流浸出、浮选富集铅精矿等技术的组合,体现了清洁生产的理念,是一次有意义的尝试。
本文的意图,还在于提供一种思路和一个实例,期望能够对铁合金行业清洁生产的实现有所促进。
[1]张文钲:钼冶炼[M].西安:西安交通大学出版社,1991.
[2]陈国华,王光信.电化学方法应用[M].北京:化学工业出版社,2003.
