气道滴入加烟熏法建立慢性支气管炎大鼠模型的实验研究
2011-04-21王瑛
王 瑛
慢 性 阻 塞 性 肺 疾 病 (chronic obstructive pulmonary diseases,COPD)是临床常见的呼吸道疾病,是一种具有气流受限特征、可以预防和治疗的疾病。目前居全球病死原因的第4位,是严重的全球性公共卫生问题。目前该病发病机制不十分明确,治疗手段有限。因此对慢性支气管炎机制的研究仍是国内外学者备受关注的问题,而如何建立合理便捷的动物模型是研究的关键所在,本实验通过改良烟熏及脂多糖气道滴入法成功建立了符合人类发病机制的大鼠慢性支气管炎模型。
1 材料和方法
1.1 动物 雄性二级Wistar大鼠18只,鼠龄8周,体重(180+20)g(解放军总医院动物中心提供)。分为正常组、对照组(生理盐水组)、慢性支气管炎组(又:慢支模型组)各6只。
1.2 烟熏材料 哈德门香烟(焦油含量1.4 mg)。
1.3 试剂 脂多糖(LPS,Sigma公司)。
1.4 方法 正常组,正常饲养,不做任何干预。生理盐水组:分别于第2、9、16、23天,将大鼠以3%戊巴比妥按45 mg/kg腹腔麻醉后,仰卧位固定于大鼠固定板,行颈部、胸部脱毛。做颈部正中切口,长约2~3 cm,分离颈前肌,暴露并固定气管,以静脉留置针替代气管导管行气管插管,向大鼠气管内注入无菌生理盐水 200 μl,完毕后迅速将大鼠直立旋转10~20 s,使生理盐水均匀分布于肺部。慢支模型组,分别于第1、8、15、22天,向大鼠气管内缓慢注入LPS 200 μl(脂多糖10 mg/瓶,购自美国Sigma公司,用无菌注射用水制成水溶液,1 mg/ml),以防窒息。完毕后迅速将大鼠直立旋转10~20 s,使LPS均匀分布于肺部。 第3~8、10~15、17~22、23~28天,每天在有机玻璃熏烟箱内持续吸入新鲜的哈德门香烟雾30 min,15支/次,2次/d。
1.5 标本采集
1.5.1 肺泡灌洗[1]分离颈部气管,在气管下段做小“V”型切口,静脉留置管为气管套管,用预热至37℃的生理盐水,分次缓慢灌洗,5 m1/次,连续3次,回收率在82%~95%,收集灌洗液于15 ml离心管中,2000 r/min离心10 min,取上清液分装,置-70℃以下保存备用。
1.5.2 肺脏病理标本制作[2]28 d后采集标本之前,大鼠禁食、不禁水12 h,称重。将大鼠腹腔麻醉后,迅速放血处死大鼠,开胸完整取出肺脏,向右肺注入10%甲醛磷酸盐缓冲液5~7 ml,浸入10%甲醛液中固定。于右下肺矢状面,右中叶冠状面最大周径处横贯各取材1块,常规脱水,石蜡包埋、切片、HE染色,镜下观察各组肺组织病理形态学的改变。肺组织做病理学检查。
1.6 气道炎症病变观察及评分方法 根据文献[3]小气道病变评估方法和标准加以改进。
2 结 果
2.1 一般表现 生理盐水组大鼠反应灵活,运动敏捷,呼吸规整,无咳嗽、气喘,毛发整齐有光泽与正常组无异。慢支模型组大鼠熏烟4周后即出现咳嗽,活动后出现气喘、呼吸气促,腹式呼吸明显(严重者呼吸减慢或呼吸节律不整),反应略迟钝,不喜运动,扎堆,毛发零乱、无光泽。造模期间各组体重变化见表1,生理盐水组体重无明显变化,慢支模型组体重28 d后明显减轻。
表1 三组大鼠造模期体重(g,±s)

表1 三组大鼠造模期体重(g,±s)
与生理盐水组比较,*P<0.05
分组 第1天 第10天 第20天 第28天生理盐水组 216.15±12.05 276.15±19.85 358.70±28.97 404.86±24.65慢支模型组 211.33±11.90 259.00±17.68 302.00±25.24*337.65±27.13*
2.2 肺组织病理HE染色 生理盐水组呼吸道及肺泡结构正常,支气管纤毛排列整齐,肺泡结构完整,无肺气肿及炎性细胞浸润,支气管壁平整,支气管平滑肌无增厚、断裂,气管及支气管管腔内均无炎性渗出物。见图1。
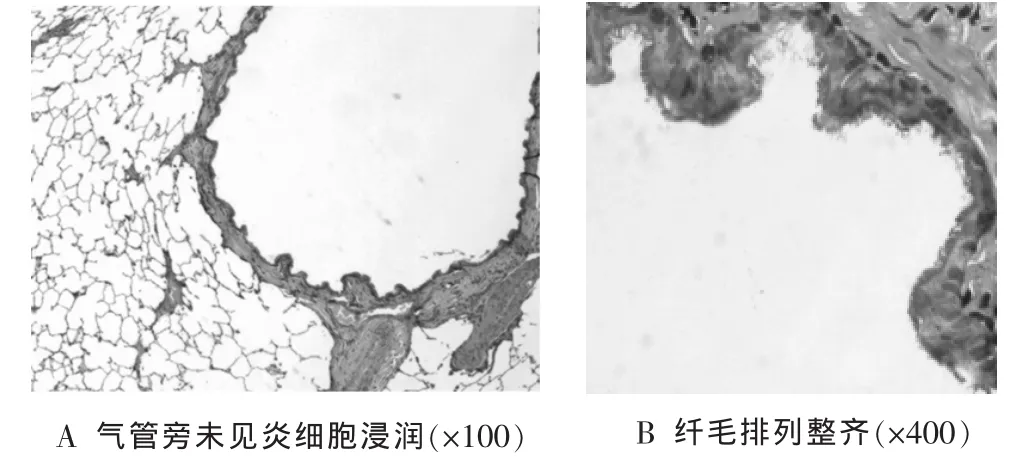

图1 生理盐水组病理染色表现
慢支模型组可见肺泡壁水肿明显,气道黏膜上皮纤毛部分粘连、倒伏、脱落,杯状细胞增生,管壁炎细胞浸润,支气管平滑肌增厚,断裂。见图2。

图2 慢支模型组病理改变
2.3 气道炎症病理评分 各组气道炎症评分见表2,与生理盐水组比较,慢支模型组在各项评分均高,其中以气道纤毛倒伏及炎细胞浸润最为明显,且气道炎症病理总分显著增高(P<0.01),在浸润的炎性细胞中又以淋巴细胞为主。
3 讨 论
COPD是呼吸系统疾病中的常见病和多发病,其患病率和病死率均较高,是严重影响人们生活质量和劳动力的慢性疾病。因此,加强对COPD的防治,在降低患病率和病死率方面均具有重要的意义。COPD主要包括慢性支气管炎和肺气肿,诊断依照肺功能检查,当慢性支气管炎和肺气肿患者肺功能检查出现气流阻塞并且不完全可逆时,则诊断为COPD。因此,慢性支气管炎和肺气肿既可能是COPD的初级阶段,又可能已经属于COPD。通过建立和研究动物模型来模仿慢性支气管炎的病理特征,为进一步阐明COPD发病的遗传背景、诱发因素、发病机制和药物疗效提供便利的条件。流行病学调查表明,吸烟是最重要的发病因素,大气污染是辅助性因素[4]。香烟中含有4000多种自由基(free radical)和多种毒性成分,可损伤气道上皮细胞,使支气管黏液腺肥大,黏膜充血水肿、黏液过量分泌、聚集,也可通过诱导体内发生氧化损伤和炎症反应而致慢性支气管炎发生[5]。研究证实,在慢性支气管炎形成之前,吸烟者气道即出现了早期炎症表现[6],因此,针对这一早期过程的研究至关重要。但是,单纯吸烟部分病例尚缺乏典型的气道结构重塑特征,因此不能完全代表慢性支气管炎模型,并且单纯吸烟模式造模时间长,烟雾量不易控制,所造成的慢支模型不稳定,不易被复制。宋一平等[7]首次在国内采用熏香烟和气管内间断灌注脂多糖(lipopolysaccharide,LPS)的方法制作慢支动物模型,结果显示模型组大鼠气管、支气管和肺组织有典型的慢性支气管炎和局限性肺气肿的病理学改变,肺功能多项指标显著下降。李红梅等[8]将单纯熏香烟与熏香烟加气道注入内毒素两种方法进行比较,发现二者均具有慢性支气管炎的病理改变,但前者病变和表现都较轻,所需时间长(6~8周)分析其原因可能与前者气道刺激强度不够有关。LPS为革兰阴性菌细胞壁的外膜结构,也是重要的致炎因子,普遍存在于污染气体及有机物灰尘中,长期吸入可直接引起气道上皮损伤,激活各种炎性细胞,促使细胞因子的释放,诱发气道炎症的出现,最终导致慢性支气管炎的发生[9]。所以烟熏加LPS气管内滴注在发病机制及病理上均符合人类慢性支气管炎的标准,是目前较为成功也是较为成熟的模型。本实验参考宋一平等熏香烟加气管内灌注内毒素的方法加以改良复制了大鼠慢性支气管炎的模型,既考虑到人类慢性支气管炎的发病机制,又注意足够的刺激强度,成功复制出了慢性支气管炎的模型。
表2 各组气道炎症病理评分(±s)
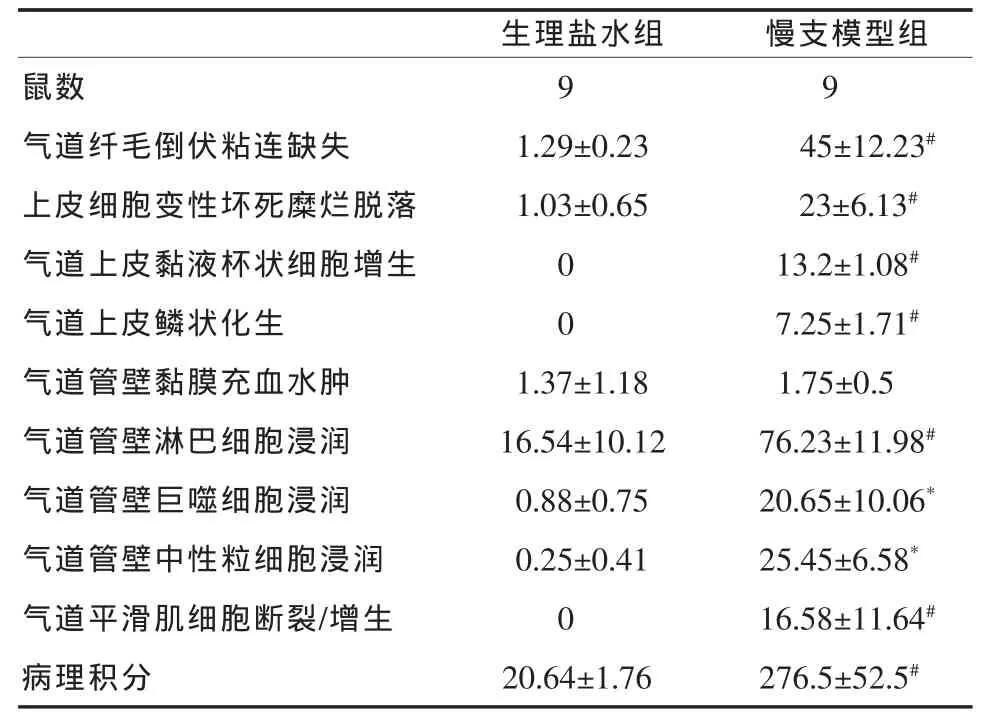
表2 各组气道炎症病理评分(±s)
与生理盐水组比较,*P<0.05,#P<0.01
生理盐水组 慢支模型组鼠数 99气道纤毛倒伏粘连缺失 1.29±0.23 45±12.23#上皮细胞变性坏死糜烂脱落 1.03±0.65 23±6.13#气道上皮黏液杯状细胞增生 0 13.2±1.08#气道上皮鳞状化生 0 7.25±1.71#气道管壁黏膜充血水肿 1.37±1.18 1.75±0.5气道管壁淋巴细胞浸润 16.54±10.12 76.23±11.98#气道管壁巨噬细胞浸润 0.88±0.75 20.65±10.06*气道管壁中性粒细胞浸润 0.25±0.41 25.45±6.58*气道平滑肌细胞断裂/增生 0 16.58±11.64#病理积分 20.64±1.76 276.5±52.5#
本实验中动物模型的临床体征、病理特征均与人类慢性支气管炎患者病情由轻到重发展过程中的改变相符合,本实验肺组织病理形态学特点表明所复制的大鼠模型符合人类慢性支气管炎的特点,证明慢性支气管炎大鼠模型复制成功,且方法简单经济,适用于慢性支气管炎的实验研究。
[1]李影林.临床微生物学及检验[M].北京:人民卫生出版社,1995.673.
[2]Ishlda Y.Experimental pneumonia with Pseudomonas aeruginosain immunosuppressed guinea pigs as a model for biofilm-associated infection[J].Kansen Sho Gaku Zasshi,1995,69(5):572-81.
[3]Cosio M,Chezzo H,Hogg JC,et al.The relations between structural changes in small airways and pulmonary function tests[J].N Engl J Med,1978,298(23):1277-1281.
[4]Zaher C,Halbert R,Dubois R,et al.Smoking-related diseases:the importance of COPD[J].Int J Tuberc Lung Dis,2004,8(12):1423-1428.
[5]Nagai A.Apoptosis in chronic obstructive pulmonary disease[J].Nippon Rinsho,2003,61(12):2126-2132.
[6]Di Stefano A,Capelli A,Lusuardi M,et al. Severity of airflow limitation is associated with severity of airway inflammation in smokers[J].Am J Respir Crit Care Med,1998,158:1277-1285.
[7]宋一平,崔德健,茅培英.慢性阻塞性肺病大鼠模型的建立及药物干预的影响[J].军医进修学院学报,2001,22(2):99-102.
[8]李红梅,崔德健.熏香烟加气管注内毒素和单纯熏香烟法建立大鼠COPD模型[J].中国病理生理杂志,2002,18(7):808-812.
[9]Vernooy JH,Dentener MA,van Suylen RJ,et al.Long-term intratracheal lipopolysaccharide exposure in mice results in chronic lung inflammation and persistent Pathology[J].Am J Respir Cell Mol Biol,2002,26(1):152-159.
