以次黄嘌呤单核苷酸脱氢酶为靶点的新型抗结核药物高通量筛选模型的建立及应用
2011-04-11熊小椒周爽杨延辉关艳肖春玲
熊小椒,周爽,杨延辉,关艳,肖春玲
·论著·
以次黄嘌呤单核苷酸脱氢酶为靶点的新型抗结核药物高通量筛选模型的建立及应用
熊小椒,周爽,杨延辉,关艳,肖春玲
目的建立以结核分枝杆菌次黄嘌呤单核苷酸脱氢酶为靶点的新型抗结核药物高通量筛选模型。
抗结核药; 次黄嘌呤类; 药物评价,临床前
www.cmbp.net.cn 中国医药生物技术, 2011, 6(6):445-449
近年来,结核病发病率的不断攀升使其又一次成为威胁人类健康的重大传染病之一。结核分枝杆菌(Mycobacterium tuberculosis,MTB)的耐药问题日趋严重,结核病与艾滋病共感染现象不断增加,使结核病疫情的防控面临着更为严峻的问题[1-2],也使新型抗结核药物的开发迫在眉睫。
次黄嘌呤单核苷酸脱氢酶(IMPDH)是 MTB从头合成鸟嘌呤核苷酸(GMP)途径的关键酶。IMPDH 能够以烟酰胺腺嘌呤二核苷酸(NAD+)作为受氢体,将次黄嘌呤核苷酸(IMP)氧化生成黄嘌呤核苷酸(XMP),而 XMP 正是生命体从头合成 GMP 的前体物质。所以,抑制 IMPDH 的活性可以阻止 GMP 的合成,从而抑制 MTB 的生长和增殖。Sassetti 等[3]的研究也证明,编码 IMPDH 的基因为 MTB 生长所必需。而 MTB 的 IMPDH和人源 IMPDH 在其 IMP 结合位点上的核苷酸抑制因子结合区有很大不同[4]。所以,MTB IMPDH是新型抗结核药物的潜在靶点,使研发选择性抑制MTB 的药物成为可能。
MTB H37Rv 基因组中包含有 3 个编码IMPDH 的基因[5]:guaB1(Rv1843c)、guaB2 (Rv3411c)和 guaB3(Rv3410c)。转座子突变研究已经表明,MTB 的 guaB2 基因是这 3 个基因中唯一的必需基因[3]。
本研究通过在体外测定重组表达的 MTB GuaB2 蛋白活性,建立了 MTB GuaB2 抑制剂的高通量筛选(HTS)模型,为发现潜在的具有 MTB GuaB2 抑制作用的新型药物提供了一种快速有效的方法。
1 材料与方法
1.1 仪器与材料
Hi-trap Fast Flow 亲和层析柱、PD-10 脱盐柱(SephadexTMG-25)AKTA 蛋白纯化仪均为美国GE 公司产品;PCR 仪(DNA Engine peltier Thermal Cycler)为美国 Biorad 公司产品;AH 高压匀浆仪(AH-Basic)为加拿大 Ats engineering Inc. 公司产品;Envision 酶标仪为美国 Perkin Elmer 公司产品。
NAD+购自美国 Sigma 公司;IMP 购自英国Acros Organics 公司;IPTG 购自美国 Merck 公司;DNA 分子量标准购自北京全式金生物技术有限公司;蛋白质分子量标准购自加拿大 Fermentas公司;引物合成和质粒序列测定由上海生工生物工程技术服务有限公司完成。表达载体 pBEV 由美国 Vertex 制药公司提供;大肠杆菌 DH5α 和大肠杆菌 BL21(DE3)pLysS 质粒受体菌购自北京天根生物公司。
1.2 方法
1.2.1MTB GuaB2 的表达与纯化 以 MTB H37Rv 基因组为模板,GuaB2nt1:5′ AATGGCATA TGTCCCGTGGCATGTC 3′ 和 GuaB2nt2:5′ TAAA CCTCGAGTTAGCGCGCGTAGT 3′ 为引物(下划线为酶切位点),经 PCR 扩增,条件为:94 ℃ 预变性 3 min;94 ℃ 变性 30 s,55 ℃ 复性 30 s,72 ℃ 延伸 3.5 min,32 个循环;最后 72 ℃ 反应10 min。NdeI 和XhoI 双酶切后与表达载体pBEV连接,转化入E.coliDH5α,用含 100 mg/L氨苄青霉素(Amp)LB 平板筛选阳性克隆子。将测序正确的质粒转化入E.coliBL21(DE3)pLysS,在含 100 mg/L Amp 和 34 mg/L 氯霉素的 BHI 平板上筛选得到 GuaB2 蛋白稳定表达菌株。基本操作参见分子克隆实验指南[6]。挑取单菌落于 BHI液体培养基中 37 ℃、200 r/min 过夜培养,以 1∶50的比例接种于 BHI 培养基中,培养至OD600= 0.4 ~ 0.6。加入 IPTG 至终浓度为 1 mmol/L,28 ℃,200 r/min 诱导 10 h。低温离心收集菌体,用细胞压力破碎仪在 8 × 107Pa 条件下破碎菌体 2 遍,用 Ni2+亲和色谱法进行蛋白纯化。聚丙烯酰胺凝胶电泳(SDS-PAGE)后,用考马斯亮蓝染色,观察蛋白表达、纯化情况。将凝胶内蛋白条带电转至硝酸纤维素膜上,5% 脱脂奶粉封闭 2 h,加入His-tag 单克隆抗体,4 ℃ 过夜。加入 lgG-HRP 二抗,室温 2 h,增强型化学发光试剂(enhanced chemilum inescence,ECL)发光,显影。
1.2.2酶活性测定及筛选条件的优化 于 96 孔酶标板中加入 GuaB2 活性测定缓冲体系[100 mmol/L Tris-HCl(pH 8.0),100 mmol/L KCl,2.5 mmol/L EDTA及1 mmol/L DTT],100 mmol/L 的 IMP 0.5 µl 和 100 mmol/L 的 NAD+2.5 µl,GuaB2 1 µg,使每孔终体积为 100 µl。在 25 ℃ 条件下检测 340 nm 波长的光吸收值(OD340)变化。优化参数包括:反应底物 IMP(1.5 ~ 0.0117 µmol/L,对倍稀释)和 NAD+的浓度(10 ~ 0.0781 µmol/L,对倍稀释),25 ℃ 下酶促反应时间(10 ~ 70 min,间隔 10 min),酶量(8.24 ~ 0.26 U,对倍稀释)。
1.2.3酶抑制剂的高通量筛选 以优化后的反应条件进行筛选,每块 96 孔酶标板上设 80 个待筛样品孔及 4 个阳性对照孔和 4 个阴性对照孔。由于目前没有已报道的 MTB GuaB2 酶抑制剂,本研究以加入热变性酶作为阳性对照。每孔加入待测样品终浓度为 10 µg/ml,在 25 ℃ 条件下检测30 min 内反应体系OD340的变化,计算酶的反应速率。利用反应速率计算样品对 GuaB2 的抑制率(R):R(%)=(1 - VS/VN)× 100%。其中 VS代表待测样品孔的酶反应速率;VN代表阴性对照孔的平均酶反应速率。
根据以上条件,我们对本所药用化合物样品库中的 1765 个化合物进行了初筛,选择抑制率 ≥50% 的样品作为活性样品,按照初筛的反应条件和方法进行复筛。根据复筛结果,确定 GuaB2 抑制剂的抑制率。
1.2.4高通量筛选模型的评价 Z’ 因子法是评价HTS 模型的一种重要方法。根据公式计算 Z’ 因子值:Z’ = 1 - 3(SDn + SDp)/(Vn - Vp)。其中 Vn 和 SDn 分别为阴性对照孔的酶反应速率平均值和标准差;Vp 和 SDp 分别代表阳性对照孔的酶反应速率平均值和标准差。
2 结果
2.1 GuaB2 表达载体的构建
PCR 产物经 1% 的琼脂糖凝胶电泳鉴定,得到了长度为 1590 bp 的guaB2 基因(图1)。选取经PCR 验证为阳性的菌落,提取质粒,用双酶切的方法进一步验证(图2)。酶切鉴定正确的质粒进行测序分析经比对与 GeneBank 中 MTB 的guaB2 基因序列一致。
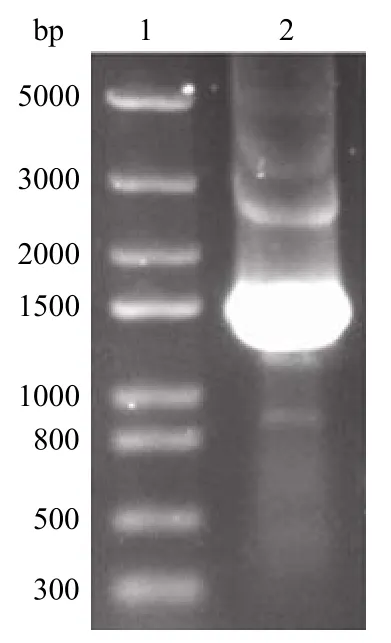
图1 guaB2 的 PCR 扩增结果Figure 1 PCR product ofguaB2

图2 pBEV::guaB2 的双酶切验证Figure 2 Restriction enzymatic analysis of pBEV::guaB2
2.2 GuaB2 的表达及纯化
对表达纯化得到的 GuaB2 蛋白进行 SDSPAGE 分析,相对分子质量约为 57 kD,与理论预期值一致。纯化得到的融合蛋白可见单一条带。经western blot 鉴定,结果表明该蛋白条带确为 GuaB2融合蛋白(图3)。

图3 His-GuaB2 蛋白的纯化及 western blot 检测 His-GuaB2 的表达Figure 3 Purification of His-GuaB2 and western blot analysis of the expression of His-GuaB2

图4 筛选条件的优化Figure 4 Optimization of screening conditions
2.3 酶活性测定及筛选条件优化
GuaB2 酶活测定原理是应用吸光光度法检测酶催化反应产物 NADH。GuaB2 酶活力的定义:25 ℃ 条件下反应,每分钟内催化生成 1 µmol/L底物的酶量设定为 1 U。纯化脱盐后的 GuaB2 为0.2 mg/ml,酶比活力为 736 U/mg。对筛选体系进行优化,最佳的筛选条件是 IMP 的浓度为0.5 mmol/L;NAD+浓度为 2.5 mmol/L;酶促反应时间 30 min;GuaB 酶量为 4 U/孔(图4)。
2.4 筛选方法的评估
目前广泛使用的 HTS 模型的稳定性和可靠性评估参数是 Z’ 因子[7],它是一个统计学参数,与筛选源无关,仅与筛选方法本身有关。一般认为,如果 Z’ > 0.5,说明该筛选模型是比较理想的适合于 HTS 的方法;如果 Z’ < 0.5,则说明筛选方法还需要调整。本实验中 HTS 的 Z’ 因子值为 0.68(图5)。因此,所建立的筛选方法是一种稳定性和灵敏度都较好的 HTS 方法。

图5 评价 GuaB2 抑制剂高通量筛选方法(Z’ ≈ 0.68)Figure 5 Evaluation of the HTS method for inhibitors of GuaB2 (Z’ ≈ 0.68)
2.5 GuaB2 抑制剂的筛选
采用建立的 HTS 模型,对本所药用化合物库中 1765 个化合物进行筛选。初筛发现抑制率 >50% 的样品 23 个,进行复筛得到抑制活性较好的5 个化合物,其化合物编号及其对重组 MTB GuaB2 的抑制率见表 1。

表1 各活性化合物在 10 µg/ml 浓度下对 GuaB2 的抑制率Table 1 The inhibition ratio of recombinant H37Rv GuaB2 activity by 10 µg/ml active compounds
3 讨论
近年来已有研究证明,抑制 IMPDH 的活性可以阻止生命体在生长和增殖过程中所需 GMP 的供应,从而达到治疗癌症、自身免疫性疾病、病原微生物(病毒、原虫以及细菌)感染疾病的目的[8]。目前,微生物体内的 IMPDH 作为抗菌药物发现的潜在靶点越来越受到重视。例如,已经通过 HTS的方法得到了微小隐孢子虫(Cryptosporidium parvum)IMPDH 的有效抑制剂[9-10]。相关研究已经表明,MTB IMPDH 是研发新型抗结核药物的优良潜在靶点,建立以 MTB IMPDH 为靶点的 HTS模型以发现具有 GuaB2 抑制作用的药物对于结核病的治疗将具有重要的意义。
本实验构建了 MTB GuaB2 的表达质粒pBEV::guaB2,纯化得到了可溶性蛋白,依据反应产物 NADH 的吸收特性对 MTB GuaB2 蛋白的活性进行测定。通过对反应体系的优化,建立了GuaB2 抑制剂的 HTS 模型,其 Z’ 因子值达到了0.68。应用该模型,对 1765 个化合物进行了筛选。结果表明,该模型具有微量、快速、灵敏、稳定等特点,为寻找和发现 MTB GuaB2 抑制剂提供了一种新的技术和方法。建立 GuaB2 抑制剂 HTS 模型的最终目的是发现活性先导化合物,利用该模型在我所化合物库中发现了有较强 GuaB2 活性抑制作用的化合物 2 个(抑制率 > 80%),具有进一步深入研究的意义。但是,利用该方法筛选获得的活性化合物,仅能证明其在体外具有 GuaB2 抑制作用,还需要进行更多的研究以全面评价其体内外活性,以便将这些活性化合物开发成新的抗结核药物。
[1] Zhang Y. The magic bullets and tuberculosis drug targets. Annu Rev Pharmacol Toxicol, 2005, 45:529-564.
[2] Das P, Horton R. Tuberculosis--time to accelerate progress. Lancet, 2010, 375(9728):1755-1757.
[3] Sassetti CM, Boyd DH, Rubin EJ. Genes required for mycobacterial growth defined by high density mutagenesis. Mol Microbiol, 2003, 48(1):77-84.
[4] Shu Q, Nair V. Inosine monophosphate dehydrogenase (IMPDH) as atarget in drug discovery. Med Res Rev, 2008, 28(2):219-232.
[5] Cole ST, Brosch R, Parkhill J, et al. Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence. Nature, 1998, 393(6685):537-544.
[6] Sambrook J, Fritsch EF, Maniatis T. Molecular cloning. Jin DY, Li MF, Translation. 2nd ed. Beijing: Science Press, 1992:34-55. (in Chinese)萨姆布鲁克, E.F沸里奇, 曼尼阿蒂斯. 分子克隆实验指南. 金冬燕,黎孟枫, 译. 2版. 北京: 科学出版社, 1992:34-55.
[7] Zhang JH, Chung TD, Oldenburg KR. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. J Biomol Screen, 1999, 4(2):67-73.
[8] Hedstrom L. IMP dehydrogenase: structure, mechanisum, and inhibition. Chem Rev, 2009, 109(7):2903-2928.
[9] Umejiego NN, Gollapalli D, Sharling L, et al. Targeting a prokaryotic protein in a eukaryotic pathogen: identification of lead compounds against cryptosporidiosis. Chem Rev, 2008, 15(1):70-77.
[10] Maurya SK, Gollapalli DR, Kirubakaran S, et al. Triazole inhibitors of Cryptosporidium parvum inosine 5’-monophosphate dehydrogenase. J Med Chem, 2009, 52:4623-4630.
Establishment and application of a novel high-throughput scr eening model targeting to inosine monophosphate dehydrogenase for antitubercular drugs
XIONG Xiao-jiao, ZHOU Shuang, YANG Yan-hui, GUAN Yan, XIAO Chun-ling
ObjectiveTo establish a high-throughput (HTS) screening model targeting inosine monophosphate dehydrogenase (IMPDH) for the discovery of novel antitubercular drugs.MethodsThe H37Rv IMPDH coding gene guaB2 was amplified and cloned into pBEV expression vector. The recombinant GuaB2 protein was expressed in Escherichia coli BL21(DE3)pLysS and itsactivity was measured at 340 nm wavelength absorbance. HTS screening model was established based on the activity of GuaB2 and Z’ factor was used to evaluate the quality of the HTS model. Total of 1765 compounds were screened for the inhibition of GuaB2 activity with the model.ResultsRecombinant H37Rv GuaB2 vector was successfully constructed and expressed, with the optimal enzymatic activity being 736 U/mg for the GuaB2 protein. The parameter Z’ factor was 0.68, suggesting that the HTS model was highly feasible and stable for drug screening. In order to test the HTS model, 1765 compounds were screened and 5 compounds were found to inhibit GuaB2 activity, showing the 0.28% positive rate.ConclusionA steady and sensitive HTS model for potential GuaB2 inhibitors was established. The hits of GuaB2 inhibitors were meaningful to further study.
Anitubercular agents; Hypoxanthines; Drug evaluation, preclinical
XIAO Chun-ling, Email: xiaocl318@163.com
10.3969/cmba.j.issn.1673-713X.2011.06.011
国家“重大传染病防治”科技重大专项(2008ZX10003-006)
100050 北京,中国医学科学院医药生物技术研究所重点室
肖春玲,Email:xiaocl318@163.com
2011-09-28
方法以结核分枝杆菌 H37Rv 基因组为模板,pBEV 表达质粒为载体,将 guaB2 基因克隆至 pBEV 以构建pBEV::guaB2 重组表达质粒,表达并纯化重组的结核分枝杆菌次黄嘌呤单核苷酸脱氢酶;建立以测定反应体系 340 nm吸光值变化速率来评价该酶活性的检定方法;构建次黄嘌呤单核苷酸脱氢酶抑制剂的高通量筛选模型,对该模型的可靠性进行评价并应用该模型对 1765 个化合物进行筛选。
结果成功构建了结核分枝杆菌 guaB2 基因的表达载体;最佳反应条件下重组结核分枝杆菌次黄嘌呤单核苷酸脱氢酶酶比活力为 736 U/mg;所建立的高通量筛选模型 Z’ 因子为 0.68,可用于次黄嘌呤单核苷酸脱氢酶抑制剂筛选;应用此模型对 1765 个化合物样品进行筛选,得到 5 个具有酶抑制活性的样品,阳性率为 0.28%。
结论建立了稳定性好、灵敏度较高的结核分枝杆菌次黄嘌呤单核苷酸脱氢酶抑制剂高通量药物筛选模型,应用该模型筛选得到的阳性药物具有进一步深入研究的意义。
Author Affiliation:State-Key Laboratory for Drug Screening, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences, Beijing 100050, China
www.cmbp.net.cn Chin Med Biotechnol, 2011, 6(6):445-449
