正交试验优选杜仲中绿原酸的提取工艺
2011-04-09孙利伟蔡楠楠
孙利伟,赵 辉,蔡楠楠
(1.河南省新乡市中心医院,河南 新乡 453000; 2.河南大学药学院,河南 开封 475004)
杜仲为杜仲科植物杜仲 Eucommia ulmoides Oliv.的干燥树皮[1],是我国独有的古老珍贵经济树种,绿原酸为其主要有效成分之一[2]。笔者采用正交试验法,以杜仲中绿原酸的含量为考察指标,确定最佳提取工艺,现报道如下。
1 仪器与试药
LC-2010A型高效液相色谱仪,岛津UV检测器(日本岛津);101-2AB型电热鼓风干燥箱(天津泰斯特仪器有限公司);N-1001S型旋转蒸发仪(上海爱朗仪器有限公司);KQ5200DA型数控超声波清洗器(昆山市超声仪器有限公司)。杜仲采自灵宝市中国林科院经济林研究开发中心,经河南大学李钦教授鉴定为杜仲科植物杜仲 Eucommia ulmoides Oliv.;绿原酸对照品(中国药品生物制品检定所,批号为0753-9910);乙腈(色谱纯,merck公司);甲醇(色谱纯,天津四友精细化工试剂厂);水为重蒸水。
2 方法与结果
2.1 绿原酸含量测定
2.1.1 色谱条件
色谱柱:Diamonsil-C18柱(150mm×4.6mm,5μm);流动相:甲醇-水-冰醋酸(17∶83∶1.5);流速:1.0 mL/min;检测波长:237 nm;柱温:25℃;进样量:20μL。在此条件下色谱图见图1,绿原酸保留时间为31.17min。
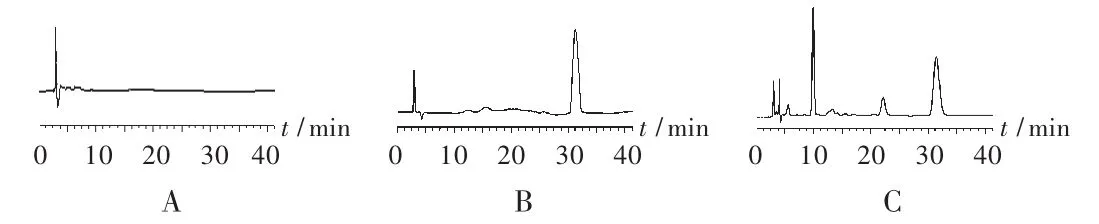
图1 高效液相色谱图
2.1.2 溶液配制
精密称取绿原酸对照品4.70mg,置10mL容量瓶中,加流动相至刻度,摇匀,作为对照品溶液,备用。取本品约1 g,剪成碎片,揉成絮状,精密加入溶剂50mL,称定质量,按试验要求(超声或回流)处理,放冷至室温,再称定质量,用50%甲醇补足减失的质量,摇匀,经0.45μm微孔滤膜滤过,作为供试品溶液。
2.1.3 方法学考察
标准曲线绘制:取2.1.2项下对照品溶液,分别进样1.41μg(3μL),2.35μg(5μL),4.70μg(10μL),7.05μg(15μL),9.40μg(20μL)。以峰面积为横坐标、进样量(μg)为纵坐标进行线性回归。得回归方程为 Y=6.71×10-3+3.07×10-6X,r=0.999 9(n=5)。结果表明,绿原酸的进样量在1.41~9.40μg范围内与峰面积呈良好线性关系。
精密度试验:精密吸取对照品溶液5μL,进样,连续5次,测量峰面积。结果的 RSD=1.4%(n=5),表明仪器精密度良好。
稳定性试验:取同一供试品溶液,分别于0,2,4,8,12h时进样20μL,测定绿原酸峰面积积分值。结果的 RSD=1.38%(n=5),表明供试品溶液在12h内稳定。
加样回收试验:取同一批已知含量的杜仲粉末6份,分别加入0.47 g/L的对照品溶液1mL,按供试品溶液制备方法制得溶液,测定含量并计算,结果见表1。
2.1.4 样品含量测定
按照最佳工艺条件,20%甲醇超声方法提取2次,每次1h,提取后,经测定,杜仲中绿原酸含量为2.28%。
2.2 正交试验设计与结果
绿原酸极性大,经预试,选取4个因素2个水平,以L8(2)7正交表安排试验,因素水平表见表2,试验结果见表3,方差分析见表4,
二元表见表5。
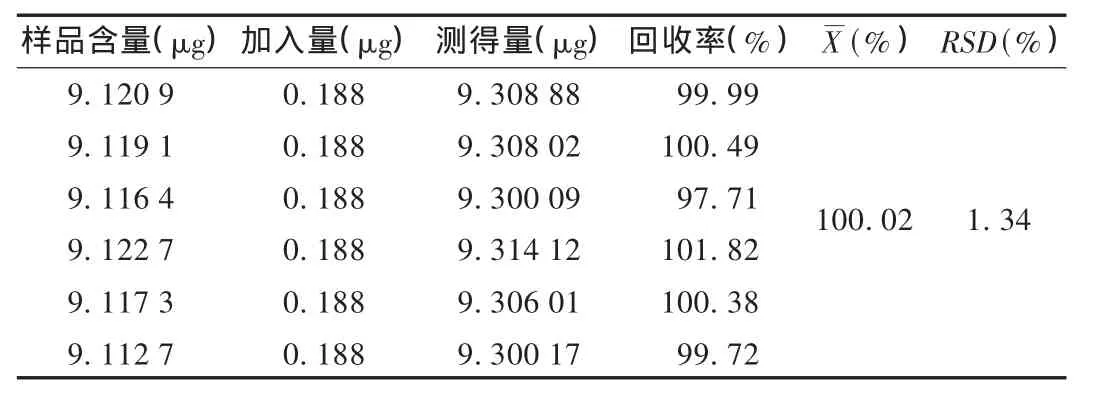
表1 绿原酸加样回收试验结果(n=6)
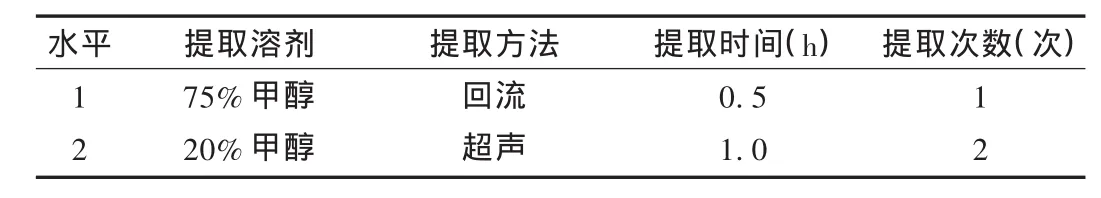
表2 因素水平表

表3 正交试验表及结果
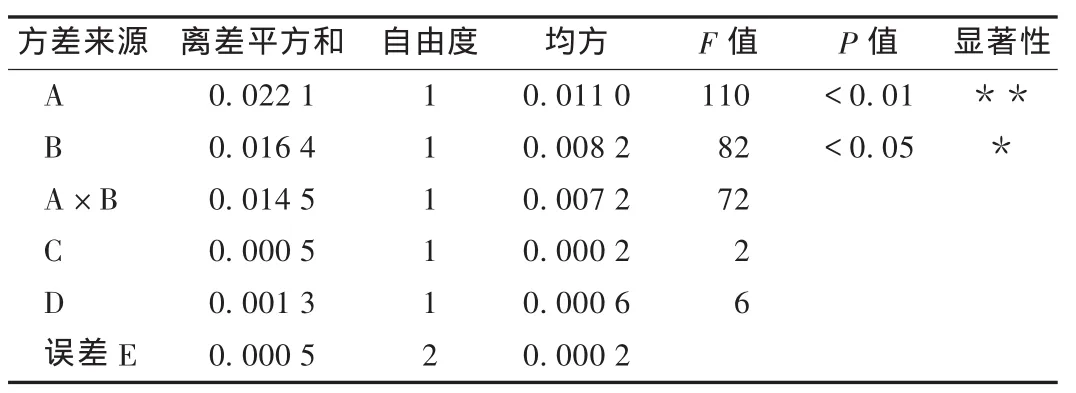
表4 方差分析表

表5 A和B的二元表(%)
3 讨论
绿原酸极性较大,水溶性好,既易溶于水,又易溶于乙醇、丙酮、甲醇等极性溶剂,微溶于乙酸乙酯,难溶于三氯甲烷、乙醚、苯等亲脂性有机溶剂。有研究显示,60%甲醇水溶液回流提取效率高[3]。亦有研究显示,30%乙醇溶液超声提取法简便,与回流比较二者无显著性差异[4]。笔者对同一批杜仲分别用10%甲醇、25%甲醇、50%甲醇、75%甲醇、100%甲醇、10%乙醇、25%乙醇、50%乙醇、75%乙醇、100%乙醇分别进行回流提取0.5h共2次,结果分别为2.19%,2.16%,2.11%,2.05%,2.11%,1.93%,1.94%,1.89%,1.90%,1.87%;以上述10种不同浓度的甲醇、乙醇溶液超声处理杜仲样品2次,每次0.5h,结果分别为1.87%,1.88%,1.78%,1.69%,1.69%,1.77%,1.80%,1.79%,1.73%,1.74%。两种方法比较,发现甲醇平均提取率高于乙醇;对不同浓度的甲醇测定结果比较,发现不论回流提取还是超声提取,甲醇浓度低时结果偏高,随着甲醇浓度的不断上升,提取效果变化不明显,且从本次试验结果判断,无规律可循。考虑方便于较大量提取时的浓缩工作,对甲醇高、低两种浓度进行考察,而不选择经济但不利于较大批量浓缩的水和成本较高的纯甲醇。
在提取时间上,对同一批杜仲分别回流提取0.5,1,1.5,2h,各提取 2次,含量测定结果分别为 2.10%,2.24%,2.25%,2.23%,可见随着时间延长,提取率无明显变化。在提取次数上,通过试验结果比较,对同一批杜仲以50%甲醇为溶剂,回流提取1h,次数分别为1,2,3次,含量测定结果分别为1.81%,2.25%,2.25%,可见提取次数增多,提取效果差异不明显,且提取2次效果明显优于提取1次。
由表2和表3数据分析显示,根据极差 R的大小,判断各因素及交互作用的主次关系为A>B>A×B>D>C,可见A×B也是影响试验结果的重要因素,为此列二元搭配均值表。方差分析结果显示,提取方法(因素A)对绿原酸的提取效果影响最大,考虑交互作用,最佳工艺条件为A2B2C2D2,即20%甲醇超声提取2次,每次1h,提取效率与直观分析结果一致。
彭密军等[5-6]用正交试验法对杜仲中的活性成分京尼平苷酸及桃叶珊瑚苷的提取工艺进行了优选研究,确定了最佳提取工艺。叶文峰等[7]用正交试验方法探讨了以乙醇为溶剂提取杜仲叶中黄酮类化合物的最佳工艺条件。本试验以杜仲中绿原酸的含量为考察指标,确定了最佳提取工艺,从而为杜仲的综合开发利用提供了一定的理论依据。
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2005:154.
[2]杜红岩.杜仲活性成分与药理研究的新进展[J].经济林研究,2003,21(2):58.
[3]刘圣金,狄留庆,吴德康,等.高效液相色谱法测定杜仲中绿原酸的含量[J].中国中医药信息杂志,2006,13(1):45.
[4]白 梅.陕西产杜仲中绿原酸含量测定研究[J].陕西农业科学,2009(5):71.
[5]彭密军,周春山,雷启福,等.杜仲中京尼平苷酸的提取工艺研究及应用[J].中国中药杂志,2004,29(3):229-231.
[6]彭密军,周春山,钟世安,等.杜仲中桃叶珊瑚苷的提取工艺研究[J].林产化学与工业,2003,23(3):65-68.
[7]叶文峰,陈 新,刘秀娟,等.杜仲叶中黄酮类化合物的提取工艺[J].江西师范大学学报(自然科学版),2001,25(1):69-71.
