高效液相色谱法测定蛋鸭组织中的类胡萝卜素
2011-04-06任真明潘思轶王可兴
薛 峰,李 晨,江 沛,王 多,任真明,潘思轶,王可兴
(华中农业大学食品科学技术学院,湖北 武汉 430070)
高效液相色谱法测定蛋鸭组织中的类胡萝卜素
薛 峰,李 晨,江 沛,王 多,任真明,潘思轶,王可兴*
(华中农业大学食品科学技术学院,湖北 武汉 430070)
通过响应面分析法对蛋鸭肝脏组织中类胡萝卜素的提取方法进行优化。利用响应面试验设计考察提取时间、提取温度、皂化液质量浓度对总类胡萝卜素提取率的影响。结果表明:蛋鸭肝脏组织中类胡萝卜素提取最优条件为提取时间90min、提取温度37℃、皂化液质量浓度50g/100mL;建立的采用反相高效液相色谱测定蛋鸭肝脏组织和血清中类胡萝卜素的方法的检出限为20ng/mL,在肝脏组织和血清样品中的加标回收率分别为95.21%和105.50%,相对标准偏差分别为5.71%和6.73%。
蛋鸭;肝脏;血清
类胡萝卜素是一种脂溶性色素,其主要由细菌、霉菌、藻类和绿色植物合成[1]。目前,在自然界中被鉴定的类胡萝卜素有600多种[2]。早期类胡萝卜素被认为具有VA活性,然而近年来人们发现大多数的类胡萝卜素都不具备VA活性[3]。这些不具备VA活性的类胡萝卜素,除了可以清除自由基外,还可以降低患白内障的风险[4]。但是,关于些类类胡萝卜素在动物体内的降解途径仍不清楚。因此,近年来国外的研究开始集中于构建合适的动物模型,用以研究不具备VA活性的类胡萝卜素的生物代谢途径。
与哺乳动物一样,禽类自身不能合成类胡萝卜素,只能从食物中获取[5]。通常,禽类选择性的富集含氧类胡萝卜素[6]。例如,Slifka等[7]研究发现,野生禽类体内只富集叶黄素、玉米黄质、角黄素和隐黄质。这一现象的产生,可能与禽类的饮食结构有关。禽类大多以玉米或玉米制品为主要食物来源[8]。而在玉米和玉米制品中的类胡萝卜素主要为含氧类胡萝卜素[9]。因此,禽类可能成为研究含氧类胡萝卜素在动物体内的吸收、运输和代谢的理想模型。
我国是禽蛋生产和消费的大国[10]。禽蛋及其制品由于具有了良好的风味和极高的营养价值,一直深受人们的喜爱。禽蛋通常呈现黄色,是人体内类胡萝卜素少数动物性来源之一。因此,研究类胡萝卜素在蛋鸭体内的富集机理,有助于更好地掌握天然色素在动物体内的富集规律,从而为人类提供更具营养价值的食物[11]。目前,尚无相关文献报道蛋鸭组织中类胡萝卜素的分析方法。因此,本实验在参照其他动物组织类胡萝卜素分析方法[14]的基础上,采用响应面优化蛋鸭组织类胡萝卜素提取工艺,并建立蛋鸭组织中类胡萝卜素的分析方法。
1 材料与方法
1.1 材料与试剂
选取14月龄的江南二号蛋鸭(由湖北省武汉市江夏区鸭场提供)为动物模型。
正己烷(分析纯) 国药集团化学试剂有限公司;甲醇、甲基叔丁基醚(色谱纯) 美国Tedia公司;β-胡萝卜素标准品(纯度>97%) 德国E.Merck公司。
1.2 仪器与设备
752紫外分光光度计 上海精密科学仪器有限公司;高效液相色谱系统(配有二极管阵列检测器和四元高压梯度泵) 美国Waters公司;C30色谱柱(4.6mm×150mm,3μm) 爱尔兰YMC公司。
1.3 方法
1.3.1 样品采集
蛋鸭经颈静脉放血宰杀,取血样和肝脏组织。肝脏组织用9g/L NaCl溶液清洗,擦干后放置于-76℃保存。血样经4℃、5000×g离心5min后,取血清置于-76℃保存。
1.3.2 肝脏组织中类胡萝卜素提取正交试验设计
关于动物组织中类胡萝卜素的提取常采用高温皂化的方法[12-13]。皂化的主要目的如下:第一,通过皂化可以使组织中的脂肪水解,从而纯化用于分析检测的类胡萝卜素样品;第二,通过皂化可以使组织细胞完全破碎,从而提高类胡萝卜素的提取率;第三,通过皂化可以使组织内酯化形式的类胡萝卜素游离出来,从而消除类胡萝卜素酯在分析过程中的干扰,实现对类胡萝卜素的准确定性。例如Deming等[12]采用60℃、25min皂化来提取沙土鼠组织中的类胡萝卜素,White等[13]采用70℃、30min皂化来提取雪雕组织中类胡萝卜素。但是,在本实验室条件下,高温皂化常常引起类胡萝卜素的异构化和降解。因此,本实验采用较为温和的条件进行蛋鸭组织中类胡萝卜素的提取。
蛋鸭肝脏组织中类胡萝卜素提取过程简述如下:称取蛋鸭肝脏组织2g,加入5mL无水乙醇(含1g/L 2,6-二叔丁基-4-甲基苯酚),均质后加入1mL一定质量浓度的KOH溶液,进行水浴皂化,皂化后的样品迅速冷却并加入3mL冷却水,之后分别加入5mL正己烷进行3次提取,合并提取液,将提取液在氮气中挥干,加入2mL甲基叔丁基醚复溶样品,在450nm波长处测定吸光度A样。同时,取等量肝脏,均质后加入正己烷多次提取,直至提取液为无色。合并提取液后在氮气中挥干,用2mL甲基叔丁基醚复溶样品,在450nm波长处测定吸光度A对照,并以此为完全提取的对照品。
在单因素试验的基础上,选取皂化时间、皂化温度以及KOH质量浓度为正交试验因素,以类胡萝卜素的提取率为考察指标,选用3因素Box-Behnken[14]正交试验设计优化肝脏类胡萝卜素提取方法(表1)。

表1 响应面法试验设计因素和水平Table 1 Factors and levels in response surface analysis
1.3.3 提取率计算

1.3.4 肝脏组织中类胡萝卜素提取
提取条件按照正交得到的回归模型预测的极值条件进行提取,提取液在氮气中挥干,最后用1mL无水乙醇复溶样品,过0.22μm滤膜进行高效液相色谱(high performance liquid chromatography,HPLC)分析。
1.3.5 血清中类胡萝卜素提取
取血清2mL加入10mL无水乙醇(含1g/L 2,6-二叔丁基-4-甲基苯酚)脱除蛋白质,之后分别加入5mL正己烷进行3次提取,合并提取液后将提取液在氮气中挥干,最后用1mL无水乙醇复溶样品,过0.22μm滤膜进行HPLC分析。
1.3.6 色谱条件
C30色谱柱;采用二极管阵列检测器检测,波长为250~550nm;进样量50μL;柱温25℃;流动相、流速及梯度洗脱程序见表2。
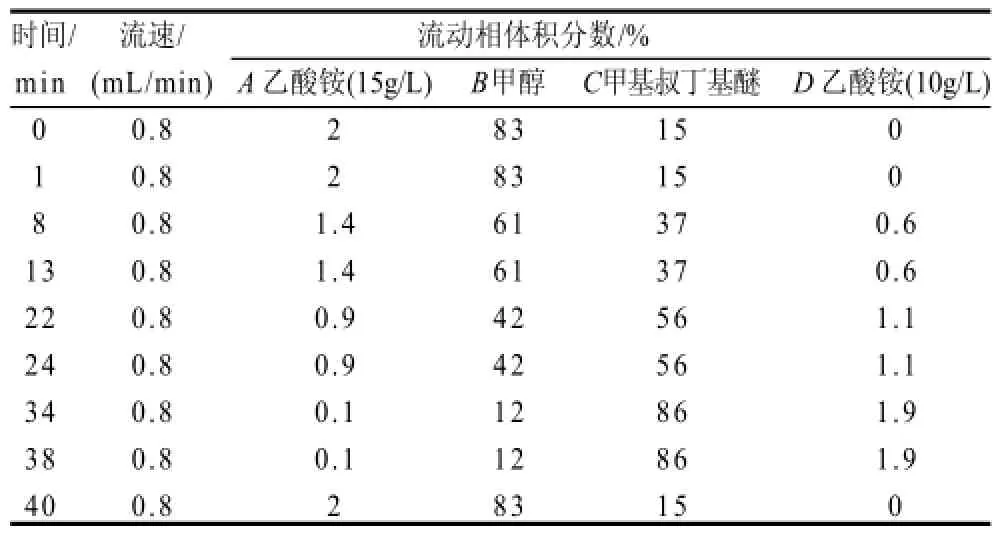
表2 HPLC梯度洗脱程序Table 2 HPLC gradient conditions for carotenoids separation
2 结果与分析
2.1 肝脏组织类胡萝卜素提取正交试验
Box-Behnken试验设计结构矩阵及类胡萝卜素得率结果见表3,对表3的数据进行整理运算,建立得率Y与调控因子Xi之间的回归方程式为:Y=-761.67+4.57X1+13.61X2+14.91X3-0.02X1X2+0.01X1X3+0.01X2X3-0.02-0.17-0.16。

表3 响应面试程设计方案与结果Table 3 The experimental design and corresponding results for response surface analysis
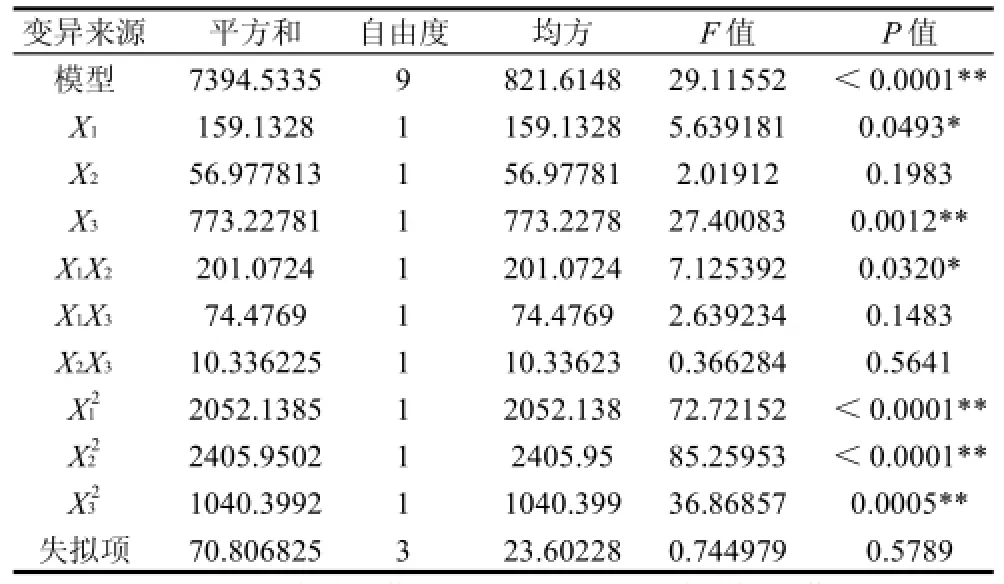
表4 回归模型方差分析Table 4 Variance analysis of the fitted regression model
由表4可知,该方程对试验拟合情况好(模型P<0.0001),试验误差小,因此可用该回归方程对试验结果进行分析和预测。同时,软件分析得到失拟项P值为0.5789>0.05,未达到显著水平,且决定系数R2=0.9740,表明试验设计合理。在一次项中,皂化时间(X1)对肝脏组织类胡萝卜素提取率影响达到显著水平(P<0.05),皂化液质量浓度(X3)对提取率影响极显著,皂化温度(X2)影响不显著,二次项均对肝脏组织类胡萝卜素提取率影响达到极显著水平(P<0.01)。交互项中皂化时间和皂化温度的交互作用对肝脏组织类胡萝卜素提取率影响显著。回归模型预测的肝脏组织类胡萝卜素提取率的极值条件为皂化时间93.77min、皂化温度37.57℃、皂化液质量浓度53.33g/100mL,此条件下的提取率为106.08%。对方程预测值进行验证实验,即皂化时间90min、皂化温度37℃、皂化液质量浓度50g/100mL,3次平行实验的平均值为(102.13±2.32)%,与理论值接近,表明该模型能够反映预期优化。
2.2 肝脏组织与血清类胡萝卜素高效液相色谱分析
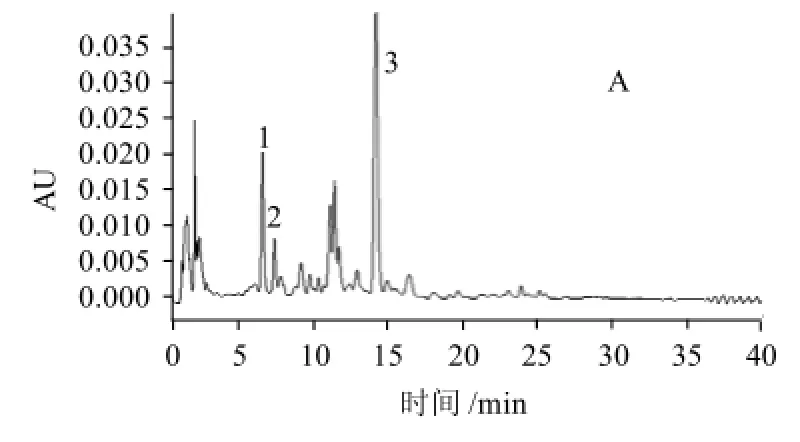
肝脏组织和血清HPLC色谱图见图1,其主要类胡萝卜素的光谱图见图2。根据保留时间,二极管阵列检测器扫描图谱获得类胡萝卜素的特征吸收以及与标准品的比对,参考文献[16-18]等,初步推断肝脏组织中主要类胡萝素为叶黄素、玉米黄质和β-胡萝卜素。血清中只检测到叶黄素和玉米黄质。由图1可知,采用该方法可以将类胡萝卜素与其他脂溶性成分以及类胡萝卜素的降解产物很好的分离。

图1 肝脏组织(A)和血清(B)的HPLC图Fig.1 HPLC chromatograms of duck liver and serum samples
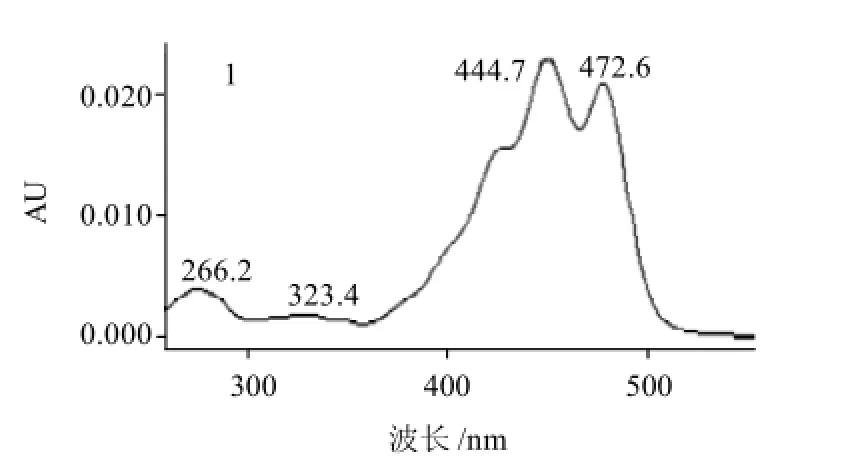

图2 肝脏组织和血清中主要类胡萝卜素光谱图Fig.2 UV scanning spectra of carotenoids in duck liver and serum
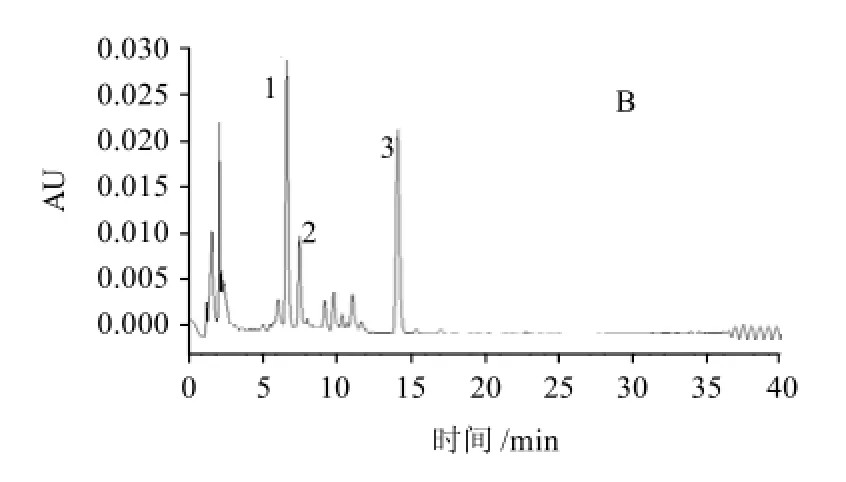
图3 肝脏组织(A)和血清(B)加标(2μg/mL)后的HPLC色谱图Fig.3 HPLC chromatograms of duck liver tissue and serum samples with the addition ofβ-carotene (2μg/mL)
2.3 分析方法评价
2.3.1 回归方程和检出限
将β-胡萝卜素标准品用无水乙醇配制成8个质量浓度梯度的工作液,质量浓度范围为0.05~15.00μg/mL。将各质量浓度工作液按照上述HPLC条件进行分析,以峰面积为横坐标、质量浓度为纵坐标,可得回归方程Y=6×10-6X+0.0183(R=0.9995)。可见采用该色谱条件,在0.02~15.00μg/mL范围内呈现良好的线性关系。因此,可以采用此色谱条件对该质量浓度范围内的样品进行分析。
对上述工作液继续稀释并进行HPLC分析,直到信噪比为3时,记录所进样品质量浓度,即为该方法的检出限。本方法所测检出限为20ng/mL。
2.3.2 加标回收率实验
分别在肝脏组织和血清中添加1mL上述8个质量浓度梯度的β-胡萝卜素标准溶液,进行加标回收实验[18]。图3为添加2μg/mL β-胡萝卜素标准品溶液时肝脏组织和血清的高效液相色谱图。回收率测定结果显示:肝脏组织加标回收率平均值为95.21%,血清加标回收率平均值为105.50%。由此可知,由于肝脏组织需要皂化处理,在皂化过程中会导致部分类胡萝卜素的损失[20]。
2.3.3 精密度实验
在肝脏组织和血清中加入2μg/mL β-胡萝卜素工作液1mL,然后在同1d内重复5次测定β-胡萝卜素的含量,用以检测样品测定时的重现性[21]。结果见表5。由表5可知,在肝脏组织和血清样品测试中,其精密度分别为5.71%和6.73%。由此可知,该方法在1d内测定的重现性较好。
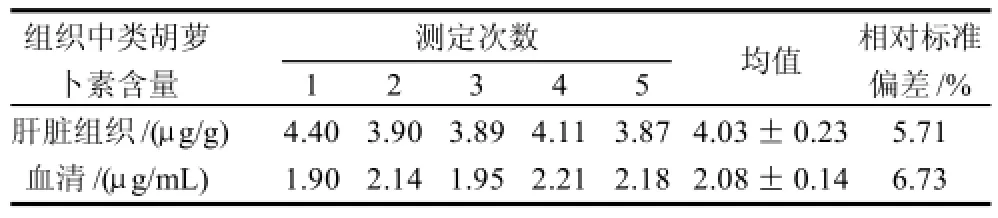
表5 肝脏组织和血清中β-胡萝卜素测定精密度Table 5 Precision of carotenoids determination in duck liver and serum by the established HPLC method
3 结 论
本实验通过正交试验得出蛋鸭肝脏组织中类胡萝卜素提取的最优条件,即皂化时间90min、皂化温度37℃、皂化液质量浓度50g/100mL。通过皂化处理,样品在乙醇中溶解性良好,类胡萝卜素的提取率较多次均质提取提高了2.13%,且在色谱图中未检测到类胡萝卜素酯类物质。并在此基础上建立了蛋鸭肝脏组织和血清组织中类胡萝卜素的分析方法。蛋鸭肝脏组织中主要类胡萝卜素为叶黄素、玉米黄质以及β-胡萝卜素,而血清中只检测到叶黄素和玉米黄质。此外,通过对该方法的评价可知:此方法在0.05~15.00μg/mL范围内具有良好的线性度;此方法的检出限为20ng/mL;肝脏组织和血清样品的回收率分别为95.21%和105.50%;肝脏组织和血清样品测定的精密度分别为5.71%和6.73%。
[1]OLSON J A. Provitamin A function of carotenoids∶ the conversion ofβcarotene into vitamin A[J]. J Nutr, 1989, 119(1)∶ 105-108.
[2]STAHL W, SIES H. Bioactivity and protective effects of naturalcarotenoids[J]. Biochimica et Biophysica Acta, 2005, 1740(2)∶ 101-107.
[3]BHOSALE P, BERNSTEIN P S. Vertebrate and invertebrate carotenoid-binding proteins[J]. Arch Biochem Biophys, 2007, 458(2)∶ 121-127.
[4]DOREY C K, GRANATA L, NICHOLS C R, et al. Dietary modulation of lens zeaxanthin in quail[J]. Exp Eye Res, 2005, 81(4)∶ 464-477.
[5]WILLIAMS A W, BOILEAU T W, ERDMAN J W Jr.. Factors influencing the uptake and absorption of carotenoids[J]. P Soc Exp Biol Med, 1998, 218(2)∶ 106-108.
[6]Van het HOF K H, WEST C E, WESTSTRATE J A, et al. Dietary factors that affect the bioavailability of carotenoids[J]. J Nutr, 2000, 130 (3)∶ 503-506.
[7]SLIFKA K A, BOWEN P E, STACEWICZ-SAPUNTZAKIS M, et al. A survey of serum and dietary carotenoids in captive wild animals[J]. J Nutr, 1999, 129(2)∶ 380-390.
[8]SURAI P F, SPESKE B K, SPARKS N H C. Carotenoids in avian nutrition and embryonic development 1[J]. J Poult Sci, 2001, 38(1)∶ 1-27.
[9]ANIKET K, FANGYI Z, MUNIR C. Separation of high-value products from ethanol extracts of corn by chromatography[J]. Ind Crop Prod, 2007, 26(1)∶ 44-53.
[10]刘良忠. 天然红心蛋中红色类胡萝卜素的结构表征及其生物活性评价[D]. 武汉∶ 华中农业大学, 2007.
[11]SAHINA N, AKDEMIRA F, ORHAN C, et al. Lycopene-enriched quail egg as functional food for humans[J]. Food Res Int, 2008, 41(3)∶ 295-300.
[12]DEMING D M, TEIXEIRA S R, ERDMAN J W. All-transβ-carotene appears to be more bioavailable than 9-cis or 13-cisβ-carotene in gerbils given single oral doses of each isomer[J]. J Nutr, 2002, 132(9)∶2700-2708.
[13]WHITE W S, PECK K M, BIERER T L, et al. Interactions of oral betacarotene and canthaxanthin in ferrets[J]. J Nutr, 1993, 123(8)∶ 1405-1413.
[14]YEUM K J, AHN S H, RUPP DE PAIVA S A, et al. Correlation between carotenoid concentrations in serum and normal breast adipose tissue of women with benign breast tumor or breast cancer[J]. J Nutr, 1998, 128 (11)∶ 1920-1926.
[15]何轩辉, 廖森泰, 刘吉平, 等. 应用Box-Behnken组合设计优化金针菇粗多糖提取条件[J]. 食用菌学报, 2008, 15(3)∶ 64-67.
[16]YEUM K J, BOOTH S L, SADOWSKI J A, et al. Human plasma carotenoid response to the ingestion of controlled diets high in fruits and vegetables[J]. Am J Clin Nutr, 1996, 64(4)∶ 594-602.
[17]MELENDEZ-MARTINEZ A J, BRITTON G, VICARIO I M, et al. The complex carotenoid pattern of orange juices from concentrate[J]. Food Chem, 2008, 109(3)∶ 546-553.
[18]Zhou Jingyi, SUN Chongde, ZHANG Lanlan, et al. Preferential accumulation of orange-colored carotenoids in Ponkan (Citrus reticulata) fruit peel following postharvest application of ethylene or ethephon[J]. Sci Hortic-Amsterdam, 2010, 126(2)∶ 229-235.
[19]FROESCHEIS O, MOALLI S, LIECHTI H, et al. Determination of lycopene in tissues and plasma of rats bynormal-phase high-performance liquid chromatography with photometric detection[J]. J Chromatogr B, 2000, 739(2)∶ 291-299.
[20]FERNANDEZ R X E, SHIER N W, WATKINS B A. Effect of alkali saponification, enzymatic hydrolysis and storage time on the total carotenoid concentration of costa rican crude palm oil[J]. J Food Compos Anal 2000, 13(2)∶ 179-187.
[21]VERTZONI M V, REPPAS C, ARCHONTAKI H A. Optimized determination of lycopene in canine plasma using reversed-phase high-performance liquid chromatography[J]. J Chromatogr B, 2005, 819(1)∶ 149-154.
Analysis of Carotenoids in Laying Duck Tissues Using High Performance Liquid Chromatography
XUE Feng,LI Chen,JIANG Pei,WANG Duo,REN Zhen-ming,PAN Si-yi,WANG Ke-xing*
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
With the aim of developing an optimal sample preparation method for the determination of carotenoids in laying duck liver tissues by high performance liquid chromatography, response surface methodology was employed to optimize the extraction recovery of carotenoids from laying duck liver tissues with respect to three extraction conditions such as temperature, extraction time and KOH concentration. The optimal extraction conditions were achieved as follows∶ extraction time 90 min, temperature 37 ℃ and KOH concentration 50 g/100 mL. The HPLC method established based on these extraction conditions exhibited a detection limit of 20 ng/mL for carotenoids in the liver and serum laying duck. The mean spike recovery rates for carotenoids in the liver tissues and serum laying duck were 95.21% and 105.50% with a relative standard deviation (RSD) of 5.71% and 6.73%, respectively.
egg-laying duck;liver;serum
Q584
A
1002-6630(2011)14-0185-05
2011-01-03
国家自然科学基金面上项目(30972044)
薛峰(1985—),男,博士研究生,研究方向为农产品加工及贮藏。E-mail:xuefengscholar@126.com
*通信作者:王可兴(1963—),男,工程师,本科,研究方向为农产品加工及贮藏。E-mail:wangkx@mail.hzau.edu.cn
