海洋拟诺卡氏菌株HY-G转化大豆异黄酮苷发酵条件的优化
2011-04-01吴少杰焦豫良马桂珍王淑军
吴少杰,焦豫良,朱 强,马桂珍,王淑军
(淮海工学院海洋学院,江苏 连云港 222005)
海洋拟诺卡氏菌株HY-G转化大豆异黄酮苷发酵条件的优化
吴少杰,焦豫良,朱 强,马桂珍,王淑军
(淮海工学院海洋学院,江苏 连云港 222005)
目的:优化大豆异黄酮苷微生物转化的发酵条件。方法:利用本实验室筛选出的海洋拟诺卡氏菌株HY-G进行生物转化,采用单因素和正交试验,对发酵条件和培养基组成及条件进行优化。结果:筛选的最佳发酵工艺为在高氏一号基础培养基中加入1g/100mL蔗糖、0.03g/100mL硫酸铵和200mg/L诱导物的培养基进行培养,培养基装液量150mL/250mL,起始pH8.0,培养温度40℃,摇瓶转速120r/min,培养72h。优化后的酶活力分别达3621U/mL(对染料木素)和4862U/mL(对大豆苷元)。结论:经过优化,得出了较好的产酶发酵工艺,有利于进一步采用大规模发酵法转化大豆异黄酮苷元。
拟诺卡氏菌株HY-G;大豆异黄酮;水解酶;生物转化;发酵条件
大豆是一种历史悠久的传统食品,其中富含蛋白质和脂类等营养成分及多种生理活性物质,大豆异黄酮(soybeans isoflavones,SI)是大豆的主要功能性活性成分之一。大豆异黄酮具有人类雌性激素相似的结构和生理活性而被称之为植物性雌激素。大豆异黄酮能够用于防治多种疾病,例如癌症、妇女更年期综合症、心脑血管疾病及骨质疏松等[1-3]。
目前从豆类中分离得到的大豆异黄酮包含12种异黄酮类成分,其母体为3种异黄酮苷元,即染料木素(genistein)、大豆苷元(daidzein)和黄豆黄素(glycitein),这3种苷元又分别与含有不同修饰基团的葡萄糖基相结合,形成9种异黄酮苷类,统称为染料木苷(genistin)、大豆苷(daidzin)和黄豆黄苷(glycitin)。大豆中95%~99%的异黄酮都是以苷的形式存在,苷元的含量很少[4]。大豆异黄酮的存在形式对其生物活性和生物利用度有着显著的影响。研究表明,苷元形式的大豆异黄酮比大豆异黄酮苷具有更好的吸收速率[5],将大豆异黄酮苷转化成苷元能显著提高其吸收效率和生物利用度[6-7];体外实验也表明,大豆异黄酮苷元比大豆异黄酮苷具有更好的雌激素样生物活性[8]。尽管这方面还存在一定的争议[9],但是国内外许多研究者都致力于提高各种大豆食品中异黄酮苷元的含量[10]。目前市场上,大豆异黄酮苷元的价格也远远高于大豆异黄酮苷[11]。
本实验室从海洋放线菌中筛选到一株高产大豆异黄酮苷水解酶的菌株HY-G,经鉴定属于较为稀有的海洋拟诺卡氏菌属(Nocardiopsis sp.)。研究表明,该菌株所产的大豆异黄酮苷水解酶是一种较特殊的β-葡萄糖苷酶,具有与其他来源的β-葡萄糖苷酶所不同的性质,可能是一种新酶。本实验对海洋拟诺卡氏菌株HY-G产生大豆异黄酮苷转化酶的发酵条件进行研究,以期为利用该菌株转化大豆异黄酮苷、生产高价值的大豆异黄酮苷元提供基础。
1 材料与方法
1.1 试剂与仪器
染料木苷(genistin)、大豆苷(daidzin) 石家庄工大生物制品有限公司;染料木素、大豆苷元标准品 上海同田生物技术有限公司;硅胶薄层层析板 安徽皖西硅源材料厂;其他药品均为分析纯。
CR22G高速冷冻离心机 日本日立公司;SPX-250B生化培养箱 上海跃进医疗器械厂;HZQ-F160全温振荡培养箱 舟山市定海区海源仪器厂;HD2200型超声波细胞破碎仪 宁波新芝生物科技股份有限公司;CS-9301PC双波长飞点扫描薄层分析仪(配有CS-9301数据处理工作站) 日本岛津公司。
1.2 菌株与培养基
海洋拟诺卡氏菌(Nocardiopsis sp.)菌株HY-G,由本实验室分离自海洋环境,目前保存在中国典型培养物保藏中心(保藏号:CCTCC 2010126)。
固体斜面培养基(海水高氏一号合成培养基):可溶性淀粉20g、KNO31g、NaCl 0.5g、K2HPO40.5g、MgSO4·7H2O 0.5g、FeSO4·H2O 0.01g、琼脂粉20g、海水1000mL,pH7.4~7.6。
液体发酵培养基:在不加琼脂的海水高氏一号合成培养基中,添加一定量的大豆异黄酮苷作为产酶诱导物,诱导产生大豆异黄酮苷水解酶。
1.3 方法
1.3.1 菌种的发酵
采用摇瓶发酵法,在250mL三角瓶中加入一定体积的液体培养基,接种后,于37℃、120r/min培养48~72h。
1.3.2 胞内酶的提取
上述液体发酵培养物于8000r/min离心10min,收获菌体。菌体用0.1mol/L pH6.8的Tris-HCl缓冲溶液洗涤两次并离心后,加入5mL的上述缓冲液重新悬浮菌体,在冰浴的条件下,用超声波细胞破碎仪破碎菌体细胞,操作条件为:功率100W、破碎10s,间隔5s。然后在12000r/min条件下离心20min除去菌体碎片,上清液即为粗酶液。
1.3.3 糖苷型大豆异黄酮的酶水解
用0.1mol/L的Tris-HCl(pH6.8)缓冲液将大豆异黄酮苷配成质量浓度约10mg/mL的底物溶液(可加适量乙醇助溶)。取0.5mL粗酶液和0.5mL底物溶液混合,40℃反应1h后,用2mL乙酸乙酯萃取水解产物。取萃取物10~20μL作薄层层析(thin layer chromatography,TLC)。展开剂为氯仿与甲醇体积比10:7,展开约6cm后,挥干溶剂,用双波长薄层扫描仪扫描,根据斑点面积的积分值计算酶活力。
1.3.4 大豆异黄酮苷元的测定
首先配制不同质量浓度的染料木素和大豆苷元标准溶液,然后分别取各质量浓度的染料木素和大豆苷元标准溶液20μL作薄层层析展开后进行薄层扫描测定。测定时,采用反射单波长锯齿扫描法,测定波长为260nm,光斑大小为0.07mm×0.07mm。所得到的测定数据通过仪器自带的CS-9301软件进行底线校正、峰面积计算等处理,得出大豆异黄酮苷元的峰面积值。分别以染料木素和大豆苷元的质量m(μg)为横坐标、薄层扫描峰面积A为纵坐标,绘制标准曲线,得染料木素和大豆苷元的回归方程分别为A = 20.355746+224.86243m (R2=0.99597)、A=70.932704+224.69326m(R2=0.99538)。通过上述回归方程,计算出样品液中的大豆异黄酮苷元含量,进而计算酶活力。
1.3.5 酶活力的测定
分别以染料木苷和大豆苷为底物,酶活力的测定按照1.3.4节方法进行。酶活力单位的定义是在上述测定条件下,每小时释放1nmol水解产物的酶量定义为一个酶活力单位(U),即:
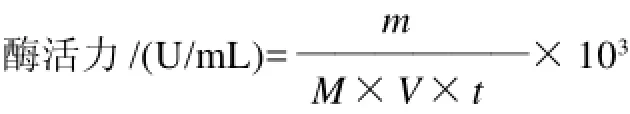
式中:m为产物的生成总质量/μg;M为产物的摩尔质量/(g/mol);t为酶反应时间/h;V为酶液体积/mL。
1.3.6 单因素及正交试验
通过单因素试验,得出最佳的培养基组成(碳源和氮源的种类与质量浓度、产酶诱导物的质量浓度等)。利用上述培养基组成,分别研究了培养基起始pH值、培养温度、摇瓶转速、培养时间4个因素的作用水平。在单因素研究基础上,选定培养时间、起始pH值、装液量、培养温度为因素,进行了L9(34)正交试验,因素水平设计表见表1。

表1 正交试验因素水平表Table 1 Factors and levels in orthogonal array design
2 结果与分析
2.1 培养基成分对产酶的影响
2.1.1 碳源对产酶的影响
以不含可溶性淀粉的海水高氏一号液体发酵培养基为基础,分别加入1mL/100mL的10°麦芽汁和1g/100mL的葡萄糖、蔗糖、可溶性淀粉、麦麸作为碳源,氮源为0.1g/100mL的硝酸钾,按照1.3.1节发酵方法培养48h后测定其酶活力,以在高氏一号培养液体发酵基中的酶活力作为100%,结果如表2所示。
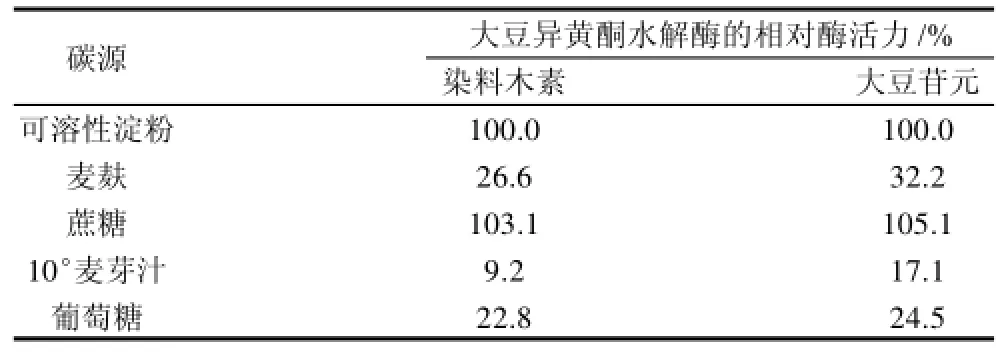
表2 不同碳源对大豆异黄酮苷水解酶产酶的影响Table 2 Effect of carbon source on the production of hydrolases for SI
从表2可见,淀粉、蔗糖对于产酶有促进作用,而葡萄糖、麦麸、麦芽汁不利于产酶,这可能与微生物的葡萄糖效应有关,即当培养基中存在着更容易利用的糖(如葡萄糖)时,微生物就较少产生利用其他糖的酶类。在葡萄糖存在的情况下,微生物产生大豆异黄酮苷酶分解大豆异黄酮获得葡萄糖的压力不大,因而影响产酶。
2.1.2 氮源对产酶的影响
以不含硝酸钾的海水高氏一号液体发酵培养基为基础,以可溶性淀粉为碳源,分别添加0.1g/100mL的NaNO3、(NH4)2SO4、蛋白胨、酵母膏和牛肉膏为氮源,按照1.3.1节发酵方法进行培养48h后测定其相对酶活力,以在高氏一号培养基中的酶活力作为100%,结果见表3。该菌株能够很好地利用无机氮源,产生的酶活力远远高于以有机氮为氮源、而且无论是对无机氮源中的硝态氮还是氨态氮,都能够很好地利用,其中以硫酸铵为氮源最好;而有机氮源中,以蛋白胨为氮源产酶活力最高。由于有机氮源价格低廉,因此,在采用发酵法转化大豆异黄酮时,该菌株有着较大的优势。
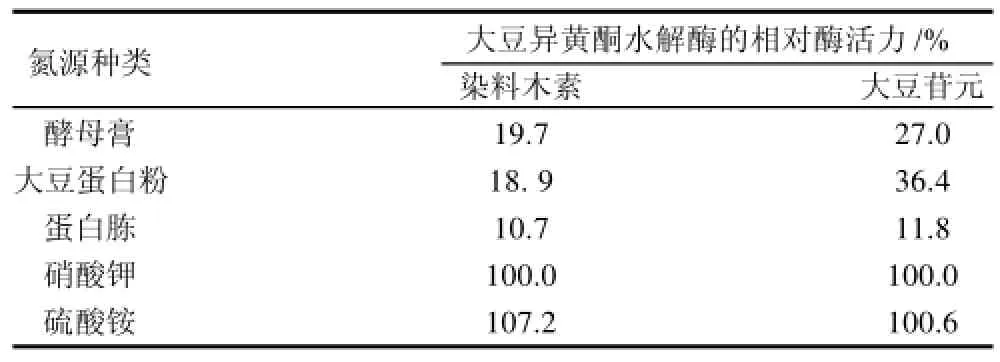
表3 不同氮源对大豆异黄酮苷水解酶产酶的影响Table 3 Effect of nitrogen source on the production of hydrolases for SI
2.1.3 最佳碳源和氮源作用的质量浓度
为了解最佳碳源和氮源最适添加量,根据上述结果确定的最佳碳源和氮源,在不含氮源和碳源的海水高氏一号液体培养基中分别添加不同质量浓度的蔗糖(0.1~10g/100mL)和硫酸铵(0.01~1g/100mL),然后按照1.3.1节发酵方法培养48h后,测定其酶活力。结果如图1所示。
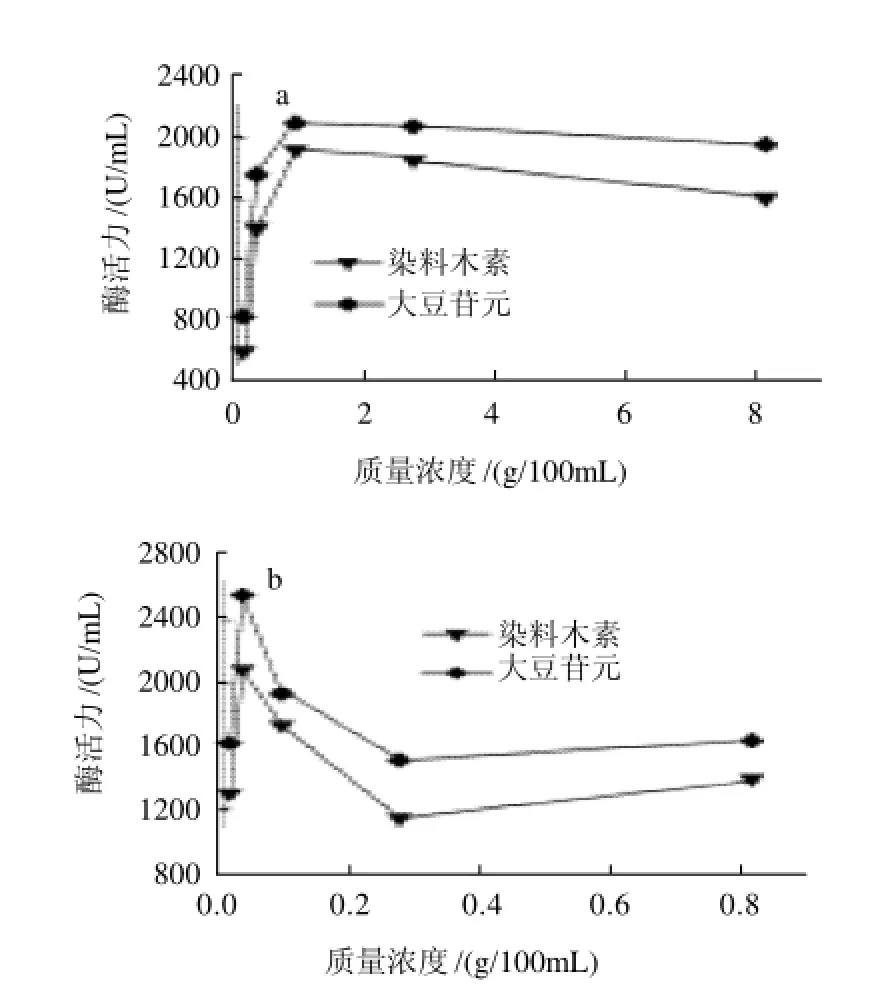
图1 最佳碳源(a)和最佳氮源(b)添加量对大豆异黄酮水解酶产酶的影响Fig.1 Effects of amounts of optimal carbon source and optimal nitrogen source on the production of produce large amounts of hydrolases for SI
由图1可以看出,碳源的添加量以1g/100mL左右较为合适,低于1g/100mL,则由于菌体生长所需的营养不足而导致产酶能力迅速下降,高于1g/100mL则产酶有下降的趋势,可能是由于培养基中糖类营养成分充足,菌株通过分泌水解酶获取额外葡萄糖的压力不大。对于最佳氮源的添加量,在实验所选的氮源质量浓度范围内,总体酶活力维持在较高的水平,其中以0.03g/100mL最好,低于0.03g/100mL时,由于氮源的不足,对产酶有较大影响;高于0.03g/100mL也会使产酶下降,但仍保持一定的产酶量。
2.1.4 诱导物质量浓度对产酶的影响
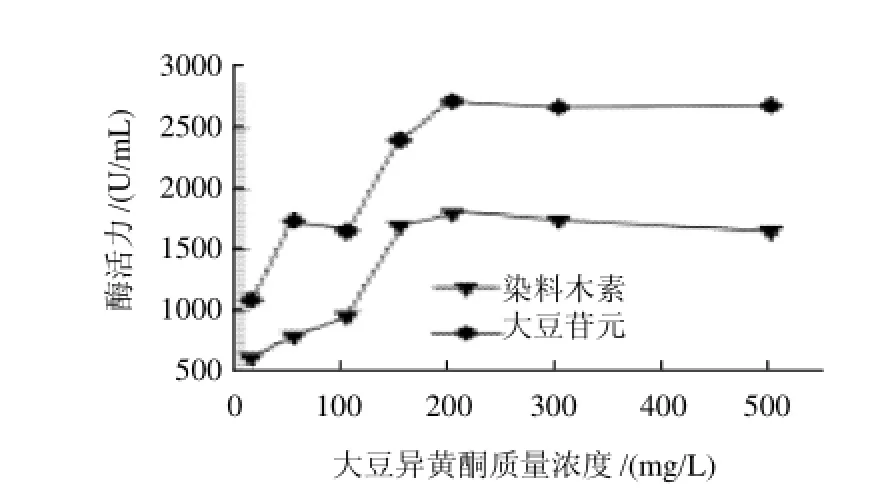
图2 诱导物质量浓度对大豆异黄酮水解酶产酶的影响Fig.2 Effect of inducer concentration on the production of produce large amounts of hydrolases for SI
在高氏一号合成培养基中,分别添加10、50、100、150、200、300mg/L和500mg/L的大豆异黄酮苷作为产酶诱导物,考察诱导物对产酶的影响,结果如图2所示。当大豆异黄酮苷的添加量<150mg/L时,产酶受到较大影响,表明该菌株产生的大豆异黄酮苷水解酶属于诱导酶,需要有外界底物存在才能够诱导合成。另外,由于大豆异黄酮苷难溶于水,因此其添加量以150~200mg/L为宜,过多添加对诱导产酶作用不大。
2.2 培养条件对产酶的影响
2.2.1 起始pH值对产酶的影响
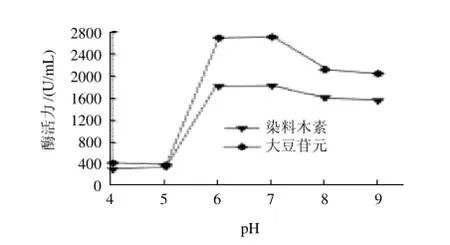
图3 起始pH值对大豆异黄酮水解酶产酶的影响Fig.3 Effect of initial pH on the production of produce large amounts of hydrolases for SI
在上述最佳培养基组成下,考察起始pH值对产酶的影响,结果见图3。起始pH值为6~7时,其酶活力最大。pH值低于6.0则生长和产酶能力急剧下降;pH值高于8.0时,其生长和产酶呈下降趋势,但下降速度比较缓慢,说明海洋拟诺卡氏菌株HY-G比较能够耐受碱性条件,这可能与其在自然界生长的海洋环境有关。
2.2.2 培养温度对产酶的影响
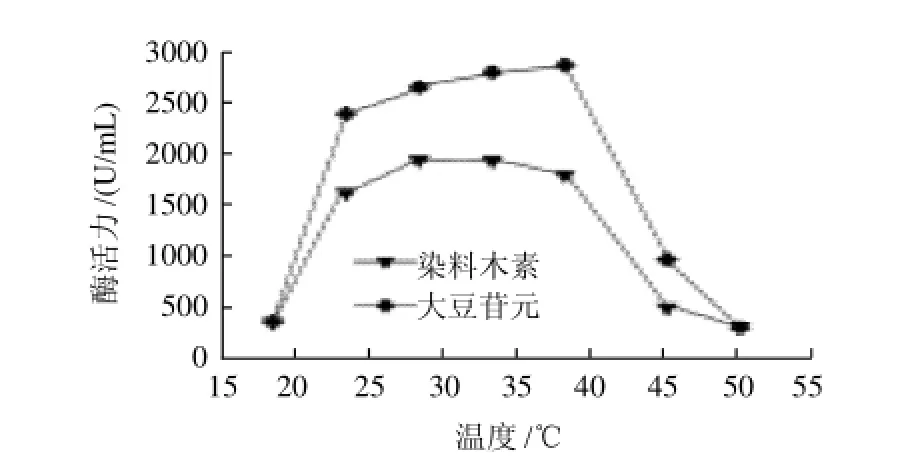
图4 培养温度对大豆异黄酮水解酶产酶的影响Fig.4 Effect of fermentation temperature on the production of produce large amounts of hydrolases for SI
按照上述筛选出的最佳产酶条件,将培养基分别置于18、23、28、33、38、45℃和50℃条件下160r/min摇床中培养72h,然后测其酶活力,结果如图4所示。温度在23~38℃范围内酶的产生量比较稳定,产酶量也达到最大;低于23℃或超过45℃则微生物生长受到抑制而影响产酶。虽然该菌株在23~38℃范围内培养72h后产酶量变化不大,但是实验发现,在此温度范围内,温度越高,微生物生长越快,如在38℃条件下培养48h即可达到最大酶活力,而在28℃条件下培养,则需要72h。
2.2.3 摇瓶转速对产酶的影响
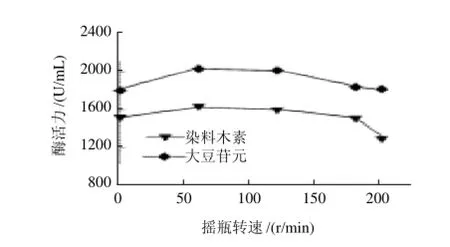
图5 摇瓶转速对大豆异黄酮水解酶产酶的影响Fig.5 Effect of rotation speed on the production of produce large amounts of hydrolases for SI
在上述最佳条件的基础上,将培养基分别置于不同转速(0、60、120、180、200r/min)的摇床中培养,考察摇瓶转速对产酶的影响,结果如图5所示。在60~120r/min下,菌体产酶量较高;转速高于120r/min,由于剪切力的影响,不利于产酶。结果还表明,在较低转速下,海洋拟诺卡氏菌株HY-G生长和产酶均较好,说明其生长代谢对溶氧的要求并不是很高。
2.2.4 培养时间对产酶的影响
将培养基于28℃、120r/min摇床中分别培养不同时间(24、36、48、60、72、84、96、108、120h),然后测其酶活力,结果见图6。当发酵培养至72h后,产酶达到高峰后,若继续培养,可能由于菌体产生蛋白酶破坏大豆异黄酮水解酶等原因,使得酶活力降低。
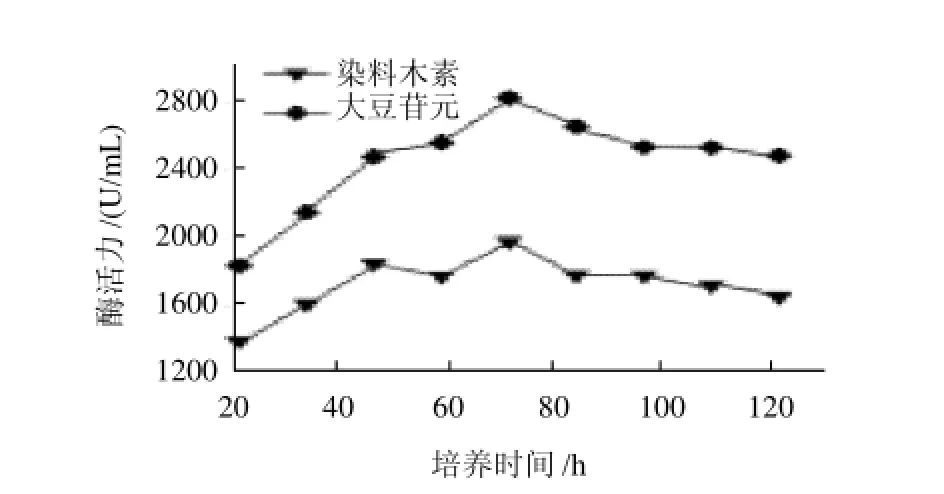
图6 培养时间对大豆异黄酮水解酶产酶的影响Fig.6 Effect of incubation time on the production of produce large amounts of hydrolases for SI
2.3 培养条件的正交试验
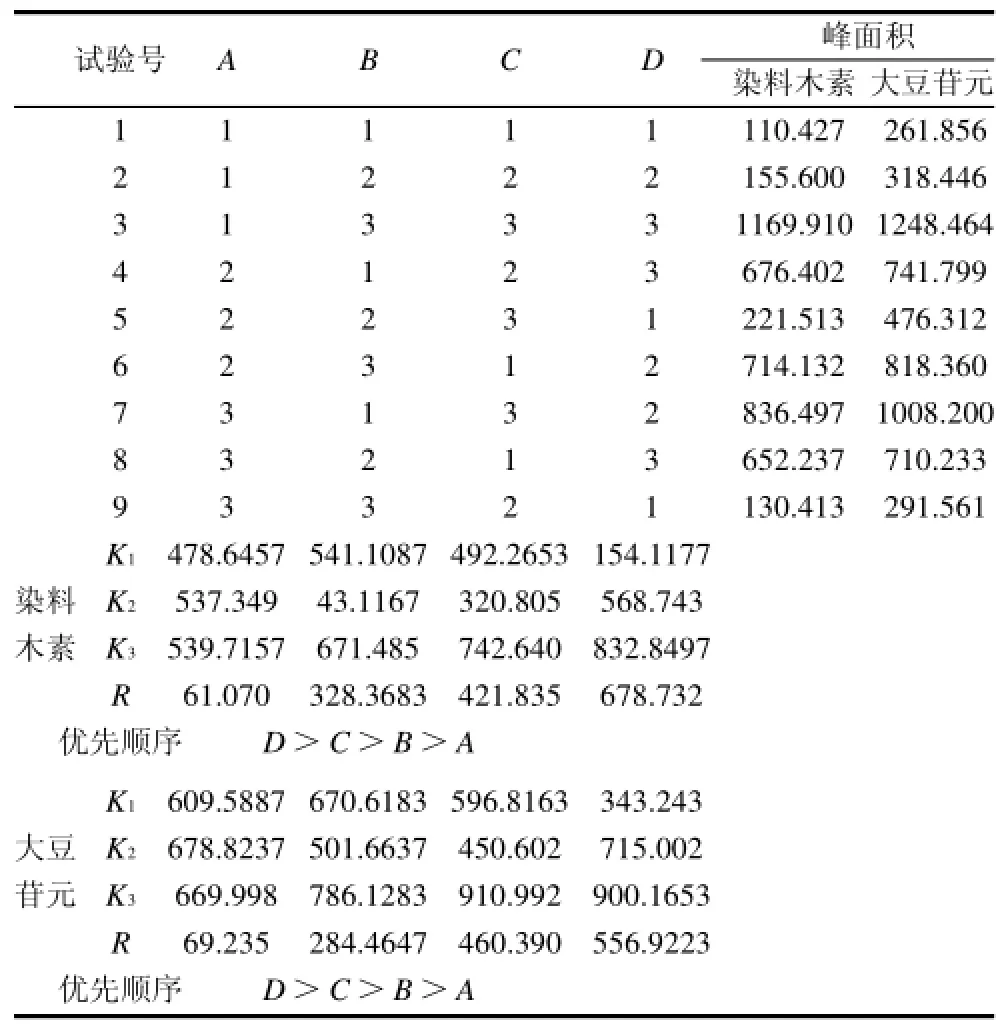
表4 培养条件正交试验结果Table 4 Scheme and experimental results of orthogonal array design
TLC点样量为10μL。从表4可以看出,若以染料木素的产生量为标准,则各影响因素的主次关系为:培养温度>装液量>起始pH值>培养时间,最佳组合为:培养温度40℃、装液量150mL/250mL、起始pH8.0、培养时间96h;若以大豆苷元为标准,各影响因素的主次关系与对染料木素一致,最佳组合也类似,唯一不同的是最佳培养时间为72h。由于培养时间各水平间差异不大、影响最不显著,即影响因素的主次关系为:培养温度>装液量>起始pH值>培养时间,最佳组合为:培养温度40℃、装液量150mL/250mL、起始pH8.0、培养时间72h。
2.4 优化后的产酶活力测定
按照上述实验筛选的最佳条件和最佳培养基组成,即在高氏一号基础培养基中加入1g/100mL蔗糖、0.03g/100mL硫酸铵和200mg/L诱导物的培养基进行培养,培养基装液量150mL/250mL,起始pH8.0,培养温度40℃,摇瓶转速120r/min,培养72h后,测定菌体破碎液中的酶活力分别为3621U/mL(对染料木素)和4862U/mL(对大豆苷元)。
3 讨 论
虽然针对大豆异黄酮苷酶水解的研究较多,但在测定酶活力时,多采用对硝基苯酚-β-D-葡萄糖苷(p-NPG)作底物,因此,难以反映酶对大豆异黄酮苷的活力大小。迄今仅有少数人测定了以对大豆异黄酮苷为底物的酶活力,例如,谢明杰等[12]测定了犁头霉菌株R(Absidia sp. R)中大豆异黄酮苷水解酶的酶活力,为82U/mL(对染料木素)。相比之下,本实验中的酶活力数值显得相当高,但是仔细分析可以发现,犁头霉菌株R产生的是胞外酶,故文献中直接将发酵液作为粗酶液,酶液浓度较稀;而本研究中拟诺卡氏菌株HY-G产生的是胞内酶,需收集菌体、用少量缓冲液重新悬浮并破碎细胞,前后大约浓缩了30余倍。因此和犁头霉菌株R相比,同体积的发酵液中,拟诺卡氏菌株HY-G产生的酶活力估计约为100~120U/mL,比犁头霉菌株R稍高,这表明该菌株也是一株较为优良的大豆异黄酮苷水解菌株。
另外,研究还发现,菌株HY-G产生的大豆异黄酮水解酶对大豆苷的活力要高于染料木素。由于染料木素分子C5上比大豆苷元多一个羟基[13],推测有可能是因为该基团的存在造成了空间位阻,对酶的作用产生一定影响。
目前,采用微生物转化法水解大豆异黄酮苷的研究较多,但所采用的菌株多属于霉菌类,例如黑曲霉[14]、米曲霉[15-16]、少孢根霉[17]、嗜热拟青霉[18]等,也有采用细菌的,例如链球菌[10]、双歧杆菌[19]等,采用放线菌转化则比较少见。海洋拟诺卡氏菌HY-G属于放线菌类,目前国内外尚未见到该属微生物产生大豆异黄酮苷水解酶(或β-葡萄糖苷酶)的报道。本实验对海洋拟诺卡氏菌株HY-G的生长和产酶特性进行了初步优化,得出了其产生大豆异黄酮苷酶的合适条件。
采用微生物转化生产大豆异黄酮苷元的工艺,通常有发酵法和酶水解法两种类型,前者直接利用微生物发酵,而后者是从微生物中提取出酶,再利用酶进行催化水解。相比而言,发酵法具有较高的成本优势。海洋拟诺卡氏菌株HY-G不仅具有较高的大豆异黄酮水解酶活力,而且具有营养需求简单、培养条件温和、对溶氧要求不高等特点,有利于进行大规模液体发酵转化生产大豆异黄酮苷元。同时,由于海洋拟诺卡氏菌株HY-G在液体发酵中能形成菌丝体,很容易收集细胞用于胞内酶的提取,因此也为采用酶水解法提供了较好的条件。
4 结 论
本研究利用海洋拟诺卡氏菌株HY-G生物转化大豆异黄酮苷,采用单因素和正交试验法,对发酵条件和培养基组成等发酵工艺参数进行了优化,优化后的酶活力分别达3621U/mL(对染料木素)和4862U/mL(对大豆苷元)。经过优化,得出了较好的产酶发酵工艺条件,有利于进一步采用大规模发酵法转化大豆异黄酮苷,得到生物活性和生物利用度都较好的大豆异黄酮苷元。
[1] FOTI P, ERBA D, RISO P, et al. Comparison between daidzein and genistein antioxidant activity in primary and cancer lymphocytes[J]. Archives of Biochemistry and Biophysics, 2005, 433(2): 421-427.
[2] OMONI A O, ALUKO R E. Soybean foods and their benefits: Potential mechanisms of action[J]. Nutrition Reviews, 2005, 63(8): 272-283.
[3] RIMBACH G, SAADATMANDIA C B, FRANKA J, et al. Dietary isoflavones in the prevention of cardiovascular disease: A molecular perspective[J]. Food and Chemical Toxicology, 2008, 46(4): 1308-1319.
[4] WANG H J, MUNPHY P A. Mass balance study of isoflavones during soybean processing[J]. Journal of Agricultural and Food Chemistry, 1996, 44(8): 2377-2383.
[5] IZUMI T, PISKULA M K, OSAWA S, et al. Soy isoflavone aglycones are absorbed faster and in higher amounts than their glucosides in humans [J]. Journal of Nutrition, 2000, 130(7): 1695-1699.
[6] SETCHELL K D R, BROWN N M, ZIMMER N L, et al. Evidence for lack of absorption of soy isoflavone glycosides in humans, supporting the crucial role of intestinal metabolism for bioavailability[J]. The American Journal of Clinical Nutrition, 2002, 76(2): 447-453.
[7] NEMETH K, PLUMB G W, BERRIN J G, et al. Deglycosylation by small intestinal epithelial cellβ-glucosidases is a critical step in the absorption and metabolism of dietary flavonoid glycosides in humans [J]. European Journal of Nutrition, 2003, 42(1): 29-42.
[8] 马达, 王素馨, 张春枝, 等. 采用转基因酵母模型检测大豆异黄酮酶解前后雌激素活性[J]. 食品与发酵工业, 2006, 32(3): 86-88.
[9] CASSIDY A, BROWN J E, HAWDON M S F, et al. Factors affecting the bioavailability of soy isoflavones in humans after ingestion of physiologically relevant levels from different soy foods[J]. The Journal of Nutrition, 2006, 136(1): 45-51.
[10] CHUN J, KIM J S, KIM J H. Enrichment of isoflavone aglycones in soymilk by fermentation with single and mixed cultures of Streptococcus infantarius 12 and Weissella sp. 4[J]. Food Chemistry, 2008, 109 (2): 278-284.
[11] 孙艳梅, 张永忠, 许晶, 等. 黑曲霉β-葡萄糖苷酶水解大豆异黄酮糖苷研究[J]. 东北农业大学学报, 2007, 38(1): 9-12.
[12] 谢明杰, 徐春华, 刘长江, 等. 高产大豆异黄酮糖苷水解酶菌株的发酵工艺研究[J]. 微生物学通报, 2004, 31(3): 41-44.
[13] 井乐刚, 张永忠. 大豆异黄酮的物理化学性质[J]. 中国农学通报, 2006, 22(1): 85-87.
[14] 周凤超, 于殿宇, 关海君, 等. 大豆异黄酮水解物的制备[J]. 中国油脂, 2007, 32(4): 59-61.
[15] HORRI K, ADACHI T, MATSUDA T, et al. Improvement of isoflavone aglycones production usingβ-glucosidase secretory produced in recombinant Aspergillus oryzae[J]. Journal of Molecular Catalysis B: Enzymatic, 2009, 59(4): 297-301.
[16] 孙体健, 王浩江, 曹晓峰, 等. 发酵法水解大豆异黄酮提取条件的研究[J]. 食品研究与开发, 2006, 27(4): 11-12.
[17] 吴定, 袁建, 周建新, 等. 固态发酵豆粕生产大豆异黄酮研究[J]. 中国粮油学报, 2004, 19(2): 72-74; 78.
[18] YANG Shaoqing, WANG Lijun, YAN Qiaojuan, et al. Hydrolysis of soybean isoflavone glycosides by a thermostableβ-glucosidase from Paecilomyces thermophila[J]. Food Chemistry, 2009, 115(4): 1247-1252.
[19] SUK J K, JI G E, HWANG I K. Assay ofβ-glucosidase activity of Bifidobacteria and the hydrolysis of isoflavone glycosides by Bifidobacterium sp. Int-57 in soymilk fermentation[J]. Journal of Microbiology and Biotechnology, 2002, 12(1): 8-13.
Optimization of Fermentation Conditions for Soybean Isoflavone Biotransformation by Marine Nocardiopsis sp. HY-G
WU Shao-jie,JIAO Yu-liang,ZHU Qiang,MA Gui-zhen,WANG Shu-jun
(College of Marine, Huaihai Institute of Technology, Lianyungang 222005, China)
Objective: Nocardiopsis sp. HY-G, a strain isolated from marine environment by our laboratory, has been found to produce large amounts of hydrolases that can transform soybean isoflavones (SI) into genistein and daidzein during fermentation. In this study, medium composition and fermentation conditions for decomposing SI by the strain were optimized. Methods: Single factor and orthogonal array design methods were combinedly used for the optimization of fermentation conditions and medium composition. Results: The optimal fermentation medium was Gausse No.1 medium fortified with 1 g/100 mL sucrose, 0.03 g/100 mL (NH4)2SO4, 200 mg/L SI and initial pH 8.0. Fermentation temperature of 40 ℃, rotation speed of 120 r/min and fermentation time of 72 h in a 250 mL shake flask with 150 mL of medium were found optimum for culturing the strain. The activity towards the substrate genistein of the resulting product was 3621 U/mL and the activity towards daidzin was 4862 U/mL. Conclusion: The optimum fermentation conditions obtained after optimization are true and reliable, which will be helpful for large scale biotransformation of SI.
Nocardiopsis sp. HY-G;soybean isoflavone;hydrolysase;biotransformation;fermentation condition
Q815
A
1002-6630(2011)07-0273-06
2010-08-19
江苏省教育厅高校自然科学基础研究计划项目(08KJB180001);淮海工学院引进人才科研启动项目(KQ08015)
吴少杰(1973—),男,副教授,博士,研究方向为食品微生物技术。E-mail:shjwu@163.com
