眼针对脑缺血再灌注损伤模型大鼠脑皮层组织TLR4表达的影响
2011-04-01赵丹玉马贤德赵金茹王守岩王德山辽宁中医药大学基础医学院辽宁沈阳110847
赵丹玉 王 哲 马贤德 赵金茹 王守岩 王德山 (辽宁中医药大学基础医学院,辽宁 沈阳 110847)
眼针疗法是我校著名老中医彭静山教授根据中医理论经络学说,结合长期实践而创立的一种微针疗法〔1〕。30余年的临床实践证明本疗法对于脑缺血再灌注损伤(CⅠRⅠ)的防治具有显著疗效,但机制尚不明确。近年来大量的研究表明,CⅠRⅠ病理生理变化过程中炎症反应是中心环节之一。本研究拟从与炎症相关的Toll样受体(TLR)4角度探讨眼针的作用机制。
1 资料与方法
1.1 材料 健康雄性SPF级Wistar大鼠60只,体重280~320 g,购自上海西普尔必凯实验动物有限公司,动物许可号:SCXK(沪)2008-0016。RNAiso Reagent和RT-PCR试剂盒购自大连宝生物公司;免疫组织化学(SABC法)试剂盒和一抗TLR4多克隆抗体购自武汉博士德生物工程有限公司。
1.2 方法
1.2.1 动物分组与模型复制 60只大鼠以随机数字法分为正常组、假手术组、CⅠRⅠ模型组和眼针组,剔除造模不成功以及死亡鼠,最终每组均为12只。
正常组:常规喂养无任何施加因素。模型复制与成模标准:采用改良的线栓法建立大鼠大脑中动脉缺血(MACO)再灌注动物模型〔2〕(右侧栓塞)。造模后参照Longa 5分制评分标准〔3〕进行神经功能缺损评分。神经功能缺损评分≥1分为造模成功。将造模成功的大鼠再随机分为模型组和眼针组。假手术组:术式与操作基本过程同模型组和眼针组,只是不进行MACO。模型组常规喂养,不给予任何刺激。眼针组在缺血再灌注即刻、造模术后12 h及24 h(即处死前)各针刺1次。
1.2.2 眼针取穴与刺法 取穴参照人体取穴定位法分别取上焦区、下焦区、肝区、肾区〔3〕;刺法:用35 mm ×25 mm 毫针在相应眼穴区距眶内缘2 mm处平刺,由该区始点向该区终点方向刺入0.3 cm,行捻转手法,留针30 min,每隔15 min行针1次,时间1 min。
1.2.3 免疫组化检测TLR4蛋白表达 于造模术后24 h每组各取6只鼠,10%水合氯醛(300 mg/kg)腹腔注射麻醉,先后用生理盐水及4%多聚甲醛心内灌流,迅速断头取脑,取额极至中脑间脑组织冠状面置于4%多聚甲醛中后固定24 h,常规脱水、透明、浸蜡、包埋,每隔100μm连续作5μm厚脑冠状面石蜡切片。石蜡切片进行免疫组化染色,具体步骤按即用型免疫组织化学试剂盒(SABC法)说明书操作。最后于高倍物镜下观察、照相及图像处理分析,测定平均光密度值(MOD)。每张切片测定6个视野取平均值作为测定值。
1.2.4 RT-PCR检测TLR4 mRNA表达 造模术后24 h每组各取6只鼠,10%水合氯醛 (300 mg/kg)腹腔注射麻醉,迅速断头取脑,分离右侧皮层组织。总RNA提取用RNAiso Reagent试剂,按说明操作。提取后的总RNA分别于260 nm、280 nm紫外线下测定样品吸光度,以鉴定纯度。随后用RTPCR试剂盒进行逆转录及PCR。TLR4的引物序列为:正义CCTGTGAGGTCGTTGAGGTTAG,反 义 GCATTGTATCGCCTTCTTAGCA,长度:290 bp,退火温度:65℃;β-actin的引物序 列 为:正 义 GCACCAAGTGCCACAAAGGAA,反 义TGCGAAGCTGTAAAGGTGCCT,长度:592 bp,退火温度:65℃。RT-PCR反应产物进行1.5%琼脂糖凝胶电泳,拍照,凝胶扫描系统进行吸光度积分分析 (ⅠOD),以TLR4的RTPCR产物ⅠOD与内参β-actin的RT-PCR产物的ⅠOD比值表示TLR4 mRNA的表达水平。
1.3 统计学分析 应用SPSS11.0统计软件,实验结果以±s表示,进行多组数据的方差分析,组间比较采用LSD法。
2 结果
2.1 眼针对CⅠRⅠ模型大鼠一般状态的影响 假手术组大鼠手术完成动物苏醒后无神经功能缺损体征出现,根据神经功能缺损评分标准进行评分,均为0分。模型组及眼针组大鼠术中死亡7只,另外还有5只大鼠神经功能缺损不明显,最终造模成功的大鼠随机分为模型组和眼针组各12只。造模成功的大鼠苏醒后出现明显的不能完全伸展对侧前爪、向对侧转圈及向对侧倾倒等神经功能缺损症状。术后24 h,模型组动物神经功能缺损症状随时间延长逐渐加重,神经功能缺损评分具有明显的上升趋势;眼针组神经功能缺损症状加重不明显,显示出眼针治疗的脑保护作用。
2.2 眼针对CⅠRⅠ模型大鼠大脑皮层组织TLR4蛋白表达的影响 正常组及假手术组大鼠大脑皮层内未见TLR4阳性细胞表达。CⅠRⅠ模型组可见较多的TLR4阳性细胞,胞质着色,与正常组和假手术组比较有显著性差异(P<0.01);眼针组阳性细胞数量显著减少,与模型组比较差异具有统计学意义(P<0.05)。见图1,表1。
2.3 眼针对CⅠRⅠ模型大鼠大脑皮层组织TLR4基因表达的影响 正常组及假手术组TLR4 mRNA表达均较少,二者之间没有显著差异(P>0.05);与正常组及假手术组比较,CⅠRⅠ模型组TLR4 mRNA呈现明显高表达(P<0.01);而眼针组表达较模型组明显下降(P<0.05)。见图2,表1。

图1 眼针对CIRI模型大鼠右侧大脑皮层组织TLR4蛋白表达的影响(IHC,DAB染色,×400)
表1 眼针对大鼠右侧皮层TLR4表达的影响(±s,n=6)

表1 眼针对大鼠右侧皮层TLR4表达的影响(±s,n=6)
与正常组比较:1)P<0.01;与模型组比较:2)P<0.05
正常组0.2 3 4±0.0 0 2 0.6 3 3±0.0 5 5假手术组 0.2 3 5±0.0 0 3 0.6 7 7±0.0 2 5模型组 0.2 5 0±0.0 0 5 1) 1.2 9 3±0.3 2 2 1)眼针组 0.2 4 5±0.0 0 4 2) 1.0 9 3±0.1 2 0 2)
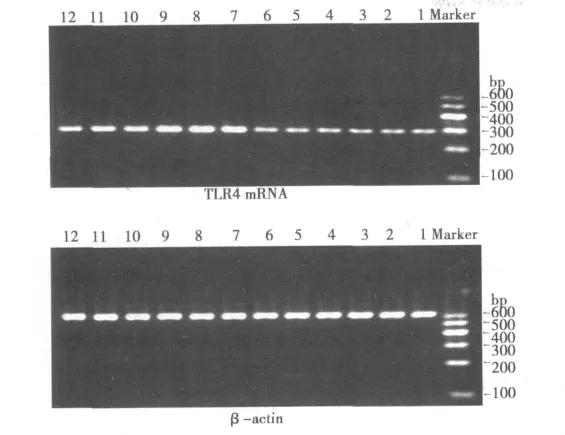
图2 RT-PCR产物凝胶电泳图
3 讨论
眼针疗法是将眼睛周围按照八卦分为八区十三穴,对应人体相应的五脏六腑、器官组织等。临床上根据不同脏腑、器官的病变和病位选取相应的穴位进行针刺,从而达到治疗全身不同部位疾病的目的。多年的临床实践证明,本疗法对于急性脑出血性疾病具有很好的疗效,然而眼针治疗脑出血性疾病的作用机制亟待研究。
CⅠRⅠ损伤是一个复杂的病理生理过程,涉及多个环节和多方面的因素。其中炎症反应在CⅠRⅠ中起到至关重要的作用。近年来对于与炎症相关的多种疾病的研究发现,TLR4介导的核转录因子(NF)-κB信号转导通路的激活可以导致肿瘤坏死因子(TNF)α、白细胞介素(ⅠL)-1等炎症因子表达增高,加重组织的炎症反应。那么这个信号转导通路的激活是否也是CⅠRⅠ的机制之一,眼针疗法是否可以对此起到抑制作用,这也是本研究要解决的问题。
已有大量的研究表明,TLR4与CⅠRⅠ损伤密切相关。Toll样受体(TLR)家族成员在大脑的各组织细胞中均有表达,被认为是目前哺乳动物唯一将细胞外抗原识别信息向细胞内传递并引发炎症反应的关键跨膜蛋白〔4〕。目前研究得最为清楚的是TLR4。TLR4是膜结合蛋白,当与配体结合后,其胞内的5'端翻译启始区(TⅠR)结构域能连接胞内衔接蛋白MyD88,进而启动下游ⅠL-1受体相关激酶(ⅠRAK)磷酸化,继而激活TNF受体相关因子(TRAF)〔5~8〕,激活 NF-κB,促进多种细胞因子及炎症因子的表达,启动炎症反应〔9,10〕,即为 MyD88依赖的 TLR4信号转导通路。研究发现,TLR4基因敲除小鼠模型比正常小鼠模型的大脑CⅠRⅠ发生率更小,梗死面积更少〔11〕。研究报道,当 CⅠRⅠ时,TLR4 表达显著升高〔12〕。因此,有学者提出,通过人为减少TLR4信号的激活,从而减少不利因素的产生,使中枢神经系统疾病得以尽快恢复,可以作为治疗中枢神经疾病的良好方案〔13〕。
本研究通过RT-PCR和免疫组化检测CⅠRⅠ模型组大鼠TLR4 mRNA和蛋白表达均增强,与以往的研究基本一致,提示CⅠRⅠ时由于某些内源性炎症介质的释放促进了TLR4的表达,极有可能激活了TLR4信号转导通路,从而使NF-κB活化,启动TNFα、ⅠL-1等炎症因子的转录,加重了 CⅠRⅠ时炎症反应。而眼针组大鼠缺血侧大脑皮层TLR4基因及蛋白表达均显著降低,说明眼针刺激能够抑制TLR4的表达,通过对膜受体蛋白表达的抑制作用而抑制其下游蛋白的活化,进而抑制NF-κB与炎症因子结构基因上游的调控序列结合,抑制炎症因子的表达,减轻其炎症反应,从而达到对脑皮层组织的保护目的,这可能是眼针对于CⅠRⅠ有显著疗效的机制之一。
1 彭静山.眼针疗法〔M〕.沈阳:辽宁科学技术出版社,1990:15-52.
2 马贤德,孙宏伟,柴纪严,等.线栓法制备大鼠脑缺血再灌注模型的方法研究〔J〕.中华中医药学刊,2009;27(6):1200-1.
3 Longa EZ,Weinstein PR,Carison S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats〔J〕.Stroke,1989;20(1):84-91.
4 Coulon S.Pattern recogruition receptors:doubling up for the innate immune response〔J〕.Cell,2002;111(7):927-30.
5 Kishore SP,Bungum MK,Platta JL,et al.Selective suppression of Tolllike receptor 4 activation by chemokine receptor 4〔J〕.FEBSLett,2005;579(3):699-704.
6 Janssens S,Beyaert R.A universal role for MyD88 in TLR/ⅠL-1R-mediated signaling〔J〕.Trends Biochem Sci,2002;27(9):474-82.
7 McGettrick AF,O'Neill LA.The expanding family of MyD88-like adaptors in Toll-like receptor signal transduction〔J〕.Mol Ⅰmmunol,2004;41(6-7):577-82.
8 Suzuki N,Saito T.ⅠRAK-4-a shared NF-κB activator in innate and acquired immunity〔J〕.Trends Ⅰmmunol,2006;27(12):566-2.
9 Velayudham A,Hritz Ⅰ,Dolganiuc A,et al.Critical role of toll-like receptors and the common TLR adaptor,MyD88,in induction of granulomas and liver injury〔J〕.JHepatol,2006;45(6):813-24.
10 Yang Y,Zhou H,Yang Y,et al.Lipipolysaccharide(LPS)regulates TLR4 signal transduction in nasopharynx epithelial cell line 5-8F via NF-κB and MAPKs signaling pathways〔J〕.Mol Ⅰmmunol,2007;44(5):984-92.
11 Marsh BJ,Williams-Karnesky RL,Stenzel-Poore MP.Toll-like receptor signaling in endogenous neuroprotection and stroke〔J〕.Neuroscience,2009;158(3):1007-20.
12 郭继东.银杏叶提取物对局灶性脑缺血大鼠脑组织炎症信号TLR4表达的影响〔J〕.中国老年学杂志,2009;29(20):2629-31.
13 茅东升,来婷婷,陈 琰,等.Toll信号通路在中枢神经系统损伤中的作用〔J〕.中国生物化学与分子生物学报,2010;26(2):121-7.
