EPO治疗干预对RPE细胞氧化损伤的保护作用*
2011-03-30姜文静牛膺筠
赵 颖 姜文静 牛膺筠
1.青岛大学医学院附属市立医院眼科,山东 青岛 266011;2.青岛大学医学院附属海慈医院眼科,山东 青岛 266033;3.青岛大学医学院附属医院眼科,山东 青岛 266003
年龄相关性黄斑变性是我国主要致盲眼病之一,严重危害患者的视力。视网膜色素上皮(retinal pigment epithelium,RPE)的氧化损伤是年龄相关性黄斑变性病程的重要病理机制[1]。近期研究发现,促红细胞生成素(erythropoietin,EPO)具有抑制凋亡[2]、抗脂质过氧化[3]、神经保护[4]等多种生物学作用。笔者前期报道了EPO对RPE细胞凋亡的抑制作用[5],本实验通过建立体外培养的RPE细胞氧化损伤模型,检测EPO干预前后RPE细胞活力以及凋亡相关因子表达的变化,进一步探讨其细胞保护机制,为临床应用提供实验依据。
1 材料与方法
1.1 一般材料
EPO、MTT试剂(美国Sigma生物技术公司);Caspases-9单克隆抗体(美国Santa Cruz公司);免疫组织化学试剂盒(北京中山生物试剂公司);人RPE细胞(美国细胞培养收集公司,ARPE-19细胞株);DMEM/F12培养基,新生牛血清,胰蛋白酶,青霉素和链霉素(GIBCO生物技术公司)。
1.2 实验方法
1.2.1 人RPE细胞的体外培养 详见文献[5]。
1.2.2 实验分组及建立RPE细胞氧化损伤模型 人RPE传代细胞随机分为5组,每组4孔:①正常对照组;②过氧化氢氧化损伤模型组(600 μmol/L过氧化氢损伤,不加EPO药物干预);③过氧化氢+10 IU/mL EPO组(600 μmol/L过氧化氢损伤,10 IU/mL EPO药物干预);④过氧化氢+20 IU/mL EPO组(600 μmol/L过氧化氢损伤,20 IU/mL EPO药物干预);⑤过氧化氢+40 IU/mL EPO组(600 μmol/L过氧化氢损伤,40 IU/mL EPO药物干预)。
1.2.3 MTT检测 细胞接种于96孔板,接种密度2×104个/mL,每孔200 μL,每组4孔。培养24 h使细胞融合约80%~90%;将原培养液吸出,按上述分组换入含有不同成份的DMEM/F12培养液,继续培养24 h;更换为正常培养液培养24 h。弃去培养液,每孔加入MTT终浓度为0.05 mg/mL的无血清培养液,培养3 h,弃去培养液,每孔加入二甲基亚砜(DMSO)100 μL,置摇床振荡10 min,用不含细胞的DMEM/F12培养液调零,应用DG3022型酶联免疫检测仪在490 nm波长处读取各孔吸光度(A490)值。
1.2.4 免疫组织化学法检测Caspases-9蛋白表达 将RPE细胞按密度2×105个/mL接种于6孔板中,孔内预置4 mm×4 mm的盖玻片,培养24 h,观察到细胞融合约80%~90%;将原培养液吸出,按上述分组换入含有不同成份的DMEM/F12培养液,继续培养24 h;更换为正常培养液培养24 h。吸出培养液,0.01 mol/L PBS冲洗3遍,用质量分数4%多聚甲醛固定20 min,0.01 mol/L PBS冲洗3遍。取出孔内的盖玻片,细胞面向上置于载玻片上。滴加0.3% H2O2室温10 min,0.01 mol/L PBS冲洗3遍,复合消化液室温10 min,0.01 mol/L PBS冲洗3遍,正常山羊血清室温10 min,加一抗(鼠抗人Caspases-9单克隆抗体)37℃ 2h,0.01 mol/L PBS冲洗3遍,加二抗37℃ 20 min,SP法染色,DAB显色,脱水,透明,封片。阳性细胞胞膜和胞质呈棕黄色染色。空白对照,用PBS代替一抗,其余步骤相同。
1.3 统计学处理
2 结果
2.1 EPO对过氧化氢氧化损伤人RPE细胞活性的影响
MTT法测定各组细胞A490值反映细胞活性变化见表1。氧化损伤组细胞活性显著降低,与正常组相比较差异有极显著性(t=11.8692,P<0.01)。EPO各组的细胞活性均明显增高,与氧化损伤组比较,10 IU/mL EPO干预组、20 IU/mL EPO干预组、40 IU/mL EPO干预组细胞活性逐渐升高差异均有极显著性(t值分别为 5.6569、5.7056、9.4299,P<0.01)。
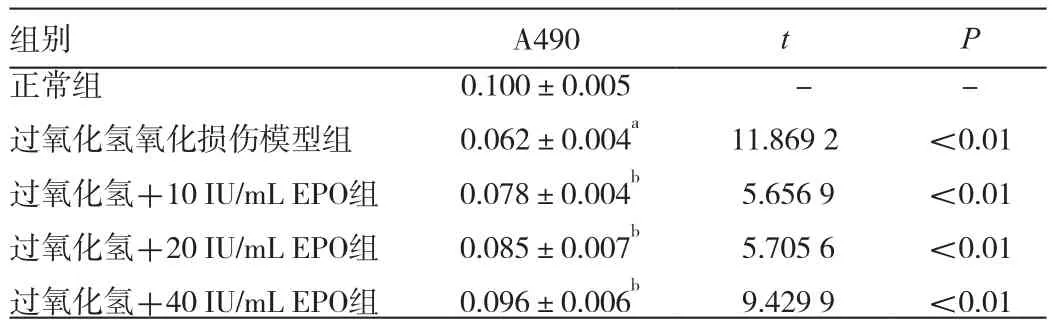
表1 EPO对过氧化氢损伤人RPE细胞活性的影响
2.2 EPO对过氧化氢损伤人RPE细胞表达Caspase-9的影响
正常组Caspases-9蛋白表达于细胞膜和细胞质上,呈少量特异性浅黄色着色。氧化损伤组Caspases-9呈强阳性表达,表现为特异性棕黄色着色。氧化损伤组与正常组比较,表达升高,差异有极显著性(t=147.5805,P<0.01)。经不同浓度的EPO干预,Caspase-9的表达不同程度的减弱,在40 IU/mL EPO干预组减弱的最为明显。与氧化损伤组比较,10 IU/mL EPO干预组、20 IUmL EPO干预组、40 IU/mL EPO干预组表达逐渐下降,差异有统计学意义(t值分别为:18.7409、61.8718、54.9153,P<0.01)。见表2。
表2 EPO对过氧化氢损伤人RPE Caspases-9蛋白表达的影响(平均光密度值,,n=4)
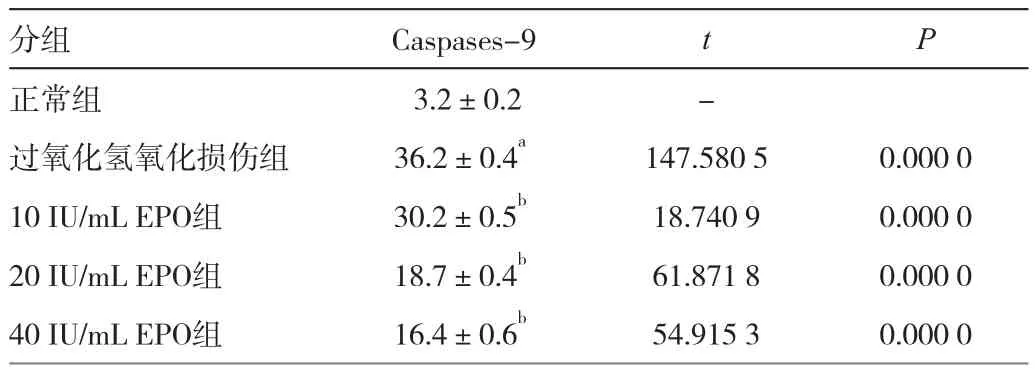
表2 EPO对过氧化氢损伤人RPE Caspases-9蛋白表达的影响(平均光密度值,,n=4)
注:n=4,氧化损伤组和正常组比较,aP<0.01, EPO组和氧化损伤组比较,bP<0.01
分组 Caspases-9 t P正常组 3.2±0.2 -过氧化氢氧化损伤组 36.2±0.4a 147.5805 0.000010 IU/mL EPO组 30.2±0.5b 18.7409 0.000020 IU/mL EPO组 18.7±0.4b 61.8718 0.000040 IU/mL EPO组 16.4±0.6b 54.9153 0.0000
3 讨论
随着我国人口老龄化趋势的加重,年龄相关性黄斑变性的患病率不断上升。而研究表明,年龄相关性黄斑变性的发病机制与RPE细胞的氧化损伤有关[6]。RPE细胞吞噬感光细胞外节会产生过度氧化反应,损伤RPE细胞,同时破坏RPE细胞之间构成的血-视网膜外屏障,诱发一系列的病理过程[7]。本实验室前期研究发现,EPO对小鼠视网膜光损伤有治疗作用[8]、对RPE细胞氧化损伤有保护作用,可以抑制凋亡、增强超氧化物歧化酶的活性,从而起到抗氧化作用。因此,本研究通过制作人RPE细胞氧化损伤模型,添加不同浓度的EPO进行药物干预,进一步研究其保护机制。
本实验使用MTT法检测RPE细胞活性。MTT测定是一种有色反应,当细胞培养液中加入MTT后,能被活细胞摄入,经细胞内线粒体呼吸链酶分解成甲瓒,经过分光光度计的检测细胞活性[9]。本研究结果发现氧化损伤组细胞活性显著低于正常组,RPE细胞的氧化损伤,破坏了线粒体膜,细胞发生致死性改变。经过EPO药物干预的RPE细胞,细胞活性明显增高,提示不同剂量的EPO均对RPE细胞有保护作用。其中40 IU/mL EPO干预组的细胞活性最高,与正常组接近,说明40 IU/mL EPO能够拮抗过氧化氢对RPE细胞的氧化损伤。
本实验室前期研究已证实EPO对RPE细胞氧化损伤的保护作用通过抑制凋亡来完成。细胞凋亡是指细胞在凋亡基因控制下主动的一种细胞死亡过程[10]。凋亡的发生由细胞内外多种不同的诱因激发细胞自身凋亡基因的连锁反应而启动[11]。Caspase-9作为Caspases蛋白酶家族的上游成员,在凋亡的介导中起重要的作用[12]。目前对于RPE细胞凋亡的上游启动阶段尚无明确的研究结果。本实验研究发现,氧化损伤组Caspases-9蛋白呈阳性表达,较正常组表达升高,显示在RPE凋亡过程中Caspase-9介导的凋亡途径起到重要的作用。而外源性EPO干预可以减少Caspase-9的表达,其抗凋亡机制可能与此有关。
[1]McLeod DS,Grebe R,Bhutto I,et al.Relationship between RPE and choriocapillaris in age-related macular degeneration[J].Invest Ophthalmol Vis Sci,2009,50(10):4982-4991.
[2]Cervellini I,Bello E,Frapolli R,et al.The neuroprotective effect of erythropoietin in docetaxel-induced peripheral neuropathy causes no reduction of antitumor activity in 13762 adenocarcinoma-bearing rats[J].Neurotox Res,2010,18(2):151-160.
[3]Wang ZY,Shen LJ,Tu L,et al.Erythropoietin protects retinal pigment epithelial cells from oxidative damage[J].Free Radic Biol Med,2009,46(8):1032-1041.
[4]Li RC,Guo SZ,Raccurt M,et al.Exogenous growth hormone attenuates cognitive deficits induced by intermittent hypoxia in rats[J].Neuroscience,2011,196:237-250.
[5]赵颖,牛膺筠,周占宇,等.促红细胞生成素对人视网膜色素上皮细胞氧化损伤的保护作用[J].中国药理学通报,2006,22(7):803-806.
[6]Bertram KM,Baglole CJ,Phipps RP,et al.Molecular regulation of cigarette smoke induced-oxidative stress in human retinal pigment epithelial cells:implications for age-related macular degeneration[J].Am J Physiol Cell Physiol,2009,297(5):C1200-1210.
[7]Bailey TA,Kanuga N,Romero IA,et al. Oxidative stress affects the junctional integrity of retinal pigment epithelialcells[J].Invest Ophthalmol Vis Sci,2004,45(2):675-684.
[8]Wang HY,Niu YJ,Wang PS,et al.Erythropoietin administration protects retina against light-induced retinal degeneration[J].Zhonghua Yanke Zazhi,2005,41(5):434-438.
[9]Saxena P,Pant VA,Wadhwani KK,et al.Potential of the propolis as storage medium to preserve the viability of cultured human periodontal ligament cells:an in vitro study[J].Dent Traumatol,2011,27(2):102-108.
[10]Algvere PV,Marshall J,Seregard S.Age-related maculopathy and the impact of blue light hazard[J].Acta Ophthalmol Scand,2006,84(1):4-15.
[11]Mammucari C,Rizzuto R.Signaling pathways in mitochondrial dysfunction and aging[J].Mech Ageing Dev,2010,131(7-8):536-543
[12]Clerkin JS,Naughton R,Quiney C,et al.Mechanisms of ROS modulated cell survival during carcinogenesis[J].Cancer Lett,2008,266(1):30-36.
