60Co g射线辐照黄连木的生物学效应
2011-03-24张萍萍李明浩陈于和吴丽芳
安 倩 张萍萍 李明浩 陈于和 吴丽芳
1(河北科技师范学院 秦皇岛 063000)
2(中国科学院离子束生物工程学重点实验室 合肥 230031)
据美国能源部和世界能源理事会预测,全球石化类能源的可开采年限分别为石油 39年、天然气60年、煤211年[1,2],到21世纪中叶化石燃料将被开采殆尽,或因开采成本过高而失去开采价值。为应对世界范围的能源危机,开发和利用可再生新能源成为各国的战略举措。其中,生物能源备受关注。
国外研究较多的生物柴油木本植物是麻风树,但其只适合生长于我国少数地区[3,4]。黄连木(Pistacia chinensis Bunge)又称楷木、药木、黄连茶等,属漆树科(Family anacardiaceae)黄连木属(Pistacia chinensis),是多年生木本油料植物。黄连木的特点为:
(1) 用途广泛,可用作生产肥皂、润滑油、染料粘合剂、工程塑料等的工业原料;
(2)分布范围广,野生和栽培于华北、华南及华中23个省区;
(3) 适应性强,耐干旱、盐碱、瘠薄,可在荒山荒地种植,宜于大面积造林;
(4)含油率高,果实含油率~35%、果肉含油率~50%、种子含油率42%、种仁含油率56%[5]。以黄连木种子为原料生产的生物柴油,主要理化指标达美国生物燃料油标准和中国轻质燃料油标准S6T[6]。黄连木是我国极具开发前景的生物质液体燃料树种,属优先发展的木本能源树种之一[7–10]。
黄连木油脂转化生物柴油技术,是我国唯一通过国家鉴定[国经贸鉴字(2002)046号]的木本生物质柴油生产技术。然而,大规模开发利用取决于种质资源,要获得高产、高品质、童期短、抗病虫的黄连木种子,关键在育种。常规育种技术是通过基因重组、累加、互补等遗传效应获得新类型,既保持原品种的优良性状,又弱化原品种的不良性状。其整体水平提高幅度大,但有遗传稳定性差、育种周期长的缺点。辐射诱变育种是继实生选种和杂交育种后发展的育种方法,可大大提高基因突变频率,缩短育种周期,改良品质而又不改变原品种的优质性状,可获得常规育种难以奏效的新种质[11]。
目前,黄连木多处于野生状态,基础研究较为薄弱,且大多集中于引种栽培、播种繁殖、病虫害防治、资源调查等方面。用辐射手段获得黄连木新种质,加快黄连木遗传改良的步伐,此类研究尚未见报道。本文将黄连木种子进行不同剂量的钴60g射线辐照,由萌发率、苗高、成苗率、形态及RAPD分析法研究处理植株的变异,获得的初步结果,可为辐射法获取黄连木优良种质提供借鉴。
1 材料和方法
1.1 黄连木种子及其辐照
黄连木种子干种子取自安徽省东至山区。在安徽省农科院原子能所进行60Co g射线辐照,剂量率为 14Gy/min,剂量分别为 100、200、400、600、800Gy,以未辐照种子作对照。
1.2 种子萌发
辐照处理种子及对照种子用70%乙醇处理1.25 min,用0.1%氯化汞处理15 min,无菌水冲洗后置于垫有 Φ9cm 培养皿中(垫有三层滤纸),加入 12 mL蒸馏水。每组100粒,重复3次。加盖后25°C恒温黑暗培养。种子以胚根明显露白为发芽,统计第3、7、10天发芽种子数[12]。14天后,将幼苗转移到装有营养土的盆钵中培养 6周左右后移栽大田,移栽前测量并记录苗高。6个月后,统计成苗率,观察并统计植株变异情况(此时可观察到稳定的植株变异性状)。
1.3 基因组DNA提取
主要试剂:CTAB提取缓冲液:3% CTAB(CTAB购自Bio Basic INC),100 mmol/L Tris-HCl(Tris购自Bio Basic INC),50 mmol/L EDTA(国药试剂),1.4 mol/L NaCl,3%b-巯基乙醇,3% PVP,pH=8.0;氯仿-异戊醇(24:1);5 mol/L KAc,RNA酶(上海生工)10 mg/mL。
用于DNA提取的样品取自6个月以上的植株,在每个处理剂量与对照组中随机取12个植株,取幼嫩叶片提取DNA。基因组DNA的提取用CTAB法,参考程世平等[13–15]提取方法并稍加改进。
1.4 RAPD反应
以对照和不同处理剂量的植株 DNA为模板,用RAPD随机引物进行PCR扩增,反应在Applied Biosystems Thermal Cycler上进行。采用上海生工S系列引物,从28个引物中筛选19个可用引物进行RAPD 分析(表 1)。反应体系为 20 mL:10´buffer,2.0 mL;200 mmol/L dNTP,0.2 mmol/L 引物,1.0 UTaq酶,模板DNA约40 ng。PCR扩增程序为:94°C 预变性 2 min,94°C 变性45 s,36℃退火 1 min,72°C 延伸 2 min,45 个循环后,72°C 延伸 5 min,4°C保存[16,17]。扩增产物经 1.5%的琼脂糖凝胶电泳分离,凝胶成像系统照相分析。每个反应重复多次,以多次重复中稳定出现的亮带作为统计对象[18,19]。
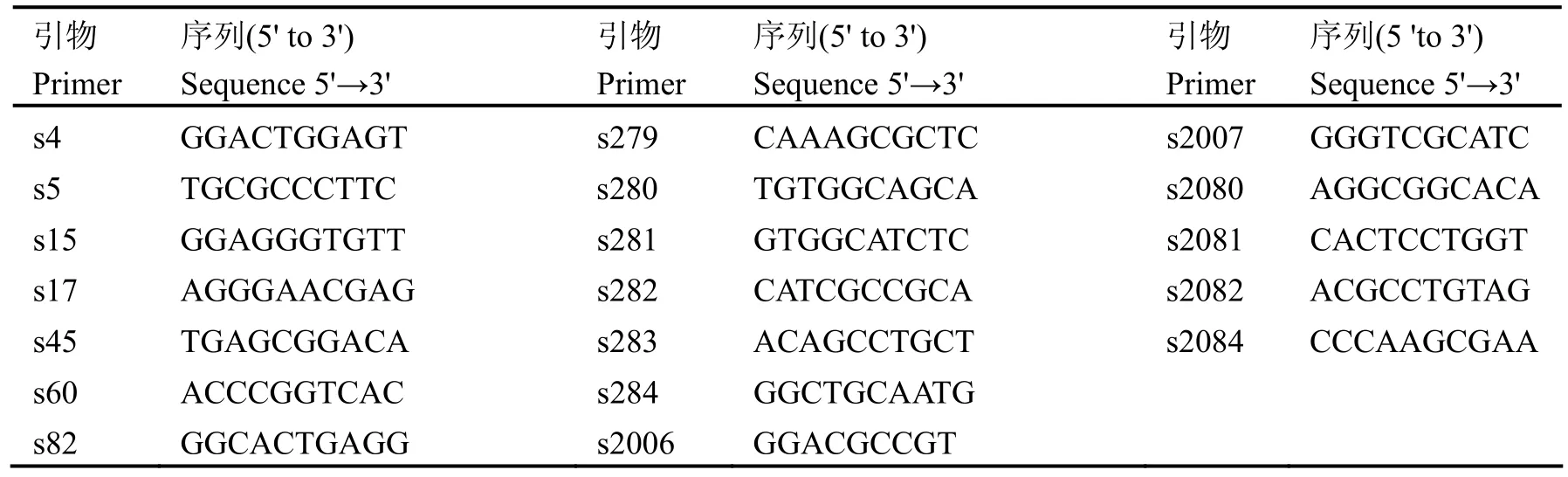
表1 RAPD分析引物及其序列Table 1 The sequence of primers used for RAPD analysis
2 结果
2.1 60Co g射线辐照对种子萌发的影响
60Co g射线辐照引起黄连木种子发芽率的降低较对照差异很明显,与剂量负相关,即随剂量增大,发芽率逐渐降低(图1)。
2.2 60Co g射线辐照生物学效应分析
辐射剂量对成苗率的影响见表 2,成苗率随辐射剂量升高而降低。100Gy和200Gy剂量处理的植株成苗率分别为23.75%、20%,而对照组成苗率为 30%,差异显著;400、600、800Gy剂量处理的植株成苗率分别为1.75%、0.25%、0,彼此间差异不显著,但与对照差异显著。

图1 钴60g射线辐照黄连木种子萌发的影响Fig.1 Effect of 60Co g-ray irradiation on germination of Pistacia chinensis Bunge seeds.

表2 60Co g射线辐照黄连木种子对幼苗生长的影响Table 2 Effect of 60Co g-ray irradiation on seedling growth of Pistacia chinensis Bunge seeds
辐照200和400 Gy的种子的7日发芽率分别为33%和 32%,几乎相同,但成苗率分别为 20%和1.75%,差异极显著。辐照600和 800Gy种子的10日发芽率在20%左右,但成苗率几乎为零。生长速率也随剂量增大而减小。在7天时,对照小苗平均根长3cm左右,而800Gy小苗平均根长仅1cm左右(结果未显示)。辐射损伤对苗高的影响(表2)也有同样趋势。100Gy处理组苗高平均为9.2 cm,对照组为9.7 cm,差异不显著; 200和400Gy处理组苗高平均为4.0和2.3 cm,与对照组有显著差异。
与对照相比,各辐照处理组的黄连木幼苗出现矮化、株型不对称、叶脉失绿、叶片卷曲、畸形等现象(图2)。成苗率较高的两个处理组在幼苗期出现的变异类型的统计结果见表3,200Gy组的叶形变异率为48.8%,株型变异率为46.3%,明显高于100Gy组的33.8%和15.0%,说明200Gy辐照对黄连木幼苗产生较大影响。对幼苗突变性状进行的跟踪观察发现,幼苗期出现的有些变异性状很可能是一种短期的生理效应,2个月后大部分变异性状开始消失。但仍有少数变异保持到6个月后(图3),这样的变异应是可遗传的。为此,对6个月大的处理材料作了RAPD 分析,以研究其DNA水平的变异。

图2 60Co g射线辐照后黄连木幼苗变异(A)左,对照;右,处理后的矮化幼苗 (B,C) 叶形变异幼苗 (D)对照 (E, F) 株型变异幼苗Fig 2 Seedling variation of Pistacia chinensis Bunge seeds irradiated by 60Co g-rays.(A) the control in the left and the dwarfed plant in the right, (B,C) the leaf variation, (D) the control, (E,F) the type variation

表3 钴60g射线辐照黄连木种子对幼苗变异的影响Table3 Effect of 60Co g-ray irradiation on seedling variation of Pistacia chinensis Bunge seeds.

图3 六个月植株变异情况(G)株高对照,(H)和(I)处理后的矮化植株;(J)叶形和株型对照,(K)和(L)叶形变异,(M)株型变异Fig 3 Variations of the 6-month plants.(G) the control, (H,I), the dwarfed plant; (J) the control, (K,L) the leaf variation, (M) the type variations
2.3 黄连木基因组DNA提取
黄连木叶片富含单宁等次生代谢物质,造成DNA提取困难。我们改进了DNA提取方法,获得了纯度较高且较为完整的大分子DNA(图4)。
2.4 RAPD结果
在所使用的28个引物中,有19条引物有扩增产物,扩增条带数从0-10条不等。与对照组(未发现差异)相比,辐照组有条带的增加或缺失,且差异出现的频率与剂量有关:100Gy组有 5株检测到RAPD差异,每株变异情况不完全一样,共记录到20个条带增加,16个条带缺失,植株变异率为41.7%,条带变异率为2.23%;200Gy组有7株检测到RAPD差异,其中条带增加43条次,缺失32条次,植株变异率为58.3%,RAPD条带变异率为4.63%(见表4)。图5和图6是用RAPD引物S17和S82扩增出的RAPD条带差异。
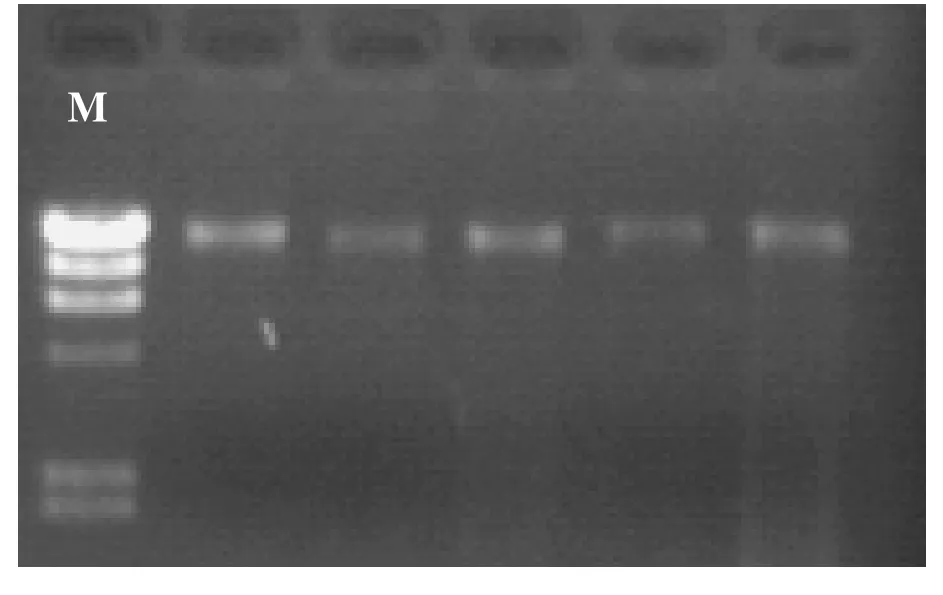
图4 黄连木基因组DNA提取结果(M: lDNAHindIII)Fig4 Extraction results of genome DNA of Pistacia chinensis Bunge (M: lDNAHindIII).

表4 钴60g射线辐照与RAPD条带变异率的关系Table4 RAPD fragment bands variation of the 6-month plants grown from the seeds irradiated to 100 and 200 Gy.
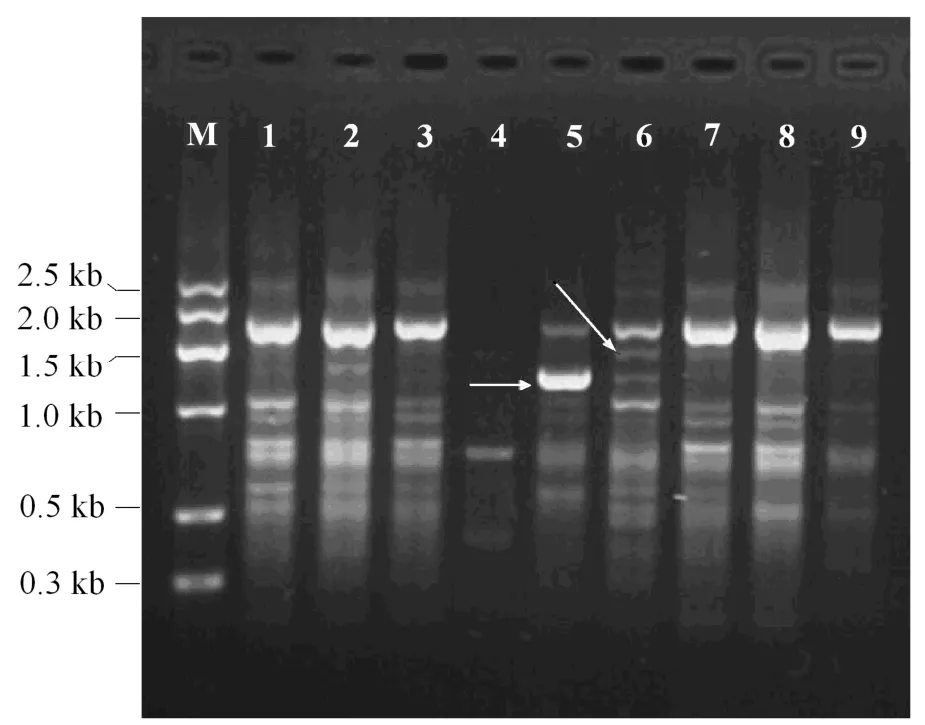
图5 引物S17扩增结果M:marker-G;1–3为对照,5–9为200Gy剂量处理6和7中各出现一条不见于对照的条带(箭头所示)Fig 5 RAPD bands patterns of S17.M: marker-G; No.1–3, the controls, No.5–9, 200Gy treatment.No.6 and.7 have a band which does not appear in the controls,as indicated by the arrows.
图6 引物S82扩增结果M, marker-G;1–3, 对照;4–10, 100Gy 9和10中均缺失一条对照有的条带(箭头所示)Fig 6 RAPD bands patterns of S82.M, marker-G; No.1–3, control; No.4–10, 100 Gy treatment.A band in the control is not found in No.9 and 10, as indicated by the arrow.
3 讨论
辐射育种一般采用半致死剂量辐照后种子发芽率为50%的剂量作为适宜剂量。其他可采用的指标还包括种子发芽率、植株成活率、生长抑制程度等。本研究的对照及各辐照处理组的发芽率和成苗率均未达到50%,显然不能用半致死剂量。育种者也常以半致矮量(辐照后植株生长受抑制的程度)作为诱变剂量是否适宜的标准[20]。本实验中,200 Gy就可使黄连木幼苗高度降低到对照的一半,也即半致矮剂量接近200 Gy。况且,200 Gy组100 Gy组能得到更多的株型和叶形变异,也比400 Gy组有更高的成苗率。因此,200Gy是较合适的诱变剂量。这一点在RAPD分析中也得到证实,200 Gy组的植株变异率及条带变异率都明显高于100 Gy。有研究表明,小油桐种子的最佳辐照剂量为132–198 Gy[21],而毛竹种子为 100–175 Gy[22],与本实验的结论相近。
黄连木种子外被蜡质,属深度休眠类型,不能直接发芽,须经过100天左右的低温(4ºC)湿(砂)藏处理才能萌发。我们在试验中发现,去除种壳可打破黄连木种子休眠,故发芽试验的种子去除种壳。60Co g射线辐照处理后黄连木种子萌发率随剂量增加而下降,表明g射线辐照对种子的生活力有明显的影响。王兆玉等[21]在研究小油桐种子的60Co g射线辐射效应时,也得到了相似的结果。
60Co g射线辐照处理的黄连木种子,其成苗率及苗高均低于对照,且随辐照剂量增加而减小,600和800Gy组的成苗率几乎为零。用400Gy以上的辐照处理会对黄连木种子造成较严重的损伤,严重影响其发芽、成苗、生长,甚至致死。蔡春菊等[22]研究60Co g射线辐射对毛竹早期幼苗生长的影响时,剂量超过100Gy,早期苗高和根生长受到明显抑制,抑制作用随辐照剂量增大,与本实验的结果相似。
用RAPD方法对植株总DNA进行分析,不受表达产物显隐性影响,也不像同工酶等易受环境条件的影响,DNA水平发生的碱基突变、序列重排、缺失等引起的变异皆可检测到。本实验结果表明了60Co g射线辐照导致黄连木在生理生化水平和遗传水平的变异,且变异率随剂量增大,200Gy组的诱变效果较为理想。本实验经60Co g射线辐照得到的突变体,其变异性状能否稳定遗传,有待进一步观察和鉴定。
1 刘培荃, 杨世诚.植物燃料的研究现状及其发展[J].潍坊教育学院学报, 1997, 24(2): 37–39 LIU Peiquan, YANG Shicheng.Current status and development of the study on plant fuel [J].Journal of Weifang Educational College, 1997, 24(2): 37–39
2 石培礼, 包维楷.燃料油植物研究的现状与展望[J].植物杂志, 1994, 5: 2–4 SHI Peili, Bao Weikai.Current status and prospect of the study on fuel-oil plant [J].Plants, 1994, 5: 2–4
3 闵恩泽, 唐忠, 杜泽学, 等.发展我国生物柴油产业的探讨[J].中国工程科学, 2005, 7(4):1–4 MIN Enze, TANG Zhong, DU Zexue, et al.Perspective of biodiesel industry in China [J].Engineering Science, 2005,7(4):1–4
4 梁坤南.林产化工通讯, 我国热带地区燃料油植物资源的开发和利用[J].2006, 12:247–252 LIANG Kunnan.Development and utilization of fuel-oil plant resources in tropical regions of China [J].Journal of Chemical Industry of Forest Products, 2006, 12:247–252
5 祝学范.安徽省生物柴油原料林黄连木的造林技术研究[J].安徽农业科学, 2007, 35 (28):8890–8891 ZHU Xuefan.Study on afforestation technology of biodiesel forest–Pistacia chinensis Bunge in Anhui province [J].Journal of Anhui Agriculture Science, 2007,35 (28):8890–8891
6 王涛.中国主要生物质燃料油木本能源植物资源概况与展望[J].科技导报, 2005, 23(5):12–14 WANG Tao.A survey of the woody plant resources for biomass fuel oil in China [J].Science and Technology Review, 2005, 23(5):12–14
7 赵爱红, 吕敏生, 等.木本燃料油树种黄连木的播种育苗技术[J].中国果蔬, 2009, 1:22 ZHAO Aihong, LÜ Minsheng, et al.The grin breeding technology of the woody species of fuel oil — Pistacia chinensis Bunge [J].China Fruit and Vegetable, 2009, 1:22
8 秦飞.中国黄连木研究综述[J].经济林研究, 2007,25(4): 90–96 QIN Fei.Literature review of researches on Pistacia chinensis Bunge [J].Nonwood Forest Research, 2007,25(4):90–96
9 裴会明, 陈明琦.黄连木的开发利用[J].中国野生植物资源, 2005, 24(1):43–44 PEI Huiming, Chen Mingqi.Exploitation and utilization of Pistacia chinnesis Bunge [J].Chinese Wild Plant Resources, 2005, 24(1):43–44
10 侯新村, 牟洪香, 杨士春, 等.木本能源植物黄连木研究进展[J].安徽农业科学, 2007, 35(12):3524–3525 HOU Xincun, MU Hongxiang, YANG Shichun, et al.Research progress in woody energy plant — Pistacia chinensis Bunge [J].Journal of Anhui Agriculture Science,2007, 35(12):3524–3525
11 杨亚婷.60Co辐射创造柑橘突变体的研究[D].华中农业大学硕士学位论文, 2009 YANG Yating.Creation of citrus mutant through60Co radiation [D].Master's Degree Dissertation of Huazhong Agricultural University, 2009
12 梁秋霞, 曹刚强, 黄群策, 等.超低能离子束注入后番茄的生物学效应[J].激光生物学报, 2006, 15(4):388–393 LIANG Qiuxia, CAO Gangqiang, HUANG Qunce, et al.The biological effect of tomato by extra–low energy ion–beam irradiation [J].Acta Laser Biology Sinica,2006, 15(4):388–393
13 程世平, 施江, 史国安, 等.黄连木叶片基因组DNA提取方法[J].河南科技大学学报, 2010, 31(3):71–73 CHENG Shiping, SHI Jiang, SHI Guoan.Extraction of genomic DNA in Pistacia chinensis Bunge [J].Journal of Henan University of Science and Technology, 2010,31(3):71–73
14 王军, 杨传平, 刘桂丰.木本植物基因组 DNA 提取及鉴定[J].植物研究, 2006, 26(5): 590–594 WANG Jun, YANG Chuanping, LIU Guifeng.Extraction of genomic DNA from woody plants and it's identification [J].Bulletin of Botanical Research, 2006,26(5):590–594
15 Hong L, Walker M A.Extracting DNA from cambium tissue for analysis of grape rootstocks [J].Hort Science,1997, 32(7):1264–1266
16 王超.不同种源黄连木及阿月浑子遗传多样性分析[D].河北农业大学硕士学位论文, 2010 WANG Chao.Genetic diversity of different geographical populations of Pistacia chinensis Bunge and Pistacia vera[D].Master's Degree Dissertation of Agricultural University of Hebei, 2010
17 Prakash Surya, Van Staden Johannes.Sex identification in Encephalartos natalensis (Dyer and Verdoorn) using RAPD markers[J].Euphytica, 2006, 152:197–200
18 Hormaza J I, Dollo L, Polito V S.Identification of a RAPD marker linked to sex determination in Pistacia vera using bulked segregant analysis [J].Theor Appl Genet, 1994, 89:9–13
19 JI Jing, WANG Gang.Molecular markers of nuclear restoration gene Rfl in sunflower using bulked segregant analysis – RAPD [J].Science in China, 1996, 39:551–560
20 辛庆国, 刘录祥, 郭会君, 等.7Li离子束注入小麦干种子诱发M1代变异的SSR分析[J].麦类作物学报, 2007,27(4):560–564 XIN Qingguo, LIU Luxiang, GUO Huijun, et al.SSR analysis of M1 variation of dry seeds implanted by7Li ion beam in wheat [J].Journal of Triticeae Crops, 2007,27(4):560–564
21 王兆玉, 林敬明, 罗莉, 等.小油桐种子的60Co-g射线辐照敏感性及半致死剂量的研究[J].南方医科大学学报, 2009, 29(3):506–508 WANG Zhaoyu, LIN Jingming, Luo Li, et al.Sensitivity of Jatropha curcas seeds to60Co-g radiation and their medical lethal doses in radiation breeding [J].J South Med Univ, 2009, 29(3): 506–508
22 蔡春菊, 高健, 牟少华.60Co-g辐射对毛竹种子活力及期幼苗生长的影响[J].核农学报, 2007, 21(5):436–440 CAI Chunju, GAO Jian, MU Shaohua.Effects of60Co-gray radiation on seed vigor and young seedling growth of phyllostachys edulis [J].Journal of Nuclear Agricultural Sciences, 2007, 21(5):436–440
