高品质甜叶菊品系“1096”的组培快繁
2011-03-24郝再彬董振红李子院
郝再彬,董振红,李子院
(1.东北农业大学生命科学学院,哈尔滨150030;2.公主岭市第三高级中学,公主岭136100;3.桂林工学院材料与化学系,桂林541004)
高品质甜叶菊品系“1096”的组培快繁
郝再彬1,3,董振红2,李子院3
(1.东北农业大学生命科学学院,哈尔滨150030;2.公主岭市第三高级中学,公主岭136100;3.桂林工学院材料与化学系,桂林541004)
采用改良DNS等方法筛选出的生长快、糖苷含量高的甜叶菊品系“1096”为材料,研究了不同外植体、不同激素种类和配比对愈伤组织诱导、不定芽分化和生根的影响。结果表明:以茎尖为外植体愈伤组织和不定芽诱导率均最高;其次是带腋芽茎段;再次为叶片。无腋芽茎段和无菌根均能诱导出愈伤组织,但不能诱导成芽。茎尖不定芽诱导的最佳培养基为MS+6-BA 1.0mg/L;叶片不定芽诱导的最佳培养基为MS+6-BA 1.0mg/L+IAA 1.0mg/L;带腋芽茎段不定芽诱导的最佳培养基为MS+6-BA 1.5mg/L。不定芽继代增殖培养采用MS+6-BA 0.5mg/L+NAA 0.05mg/L;在1/4MS+IBA 0.1mg/L+NAA 0.1mg/L+1g/L活性炭的培养基上诱导生根,生根率可达100%,生根苗移栽后成活率达95%。
甜叶菊;组织培养;愈伤组织;试管苗
甜叶菊(Stevia rebaudiana Bertoni)又名“甜菊”、“甜草”(杨丹等,2005),是一种小型多年生菊科(Compositae)斯台维亚属草本植物,原产于南美巴拉圭高原(王贵民等,2007),几个世纪以来甜叶菊一直被当地居民作为甜味饮料饮用(Yao等,1999)。从甜叶菊叶片中提取出来的糖苷以其高甜度、低热量、安全无毒(Matsui等,1996)等特点,逐渐受到糖尿病、肥胖症患者的青睐;Chan等(2000)研究表明,甜叶菊糖苷中的stevioside有明显的降压功效,且无毒副作用;甜叶菊糖苷对小儿龋齿、肥胖症、心脏病等均有防治功能和辅助疗效(张贤泽等,1996);在南美洲、东南亚、远东地区,甜叶菊糖苷已被广泛应用于食品和医药领域(Bovanová等,1998)。甜叶菊为自交不育异花授粉植物,遗传稳定性差,0℃以下不能越冬,且种子发芽率低,仅靠种子繁殖无法满足市场上对甜叶菊的需求。采用组织培养技术不仅能保持品种的优良特性,还可不受外界条件的影响周年繁殖,在较短时间内,即可繁育出大批种苗,因此利用组织培养技术对甜叶菊进行快速繁殖具有广阔的市场前景。本实验室采用改良DNS(郝再彬等,2006)方法筛选出的甜叶菊优良品系,编号“1096”主要特征如下:1)干叶中甜叶菊糖苷的含量为15%;2)植株的平均高度为1.5m;3)叶片大,平均24个节数,茎秆粗壮,生长迅速,适应性强;公顷产干叶片平均为2250kg;4)抗旱能力强,具有生产应用价值。近几年国内外已有一些关于甜叶菊组织培养的报道(吕荣华等,1998;黄苏珍等,1999;Sivaram等,2003;赫福霞等,2005;Uddin等,2006;董振红等,2008)。本试验在总结前人经验的基础上,探讨了高品质甜叶菊品系“1096”的组织培养条件,以期建立“1096”稳定的植株再生体系,为其在生产上的应用推广以及开展基因工程育种等奠定基础。
1 材料与方法
1.1 实验材料
甜叶菊品系“1096”。
1.2 实验方法
1.2.1 外植体和消毒取“1096”侧枝的幼嫩茎尖、叶片、茎尖诱导成苗的无菌苗带腋芽和无腋芽茎段及无菌根为外植体。茎尖及叶片先用蒸馏水冲洗干净,然后在超净工作台上用70%的酒精消毒10s,无菌水冲洗1~2次,再用0.1%的升汞(HgCl2)溶液浸泡4min,无菌水冲洗4~5次后,即可进行接种培养。
1.2.2 诱导培养茎尖:用镊子掐取已消毒好的茎尖端约0.5cm,接种于茎尖诱导培养基中,4周后计算增殖倍数,计算公式如下:增殖倍数=分化出的总不定芽数/成活外植体数×100%。叶片:将叶片切成0.5cm2左右的小块,接种于叶片诱导培养基中(表2)。试管苗无腋芽茎段切成厚度为0.2cm左右的小圆片,无菌根段切成0.5cm左右的小段,分别接种于附加KT 1.0mg/L,6-BA 1.0 mg/L,IAA 1.0 mg/L,NAA 0.1 mg/L,CH 400 mg/L的1/4MS,1/2MS及MS培养基中,每个处理分别接种40个外植体,定期观察统计结果。
1.2.3 继代增殖培养当不定芽长至1~2cm时,将其转入以下继代培养基,D1:MS+6-BA 0.5mg/L+NAA 0.5mg/L;D2:MS+6-BA 0.5mg/L+NAA 0.05mg/L;D3:MS+6-BA 1.0mg/L+NAA 0.1mg/L;D4:MS+6-BA 1.0mg/L+ NAA 1.0mg/L,进行继代增殖培养,定期观察统计结果。
1.2.4 不定芽生根及移栽将长至2cm左右的不定芽从愈伤组织上切下,接种于以下培养基,E1:1/4 MS+ IBA 0.1mg/L;E2:1/4MS+IBA 0.1mg/L+NAA 0.1mg/L;E3:1/4MS+NAA 0.1mg/L;E4:1/4MS,诱导生根,定期观察统计根的生长情况;待苗长出发达的根系后,先敞口炼苗2d,在含1/8MS+IBA 0.05mg/L+NAA 0.05 mg/L+蔗糖15g/L的培养液中浸根2d,然后洗净根系上的培养基(黄宁珍等,2007),将苗转入装有土沙的小塑料培养杯中,并浇少量培养液(1/20MS),室温阴湿处放置4~5d,每1~2d浇1次水,待小苗成活后,温度适宜时再移于大田栽培。
1.2.5 培养条件培养温度(25±1)℃,相对湿度60%~70%,光照强度2000~3000μmol/(m2.s),先暗培养2d,再进行24h/d的光培养。基本培养基MS,附加3%蔗糖、6%琼脂,各培养基在高压灭菌前pH均调至5.8。
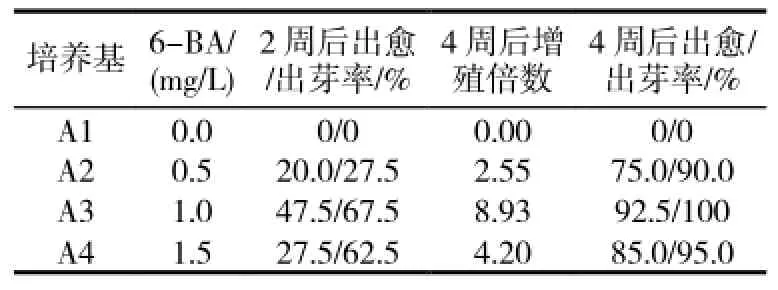
表1 6-BA对“1096”茎尖不定芽诱导的影响
2 结果与分析
2.1 愈伤组织与不定芽的诱导
2.1.1 6-BA对茎尖愈伤组织诱导和不定芽分化的影响在不加任何激素的培养基中,茎尖无愈伤组织及不定芽的分化,但3~4d后,在附加6-BA 0.5、1.0、1.5mg/L的培养基中外植体基部有的已开始膨大,5~7d后开始有嫩绿的不定芽出现,同时部分外植体基部形成愈伤组织。随着小芽的不断长高,在芽的基部出现数量不等的丛生芽(图1-A),4周后,6-BA浓度为1.0mg/L时,不定芽增殖最多(表1)。故MS+6-BA 1.0mg/L为“1096”茎尖不定芽诱导最适培养基。
2.1.2 不同激素组合对叶片愈伤组织诱导及分化的影响添加不同激素的培养基对“1096”叶片愈伤组织诱导及分化的影响不同(表2)。经过3周左右的培养,甜叶菊叶片切块在不同培养基中均有愈伤组织形成,并随培养天数的增加,逐渐增多,其中单独添加6-BA以及6-BA与NAA组合,愈伤组织诱导率最高,都可达到100%,其诱导出的愈伤组织均呈致密绿色小颗粒状(图1-B),但这些愈伤组织或不能再继续分化或分化率极低,且要到6周后才有芽点出现,8周后小芽才可长大到足以切下进行继代培养;6-BA与IAA组合都仅在叶片切口处形成少量的愈伤组织,3周后即可在切口处或叶块中央不同位置看到小的丛生芽(图1-C),6周后即可进行继代培养。由表2中的统计情况可知最佳的叶片不定芽诱导培养基为B6。
2.1.3 不同浓度激素组合对带腋芽茎段诱导及分化的影响在C1和C3培养基(表3)中,带腋芽茎段接种3~4d后腋芽就开始萌发,7d后开始在基部形成愈伤组织,4周后萌发的小苗已具有3~5片正常叶,其中C3培养基中平均出芽数最高,而C2、C4培养基中4周后会发现个别茎段的基部有褐化出现,个别芽从新生的叶片上长出,形态不规则(图1-D),平均出芽数也没有另两组培养基高。故C3为甜叶菊带腋芽茎段愈伤组织诱导及分化最适培养基。
2.1.4 不同培养基对无腋芽茎段及无菌根愈伤组织诱导的影响4周后观察,在几种培养基中无腋芽茎段愈伤组织诱导率都在90%以上,但以MS中的愈伤组织长势最好,呈淡绿色颗粒状(图1-E),1/4MS,1/2MS中为淡黄色或浅褐色;无菌根段的出愈率分别为45%,85%和50%,1/2MS中的愈伤组织长势明显好于其他两种培养基,呈疏松颗粒状(图1-F),但都有不同程度的褐化出现,且无论哪种愈伤组织都没能诱导出芽。
2.2 继代增殖培养
以MS为基本培养基,附加不同激素组合进行继代增殖培养。4周后观察,D2组增殖倍数达15.6(图1-G),最适宜甜叶菊的继代增殖培养,D3组次之,增殖倍数为14.3;但是D1,D4组增殖倍数都不及10,D2、D3组合4周后如不及时转瓶,就会出现褐化现象,说明等浓度使用6-BA,NAA两种激素可降低组织培养中的褐化率。
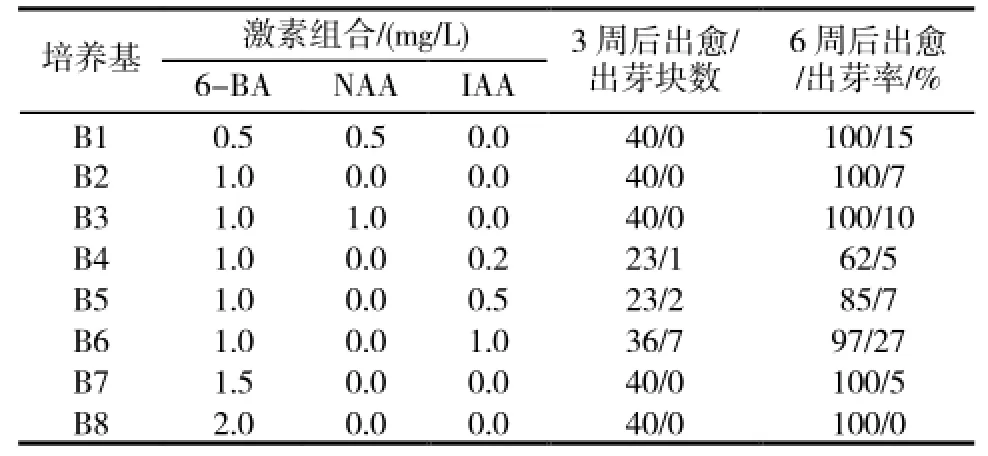
表2 激素组合对“1096”叶片愈伤组织诱导及分化的影响
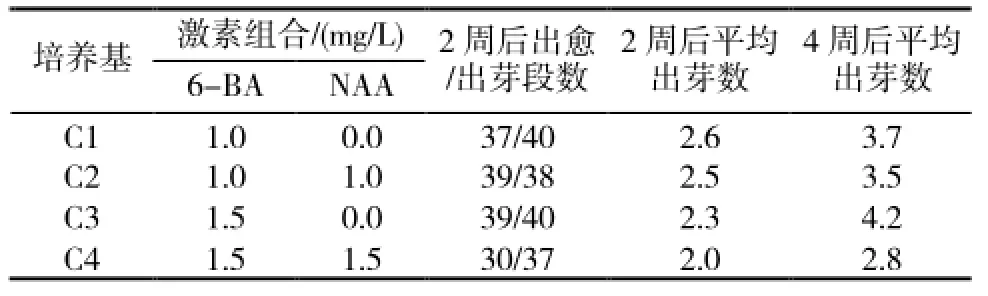
表3 激素组合对“1096”带腋芽茎段诱导及分化的影响
2.3 不定芽的生根与移栽
生根培养1周左右即可见E1~E3中陆续生根,40d后观察(表4),E2中诱导出的根,长、粗适宜,苗壮(图1-H),移栽更易成活,E4培养基上苗的叶色较前几种培养基中的稍淡,呈黄绿色,但不影响株高的生长,且也长出了极少量的不定根;试管苗移栽到小培养杯30d后观察发现,E1~E3组(表4)苗均长至10cm以上,叶色鲜绿,茎不断长高增粗,60d后,E2组苗长势最好,表现为茎粗,叶肥大,苗较高(图1-I),成活率最高达95%;但E4组,无论是苗的长势还是成活率都远不及前三组,说明诱导出良好的根系是甜叶菊移栽成功的关键。
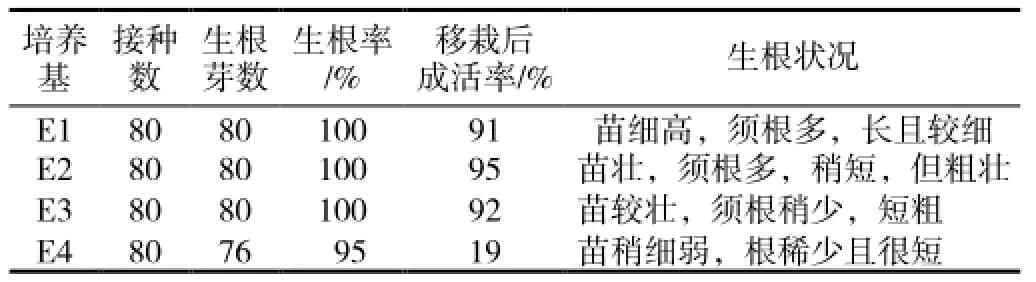
表4 不同培养基对“1096”不定芽生根的影响

图1 不同外植体从诱导到成苗及移栽的各个阶段
3 讨论
3.1 外植体的选择
甜叶菊进行组织培养时,外植体的选取至关重要。在本试验所选取的外植体中,因培养基筛选范围有限,其中叶片的诱导出芽率低,不到50%,但娄玉霞等(2000)研究认为,在添加BA 0.5mg/L和NAA 0.05mg/L的MS培养基上可诱导叶片愈伤组织分化不定芽,分化频率为100%,可能是因为所用材料不同,导致试验结果不同。无腋芽茎段、无菌根则不能诱导出芽,还需要进一步试验、筛选。选用“1096”茎尖及试管苗带腋芽茎段为外植体,无论是愈伤组织诱导率,还是出芽率都较为理想,这可能与其较强的分生能力有关。
3.2 继代增殖培养
在植物组织培养过程中,由愈伤组织分化为根和芽是由细胞分裂素与生长素含量的比值决定的,比值高时,促进芽的形成。故本试验采用调整6-BA与NAA的浓度比例,来提高丛生芽的分化率。
3.3 不定芽生根及移栽
IBA和NAA均可诱导不定芽生根,但IBA诱发的根细长,而NAA诱发的根短粗,将二者结合使用,则起到了一定的加合作用,诱发出的根具有长、粗、多等特点;移栽最好待试管苗长至5~7cm以上,根系发达时进行,此时苗的抗性较强,根系较完全,易于成活。为了避免感染细菌,开口炼苗2~3d为宜。在培养液中培养不应超过2d,否则培养液会因感染细菌而浑浊。如培养液已经出现浑浊,应先将苗用70%的酒精消毒处理后再移栽。移栽后观察发现用1/20的培养液浸过的土壤较未浸过的易感染病菌,所以在以后的重复试验中采用水来代替1/20培养液。
[1]杨丹,郝再彬.流动注射化学发光法测定甜叶菊糖苷[J].化学工程师,2005(4):23-24.
[2]王贵民,董振红,郝再彬.甜叶菊糖苷的应用和安全性的研究进展[J].中国食品添加剂,2007,6:65-69.
[3]Y.Yao,M.Ban,J.Brandle.A genetic linkage map for Stevia rebaudiana[J].Genome,1999,42(4):657-661.
[4]M.Matsui,K.Matsui,Y.Kawasaki,et al.Evaluation of the genotoxicity of stevioside and steviol using six in vitro and one in vivo mutagenicity assays[J].Mutagenesis,1996,11(6):573-579.
[5]Chan P,Tomlinson B,Chen YJ,et.al.A double-blind placbo-controlled study of the effectiveness and tolerability of oral stevioside in human hypertension[J].British Journal of Clinical Pharmacology,2000,50,(3):215-220.
[6]张贤泽,何毓娟.大力开发利用新糖源-甜叶菊[J].中国糖料,1996(2):55-58.
[7]Ludmila Bovanová,E.Brandsteterová,Stanislav Baxa.HPLC determination of stevioside in plant material and food samples[J]. European Food Research and Technology,1998,207(5):352-355.
[8]郝再彬,杨丹,一井真比古.快速测定甜叶菊糖含量的方法及其专用试剂[P].中国:200510010277.3,2006.
[9]吕荣华,莫志南.甜叶菊的组织培养[J].广西农业科学,1998(5):269.
[10]黄苏珍,韩玉林,谢明云,等.甜叶菊“中山一号”快速繁殖研究[J].特产研究,1999(4):48-49.
[11]Sivaram Latha,Mukundan Usha.In vitro culture studies on Stevia rebaudiana[J].In Vitro Cellular&Developmental Biology,2003,39(5):520-523.
[12]赫福霞,于晶,李茫雪,等.多因子正交试验对甜叶菊丛生芽诱导条件的筛选[J].中国农学通报,2005,21(7):79-81.
[13]Uddin Salim Mohammed,Chowdhury Shaheed Hossain Mohammad,Khan Mahfuzul Haque Muoztaba M,et al.In vitro propagation of Stevia rebaudiana Bert in Bangladesh[J].African Journal of Biotechnology,2006,5(13):1238-1240.
[14]董振红,王贵民,王彦超,郝再彬.甜叶菊茎尖组培苗生根及移栽的研究[J].中国糖料,2008(2):28-29.
[15]娄玉霞,宋磊,李心国,等.甜叶菊叶片离体培养及试管无性系的建立[J].上海师范大学学报//自然科学版,2000,29(4):74-77.
Tissue Culture Propagation of High Quality Stevia rebaudiana Bertoni Strain"1096"
HAO Zai-bin1,3;DONG Zhen-hong2;LI Zi-yuan3
(1.College of Life Sciences,Northeast Agricultural University,Harbin,Heilongjiang150030,China;2.The Third Senior Middle School of Gongzhuling,Gongzhuling,Jilin 136100,China;3.Department of Material and Chemistry,Guilin University of Technology,Guili,Guangxi 541004,China)
The effects of different combinations of growth substances and explants on callus induction,bud differentiation and root formation were investigated in rapid growth and high steviol-glucosides content Stevia rebaudiana Bertoni Strain"1096",which was screened by improved DNS method.The results showed that stem apex seemed to be the best explant for callus induction and bud differentiation,followed by stem segment with axillary bud and the third was leaf.Both the stem segment without axillary bud and root of plantlets could be induced to form calli but not adventitious buds.The optimal combinations of 6-BA for adventitious bud induction on stem apex was 1.0mg/L,on stem segment with axillary bud was 1.5mg/L on MS medium;The best adventitious buds induction medium from leaves was MS medium with 1.0mg/L 6-BA and 1.0mg/L IAA.The proliferation culture medium for bud differentiation was MS medium with 0.5 mg/L 6-BA and 0.05 mg/L NAA.Rooting medium is 1/4MS+IBA 0.1 mg/L+NAA 0.1mg/L+active carbon l.0g/L,the rooting rate reached up to 100%,transplant survive was 95%.
Stevia rebaudiana Bertoni;tissue culture;callus;plantlet
S566.9
A
1007-2624(2011)03-0009-03
2011-02-16
黑龙江省教育厅(11511033);广西科技厅(桂科回0731021);桂林理工大学;广西环境工程与保护评价重点实验室(桂科能0701K017);广西新材料及其制备新技术重点实验室(桂科能0842003-35)。
郝再彬(1958-),男,黑龙江省哈尔滨市人,教授,博士生导师。E-mail:haozaibin2010@126.com
