饲料中添加两种寡糖和一种芽孢杆菌对牙鲆肠道菌群的影响
2011-03-18王琨孙云章李富东叶继丹
王琨,孙云章,李富东,叶继丹
(集美大学厦门市饲料检测与安全评价重点实验室,福建厦门361021)
饲料中添加两种寡糖和一种芽孢杆菌对牙鲆肠道菌群的影响
王琨,孙云章,李富东,叶继丹
(集美大学厦门市饲料检测与安全评价重点实验室,福建厦门361021)
在饲料中单独或联合添加果寡糖(FOS)、甘露寡糖(MOS)和克劳氏芽孢杆菌Bacillus clausii,共配制8种试验饲料,分别为对照组(不添加寡糖和芽孢杆菌)、5 g/kg FOS(F组)、5 g/kg MOS(M组)、2.5 g/kg FOS+2.5 g/kg MOS(FM组)、107CFU/g B.clausii(B组)、5 g/kg FOS+107CFU/g B.clausii(FB组)、5 g/kg MOS+107CFU/g B.clausii(MB组)和2.5 g/kg FOS+2.5 g/kg MOS+107CFU/g B.clausii(FMB组)。用8种饲料饲喂牙鲆Paralichthys olivaceus 56 d后,取牙鲆肠道用2216E琼脂培养基培养肠道细菌,并进行16S rRNA基因测序鉴定。结果表明:从各组牙鲆肠道中共检出细菌11种,其中共有细菌为表皮葡萄球菌Staphylococcus epidermidis、弗尼斯弧菌Vibrio furnissii、鲍氏不动杆菌Acinetobacter baumannii、溶酪大球菌Macrococcus caseolyticus、铅黄肠球菌Macrococcus caseolyticus和施氏假单胞菌Pseudomonas stutzeri;各试验组(除B组外)肠道可培养细菌总数低于对照组,且FMB组最低;各试验组(B组除外)的表皮葡萄球菌、弗尼斯弧菌数、鲍氏不动杆菌和溶酪大球菌数明显低于对照组;F组、M组和FM组肠道优势菌与对照组基本相似,B组、FB组和FMB组的优势菌与对照组差异较大;各试验组的铅黄肠球菌和施氏假单胞菌比例均大幅度高于对照组。在试验饲料中添加FOS、MOS和B.clausii可不同程度地抑制牙鲆肠道病原菌,有利于改善牙鲆肠道健康,且寡糖与B.clausii联合使用表现出一定的协同作用。
牙鲆;果寡糖;甘露寡糖;克劳氏芽孢杆菌;肠道菌群
在鱼类集约化养殖中,高密度饲养导致的应激可降低鱼体抗病力,诱发病害甚至暴发疾病[1]。为了防控病害,养殖者最先考虑使用抗生素,但抗生素使用不当而产生的抗药性、药残等食品安全问题已引起人们的重视[2],因此,寻找适宜的抗生素替代品成为当前水产养殖业最为紧迫的任务之一。鱼类消化道微生物区系由好氧菌、兼性厌氧菌和绝对厌氧菌组成[3],并随年龄、营养状况和生长环境而不断变化[4],与鱼类生长和健康关系密切。研究表明,功能性寡糖能够被肠道有益菌利用,调节肠道微生态平衡[5],而益生菌通过竞争黏附位点[6]和营养[7]来抑制病原菌生长,促进有益菌的增殖,从而促进动物健康生长。在研究功能性寡糖和益生菌对肠道菌群的影响时,研究者通常使用其中一种,较少对两种以上的寡糖和益生菌的使用效果进行比较。本试验中,作者将果寡糖(fructo oligosaccharides,FOS)、甘露寡糖(mannan oligosaccharides,MOS)和一株鱼源克劳氏芽孢杆菌Bacillus clausii分别作为益生元和益生素,单独或联合添加在饲料中饲喂牙鲆Paralichthys olivaceus 56 d后,采用16S rRNA基因测序等方法鉴定肠道菌群,探讨果寡糖、甘露寡糖与克劳氏芽孢杆菌的不同添加方式对肠道菌群结构的影响,为功能性寡糖与益生菌在牙鲆饲料中的合理配伍和使用提供参考资料。
1 材料与方法
1.1 试验饲料
将饲料原料(预混料、鱼油除外)用粉碎机粉碎后过60目网筛,并在105℃下烘1 h ,以杀灭病原微生物。果寡糖购自广东江门量子高科技生物工程有限公司(果寡糖的纯度≥95%),甘露寡糖购自美国奥特奇公司(甘露寡糖的纯度≥20%)。多种维生素和多种矿物质由厦门海康生物技术有限公司提供。克劳氏芽孢杆菌B.clausii由集美大学福建省高校水产科学与食品安全重点实验室从斜带石斑鱼Epinephelus coioides肠道中分离的。
试验中共配制8组饲料,分别为:对照饲料(对照组,不添加寡糖和芽孢杆菌)、5 g /kg FOS (F组)、5 g /kg MOS(M组)、2.5 g /kg FOS+2.5 g/kg MOS(FM组)、107CFU/g B.clausii(B组)、5 g /kg FOS+107CFU/g B.clausii(FB组)、5 g /kg MOS+107CFU/g B.clausii(MB组)和2.5 g /kg FOS+2.5 g /kg MOS+107CFU/g B.clausii(FMB组)。各组试验饲料配方及营养水平见表1。将芽孢杆菌用营养肉汤活化36 h (细菌浓度达109CFU/mL),于4℃下以5 000 r/min离心10 min,去掉上清液;将收集的细菌用生理盐水稀释,平均分成4份,分别用喷雾器均匀喷涂到B组、FB组、MB组和FMB组饲料中,使这4组试验饲料中的芽孢杆菌数量为107CFU/g。将8组试验饲料用双螺杆制粒机制成5.0 m m的颗粒饲料,再用鼓风干燥机干燥(45℃)后,用塑料袋密封,-20℃下贮藏备用。
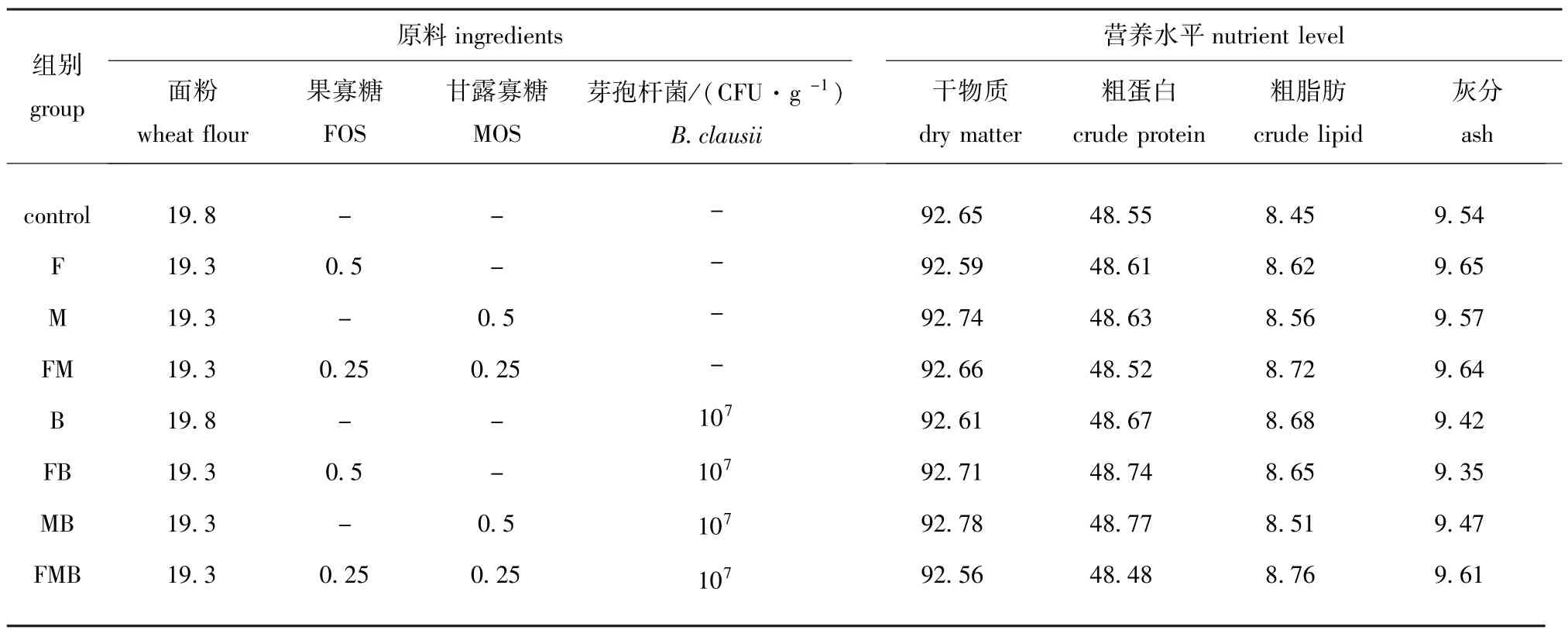
表1 试验饲料配方及营养成分(干重)Tab.1 Ingredients and proximate composition of the experimental diets(in dry matter)w/%
1.2 方法
1.2.1 饲养管理 将健康牙鲆暂养于福建漳浦县杨旺木水产养殖场的室内水泥池(6 m ×3 m ×1.5 m)中,每天换水2次,换水量约为养殖水体的3/4。暂养时间为10 d ,每天定量投喂商品饲料。将牙鲆禁食24 h 后分箱,从暂养池中挑选规格相近的牙鲆随机分配到24个网箱(60 cm ×50 cm ×60 cm)中,每箱放鱼20尾(体质量为21.35 g ±0.20 g)。本试验中共设8组,分别投喂8种饲料。每组设置3个重复。试验期间,每天投喂2次(7:30、17:30),投喂量以牙鲆达到接近饱食程度为准。投喂30 min后吸底,清除粪便,换水,定期清洗池壁和网箱。每天记录水温变化,观察牙鲆的摄食情况和健康状况,记录牙鲆的死亡数量。试验共进行56 d 。
1.2.2 样品的采集与处理 试验结束后,禁食48 h,每箱随机取3尾鱼,用酒精棉球擦拭鱼体表面,用灭菌工具解剖,取出肠道。为了减少个体差异,将3尾牙鲆肠道样品合并,放入已灭菌的样品瓶中,称量肠道质量。
1.2.3 肠道细菌培养 向肠道样品中加入4 mL的灭菌生理盐水,在冰水浴中匀浆。取匀浆液0.1 mL,加入到0.9 mL的灭菌生理盐水中,按梯度稀释,取10-2、10-3和10-4稀释液各100 μL,分别涂布在2216E琼脂培养基(青岛海博生物技术有限公司)平板上,每个梯度设2个平行。将涂布好的平板在洁净操作台上正放,静置数分钟后再将平板倒置,于恒温培养箱(28℃)中培养。
1.2.4 肠道细菌DNA的提取 将细菌接种到液体营养肉汤中,恒温(28℃)下在摇床上活化培养48 h,吸取4 mL菌液以12 000 r/min离心10 min,收集沉淀,即为活菌体,用无菌生理盐水冲洗2次,再用TE缓冲液(10 mmol/L Tris,1 mmol/L EDTA,pH为8.0)制备混悬液用于提取DNA。采用天根生化科技(北京)有限公司生产的试剂盒提取DNA。选择细菌生长疏密适当的平板观察菌落形态,根据菌落大小、光泽、质地、边缘特征、表面特征、隆起形状、透明度、菌落及培养基的颜色、生长速度等特征和培养性状,结合革兰氏染色初步进行分类编号,统计各种类型菌落的数量,并挑取优势种群单菌落纯化保存,待鉴定。
1.2.5 PCR扩增 以细菌通用引物8f(5'-CAC GGA TCC AGA GTT TGA T(C/T)(A/C)TGG CTC AG-3')和1510r(5'-GTG AAG CTT ACG G (C/F)T ACC TTGTTACGA CTT-3')扩增细菌16S rRNA基因片段。采用50 μL的PCR反应体系: 31.75 μL的无菌ddH2O,5 μL的dNTP mix(2.0 mmol/L),5 μL的MgCl2(25 mmol/L),5 μL的10 ×PCR buffer(无Mg2+),1 μL的引物8f(20 μmol/L),1 μL的引物1510r(20 μmol/L),0.25 μL的Taq DNA polymerase(5 U/μL)以及1 μL的模板DNA(50 ng/μL)。
PCR的反应条件为:94℃下预变性4 min;94℃下变性45 s,60℃下退火60 s,72℃下延伸60 s,如此进行30个循环;最后在72℃下再延伸7 min。取5 μL PCR产物用12 g/L琼脂糖凝胶进行电泳检测。
1.2.6 测序结果比对与细菌数量统计 将PCR扩增产物送交英骏生物公司进行纯化、测序。将测序结果在网上进行BLAST序列比对(http:// www.ncbi.nlm.nih.gov/BLAST/),获得最相似菌,然后结合其对应编号的菌落数量,计算该种细菌数量。细菌数量以每克肠道所含的细菌数(1og (CFU/g))表示,并计算每组该种细菌数的均值。
1.3 统计分析
实验数据用SPSS 11.5统计软件进行单因数方差分析,差异显著时进行Duncan氏多重比较。
2 结果
2.1 牙鲆肠道细菌种类与数量的变化
通过肠道细菌培养、DNA的提取、PCR扩增以及测序结果比对,从各组牙鲆肠道中共检出细菌11种,其中共有细菌为表皮葡萄球菌Staphylococcus epidermidis、弗尼斯弧菌Vibrio furnissii、鲍氏不动杆菌Acinetobacter baumannii、溶酪大球菌Macrococcus caseolyticus、铅黄肠球菌Macrococcus caseolyticus和施氏假单胞菌Pseudomonas stutzeri。
从表2可见:除B组外,F、M、FM、FB、MB和FMB组牙鲆肠道可培养细菌总数较对照组有明显下降(P<0.05),且FMB组的肠道可培养细菌总数最低;除B组外,F、M、FM、FB、MB和FMB组表皮葡萄球菌和弗尼斯弧菌数明显低于对照组(P<0.05);各试验组鲍氏不动杆菌和溶酪大球菌数较对照组明显减少(P<0.05);除FB组铅黄肠球菌数高于对照组外(P<0.05),其余各试验组与对照组差异不明显(P>0.05);各试验组施氏假单胞菌的数量与对照组差异不明显(P>0.05)。另外,希瓦氏菌Shewanella loihica和恶臭假单胞菌Pseudomonas putida仅在对照组中检出,副溶血弧菌Vibrio parahaemolyticus仅在对照组和F组中检出,沃氏葡萄球菌Staphylococcus warneri仅在FM和MB组中检出,海滨赤细菌Erythrobacter litoralis仅在MB组中检出。
2.2 牙鲆肠道菌群结构的变化
从表2还可见:对照组牙鲆肠道中的优势菌为鲍氏不动杆菌(43%)、溶酪大球菌(37%)和弗尼斯弧菌(17%);F组牙鲆肠道中鲍氏不动杆菌(58%)的优势更加明显,而溶酪大球菌(12%)和弗尼斯弧菌(9%)的优势大为降低,铅黄肠球菌(11%)则上升为优势菌;M组和FM组牙鲆肠道中的优势菌与F组的大体一致;B组牙鲆肠道中的优势菌为表皮葡萄球菌(48%)、弗尼斯弧菌(34%)和溶酪大球菌(10%),与对照组比,弗尼斯弧菌优势明显,溶酪大球菌优势下降,鲍氏不动杆菌则变为非优势菌;FB组牙鲆肠道中的优势菌为溶酪大球菌(37%)、铅黄肠球菌(35%)和弗尼斯弧菌(16%),鲍氏不动杆菌则变为非优势菌;MB组牙鲆肠道中的唯一优势菌为溶酪大球菌(71%);FMB组牙鲆肠道中溶酪大球菌(45%)仍为优势菌,鲍氏不动杆菌(23%)和施氏假单胞菌(11%)成为优势菌,表明B.clausii可降低鲍氏不动杆菌在牙鲆肠道中的比例,果寡糖、甘露寡糖与B.clausii联合添加可提高溶酪大球菌在肠道中所占的比例。各试验组中铅黄肠球菌和施氏假单胞菌所占比例较对照组均有较大的增加,其中前者的增加幅度较后者更大。希瓦氏菌、恶臭假单胞菌、副溶血弧菌、沃氏葡萄球菌和海滨赤细菌在个别试验组中虽有检出,但除沃氏葡萄球菌外,其它细菌所占比例均较低。
3 讨论
鱼类肠道菌群的组成和数量主要受水体中微生物、水体温度、盐度、饵料、药物、鱼体的不同发育阶段与生理状态等的影响[8]。弧菌和假单胞菌是海水鱼消化道中最常见的细菌[9],而乳酸菌极少在鱼类肠道中检出。有关牙鲆消化道菌群结构的报道较少。Sugita等[10]用海水琼脂培养基从牙鲆幼鱼肠道中共分离到12个属的细菌,其中气单胞菌属Aeromonas、莫拉氏菌属Moraxella和弧菌属Vibrio是牙鲆幼鱼肠道中的主要优势菌,另外还有不动杆菌属Acinetobacter、棒状杆菌属Corynebacterium、芽孢杆菌属Bacillus、肠杆菌属Enterobacter、微球菌属Micrococcus、葡萄球菌属Staphylococcus和假单胞菌属Pseudomonas等,肠道中可培养细菌总数为3.6×105~6.0×107CFU/g。本研究中也使用2216E海水琼脂培养基,结果从牙鲆幼鱼肠道中共分离得到11种细菌,牙鲆肠道可培养细菌总数为8.96×105~2.46×107CFU/g,这与Sugita等[10]的结果相似;但果寡糖、甘露寡糖和B.clausii处理组细菌总数大体上比对照组少,表皮葡萄球菌、弗尼斯弧菌数、鲍氏不动杆菌和溶酪大球菌数也较对照组少,这与施用抗生素减少鱼类肠道中细菌数量的作用相似[2]。此外,B.clausii与果寡糖、甘露寡糖联合添加能协同抑制牙鲆肠道中鲍氏不动杆菌,并使恶臭假单胞菌和副溶血弧菌降低到检出限以下。使用选择性培养基研究肠道菌时,结果发现,功能性寡糖可以增加陆生恒温动物肠道有益菌(如乳酸菌[11-14]和双歧杆菌[11,13])的数量,降低有害菌(如沙门氏菌Salmonella sp.[15]、大肠杆菌E.coli[12-14]和产气荚膜梭菌Clostridium perfringens[16])的数量。在鱼类饲料中应用功能性寡糖也得到类似结果,如张红梅[17]和李云兰[18]报道了甘露寡糖也能显著促进鲤肠道中乳酸杆菌和双歧杆菌增殖,抑制大肠杆菌的生长。饲料中添加鼠李糖乳杆菌P15增加了牙鲆肠道中乳酸菌的数量,减少了弧菌的数量[19];嗜酸乳酸菌和双歧杆菌不影响大菱鲆幼鱼肠道中的总细菌数量,但降低了弧菌数量[20]。Urdaci等[21]的研究表明,B.clausii分泌的抗菌物质能有效地抑制革兰氏阳性菌,尤其是金黄色葡萄球菌Staphylococcus aureus、屎肠球菌Enterococcus faecium和艰难梭状芽胞杆菌Clostridium difficile。饲料中添加枯草芽孢杆菌B115制剂能够明显增加银鲫和翘嘴红鲌肠道中乳酸杆菌的数量,但不影响气单胞菌、肠杆菌和肠球菌的数量[22]。
本试验中检出的表皮葡萄球菌、恶臭假单胞菌和副溶血弧菌都是海水鱼的主要致病菌[23],鲍氏不动杆菌[24]和弗尼斯弧菌[25]也是水产动物重要的致病菌。本试验结果显示,饲喂果寡糖和甘露寡糖减少了牙鲆肠道中弗尼斯弧菌、鲍氏不动杆菌、表皮葡萄球菌和溶酪大球菌的数量,并降低弗尼斯弧菌和溶酪大球菌在肠道菌群中的比例。同样,饲喂B.clausii可使牙鲆肠道中表皮葡萄球菌、铅黄肠球菌和施式假单胞菌的数量分别比对照组增加了3.4倍、1.2倍和0.4倍,同时增加了它们在肠道菌群中的比例;而鲍氏不动杆菌和溶酪大球菌数量分别比对照组减少99%和91%,并降低了它们在肠道菌群中的比例,并且果寡糖、甘露寡糖与B.clausii联合使用后对这些肠道菌的抑制作用更为明显。另外,希瓦氏菌、恶臭假单胞菌、副溶血弧菌、沃氏葡萄球菌和海滨赤细菌仅在个别试验组中检出,但除沃氏葡萄球菌外其它细菌的检出率很低,优势不明显。这些结果表明,饲料中单独或联合添加果寡糖、甘露寡糖和B.clausii能够影响牙鲆肠道菌群的数量和组成。但Dimitroglou等[26]利用DGGE技术分析了肠道细菌的组成,结果发现,使用甘露寡糖增加了金头鲷Sparus aurata肠道菌群数量和丰度,这与本试验结果不同。
在正常情况下,鱼类肠道对外源微生物有明显的选择性[27]。王福强等[28]的研究表明,鼠李糖乳杆菌和干酪乳杆菌均可以在牙鲆消化道内定植,且定植部位主要在小肠,而广布肉杆菌虽然可以在虹鳟肠道内定植,但定植效果不佳,停喂3 d后广布肉杆菌的数量明显下降[29]。本研究结果显示,投喂B.clausii后,未能从牙鲆幼鱼肠道中分离到该菌。究其原因,可能有两个:第一,本研究中使用的B.clausii是分离自斜带石斑鱼肠道,此菌株可能无法在牙鲆的肠道中定植或定植效果不佳;第二,在取样时,牙鲆已禁食48 h,导致肠道中B.clausii数量下降,在微生物培养过程中未形成优势菌落,从而未被检出。
动物肠道的微生态区系较复杂,微生物数量庞大,其中大多数在现有培养技术下不可培养,而且鱼类肠道菌群的组成和数量与外界环境及自身生理状况的关系密切[4,30],不同鱼类、不同生理阶段和不同的生活环境其肠道菌群也存在很大差异[8,31],难以比较不同的试验结果。本研究中没有从牙鲆肠道中分离到乳酸菌和芽孢杆菌等益生菌,也未分离到大肠杆菌等病原菌,可能与没有使用专一性的培养基有关。
[1] Torrecillas S,Makoi A,Cabaliero M J,et al.Immunostimulations and improved infection resistance in European sea bass(Dicentrarchus labrax)fed mannan oligosaccharides[J].Fish&Shellfish Immunology,2007,23:969-981.
[2] Serrano P H.Responsible use of antibiotics in aquaculture[R]. Rome:FAO Fisheries Technical Paper,2005:1-97.
[3] Cahill M M.Bacterial flora of fishes:a review[J].Microbial Ecology,1990,19(1):21-41.
[4] Martin-Antonio B,Manchado M,Infante C,et al.Intestinal microbiota variation in Senegalese sole(Solea senegalensis)under different feeding regimes[J].Aquaculture Research,2007,38:1213-1222.
[5] Gaggìa F,Mattarelli P,Biavati B.Probiotics and prebiotics in animal feeding for safe foods production[J].International Journal of Food Microbiology,2010,141:S15-S28.
[6] Nemcová R,Bomba A,Gancarĉíková S,et al.Effects of the administration of Lactobacilli,maltodextrins and fructooligosaccharides upon the adhesion of E.coli O8:K88 to the intestinal mucosa and organic acid levels in the gut contents of piglets[J].Veterinary Research Communications,2007,31:791-800.
[7] Chabrillón M,Arijo S,Díaz-Rosales P,et al.Interference of Listonella anguillarum with potential probiotic microorganisms isolated from farmed gilthead seabream(Sparus aurata L.)[J].Aquaculture Research,2006,37:78-86.
[8] 陈孝煊,吴志新,周文豪.鱼类消化道菌群的作用与影响因素研究进展[J].华中农业大学学报,2005,24(5):523-528.
[9] Sakata T.Microflora in the digestive tract of fish and shellfish [C]//Microbiology in Poecilotherms.Amsterdam:Elsevier,1990: 171-176.
[10] Sugita H,Okano R,Suzuki Y,et al.Antibacterial abilities of intestinal bacteria from larval and juvenile Japanese flounder against fish pathogens[J].Fisheries Science,2002,68:1004-1011.
[11] Lara-Villoslada F,de Haro O,Camuesco D,et al.Short-chain fructooligosaccharides,in spite of being fermented in the upper part of the large intestine,have anti-inflammatory activity in the TNBS model of colitis[J].European Journal of Nutrition,2006,45(7): 418-425.
[12] Swanson K S,Grieshop C M,Flickinger E A,et al.Supplemental fructooligosaccharides and mannan oligosaccharides influence immune function,ideal and total tract nutrient digestibilities,microbial populations and concentrations of protein catabolites in the large bowel of dogs[J].Journal of Nutrition,2002,132(5):980-989.
[13] 袁缨,闫际平,陈立华.不同寡糖对肉仔鸡肠道主要菌群和免疫器官指数的影响[J].中国饲料,2007,15(3):15-17.
[14] 杜英男,鞠贵春,薛军,等.果聚糖和甘露寡糖对水貂肠道菌群影响的研究[J].经济动物学报,2007,11(2):83-86.
[15] Spring P,Wenk C,Dawson K,et al.The effects of dietary mannaoligosaccharides on cecal parameters and the concentrations of enteric bacteria in the ceca of salmonella-challenged broiler chicks[J]. Poultry Science,2000,79(2):205-211.
[16] Strickling J A,Harmon D L,Dawson K A,et al.Evaluation of oligosaccharide addition to dog diets:influences on nutrient digestion and microbial populations[J].Animal Feed Science and Technology,2000,86:205-219.
[17] 张红梅.甘露寡聚糖对鲤鱼生产性能及对鱼体各项生物学指标的影响[D].保定:河北农业大学,2003.
[18] 李云兰.甘露寡糖对幼建鲤(Cyprinus carpio var.Jian)肠道菌群和免疫功能的影响[D].雅安:四川农业大学,2004.
[19] 陈营,王福强,邵占涛,等.乳酸菌对牙鲆稚鱼养殖水体和肠道菌群的影响[J].海洋水产研究,2006,27(3):37-42.
[20] 潘雷.几种微藻和益生菌在大菱鲆苗种培育过程中的应用研究[D].北京:中国农业科学院,2009.
[21] Urdaci M C,Bressollier P,Pinchuk I.Bacillus clausii probiotic strains:antimicrobial and immunomodulatory activities[J].Journal of Clinical Gastroenterology,2004,38:S86-S90.
[22] 沈锦玉,沈智华,尹文林,等.饲喂枯草芽孢杆菌对银鲫等水生动物肠道菌群及消化酶活性的影响[J].水产学报,2004,28 (12):146-150.
[23] 孟庆显.海水养殖动物病害学[M].北京:中国农业出版社, 1996:63-69.
[24] 顾天钊,陆承平.鲍氏不动杆菌——鳜鱼暴发性死亡的新病原[J].微生物学通报,1997,24(2):104-106.
[25] 王广和,于志华.文蛤弗尼斯弧菌病研究[J].微生物学通报, 1992,19(4):222-225.
[26] Dimitroglou A,Merrifield D L,Spring P,et al.Effects of mannan oligosaccharide(MOS)supplementation on growth performance, feed utilisation,intestinal histology and gut microbiota of gilthead sea bream(Sparus aurata)[J].Aquaculture,2010,300:182-188.
[27] 何明清.动物微生态学[M].北京:中国农业出版社,1994:138 -140.
[28] 王福强,呙于明,陈营,等.两种乳杆菌在牙鲆消化道的定植[J].中国农业大学学报,2005,10(1):1-5.
[29] Jöborn A,Olsson C J,Kjelleberg S.Colonization in the fish intestinal tract and production of inhibitory substances in intestinal mucus and faecal extracts by Carnobacterium sp.strain K1[J].Journal of Fish Diseases,1997,20:383-392.
[30] 蔡雪峰,罗琳,战文斌,等.壳寡糖对虹鳟幼鱼肠道菌群影响的研究[J].中国海洋大学学报,2006,36(4):606-610.
[31] Sun Y,Yang H,Ling Z,et al.Gut microbiota of fast and slow growing grouper Epinephelus coioides[J].African Journal of Microbiological Research,2009(3):713-720.
Effect of dietary fructo-and mannan oligosaccharides and Bacillus clausii on the intestinal microflora in Japanese flounder Paralichthys olivaceus
WANG Kun,SUN Yun-zhang,LI Fu-dong,YE Ji-dan
(Xiamen Key Laboratory for Feed Quality Testing and Safety Evaluation,Fisheries College,Jimei University,Xiamen 361021,China)
A feeding trial was conducted to investigate the effect of dietary fructo-and mannan oligosaccharides (FOS and MOS),and bacterium Bacillus clausii administration on intestinal microflora in healthy Japanese flounder Paralichthys olivaceus by traditional culture-based techniques and 16S rRNA gene sequencing.The juvenile Japanese flounder with body weight of(21.35 g±0.20 g)were randomly stocked into 24 cages at a rate of 20 fish per cage,and fed eight experimental diets containing different concentrations of FOS,MOS and the bacterium(0.5% FOS,group F;0.5%MOS,group M;0.25%FOS+0.25%MOS,group FM;107CFU/g B.clausii,group B; 0.5%FOS+107CFU/g B.clausii,group FB;0.5%MOS+107CFU/g B.clausii,group MB;0.25%FOS+0.25% MOS+107CFU/g B.clausii,group FMB;without supplementation,as control group)with triplication for 56 days. Total bacterial count was found to be varied from 5.92 to 7.31 log(CFU/g)in the intestine,with the maximum in fish in the control group and the minimum in the group FMB.The total bacterial number in the test groups except group B was significantly lower than that in the control group.The number of Staphylococcus epidermidis,Vibrio furnissii,Acinetobacter baumannii and Macrococcus caseolyticus was showed to be reduced in the intestine in the fish fed the test diets except in group B,whereas Macrococcus caseolyticus increased in the fish fed the test diets except FB compared to the control.A.baumannii,V.furnissii and M.caseolyticus recorded as the dominant species in the control group remained dominant bacteria in the intestine of fish in the groups fed F,M and FM,Enterococcus casseliflavus being the dominant bacteria.Distinct variations in the presence of the eleven species were observed in the groups B,FB,MB and FMB versus the control,with a reduced occurrence for Acinetobacter baumannii,while enhanced occurrence for M.caseolyticus.Both M.caseolyticus and Pseudomonas stutzeri were found to be increased in all treated groups compared to the control.It is inferred from the results that dietary FOS,MOS and B.clausii alone or in combination may improve gut health of Japanese flounder via alteration of intestinal microbiotia.
Paralichthys olivaceus;fructo oligosaccharide;mannan oligosaccharide;Bacillus clausii;microbiotia
S917
A
2095-1388(2011)04-0299-07
2010-08-29
福建省高校水产科学技术与食品安全重点实验室资助项目(2008J304);厦门市科技计划项目(3502Z20093024)
王琨(1967-),女,副研究员。E-mail:scyjs@jmu.edu.cn
叶继丹(1966-),男,研究员。E-mail:yjdwk@sina.com
