Lachnum YM 328多糖发酵条件优化及抗氧化性
2011-03-15陈吴西蔡敬民张利兵
陈吴西, 蔡敬民, 邱 涛, 张利兵, 叶 明
(1.合肥工业大学生物与食品工程学院,安徽合肥 230009;2.合肥学院生物与环境工程系,安徽合肥 230022)
0 引 言
真菌多糖是从真菌子实体、菌丝体、发酵液中分离出的,能够控制细胞分裂分化、调节细胞生长衰老的一类活性多糖[1]。大量研究表明,多糖具有免疫增强与调节、抗病毒、抗放射、抗肿瘤、抗凝血、抗衰老以及抗氧化等作用[2-5],是公认的安全低毒活性物质。
利用微生物生产多糖可以不受季节变化的影响,微生物多糖的收集与纯化相对其它多糖而言更容易[6],微生物多糖越来越受到人们的关注。粒毛盘菌属Lachnum Retz是晶杯菌科(H ya-loscyphaceae)真菌,其分布广泛,通常腐生在各种植物基质上。近十几年来,我国学者在粒毛盘菌方面做过不少研究[7-10],人们发现粒毛盘菌属中有的种能产生生物活性物质,说明粒毛盘菌具有重要的应用前景[11-13]。本文对一株粒毛盘菌YM 328发酵条件以及其胞外多糖抗氧化活性进行了研究,以期为盘菌多糖的开发和利用提供理论依据。
1 材料和方法
1.1 菌株及培养基
粒毛盘菌(Lachnum)YM 328,合肥工业大学微生物资源与应用研究室分离保藏菌种。
发酵培养基:液体PDA培养基。
1.2 YM 328胞外多糖的发酵、提取和测定
摇瓶培养条件为温度25℃,转速180 r/min,装液量50 m L(容积为150 m L的三角瓶),在此条件下培养10 d。
提取方法:将50m L发酵液过滤,滤液浓缩,加3倍体积的无水乙醇,4℃下醇沉。离心除去上清液,沉淀用蒸馏水溶解并定容至50 m L,加1m L 30%的H 2O2,50℃保温脱色,Sevage法脱蛋白[14],得到胞外多糖溶液。
采用苯酚-硫酸法测定多糖质量浓度[15],以葡萄糖为标准物,用721E型可见光光度计作比色分析。
1.3 YM 328胞外多糖发酵条件
1.3.1 碳、氮源对菌株YM 328多糖发酵的影响
分别用20 g/LCMC-Na、蔗糖、淀粉、麦芽糖代替基础发酵培养基中的葡萄糖配制不同碳源培养基各50 m L,装入150 m L的锥形瓶中,用打孔器接入直径为3mm的菌块,25℃、150 r/m in摇床培养10 d,测定多糖质量浓度。分别以5 g/L蛋白胨、NH4NO3、(NH4)2SO4、尿素、酵母膏为氮源[16],并选择最适碳源配制发酵培养基,方法同上。
1.3.2 金属离子对YM 328多糖发酵的影响
选择最适碳氮源配制发酵培养基,分别添加0.01 g/L硫酸锰、硫酸亚铁、硫酸锌、硫酸铜和硫酸镁,以不加金属离子的发酵液为对照。调节pH值为最适,接种菌龄相同菌块装于50m L不同生长因子发酵培养基的 150 m L锥形瓶中,25℃、150 r/m in摇床培养 10 d,测定多糖质量浓度。
1.3.3 时间对YM 328多糖发酵的影响
选择最适碳氮源和最佳生长因子配制发酵培养基,并调节最适pH值,接入直径3 mm的菌块,25℃、150 r/m in摇床培养6、8、10、12、14 d,测定多糖质量浓度。
1.3.4 正交试验
在单因素试验基础上,以碳源、氮源、金属离子为3因素,各取4个水平,选择L16(45)正交表进行试验。
1.4 YM 328胞外多糖抗氧化活性测定
1.4.1 胞外多糖对◦OH的清除作用
按照Sm irnoff的方法(有改动),利用H2 O2与Fe2+混合产生◦OH,在体系内加入水杨酸捕捉◦OH并产生有色物质,该物质在510 nm下有最大吸收。反应体系中含 8.8 mmo l/L H2O2、9mmol/L FeSO4、9mmol/L水杨酸/乙醇、不同质量浓度(10、20、30、40、50、60 mg/L)的多糖溶液各1 m L,最后加H2O2启动反应,37℃反应0.5 h,以蒸馏水为参比,在510 nm下测量不同质量浓度下的吸光度。考虑到多糖本身的吸光值、以9 mm ol/L FeSO4、9 mmol/L水杨酸/乙醇、不同质量浓度的多糖溶液和蒸馏水各1m L做为多糖的本底吸收值[17]。
清除率计算公式为:
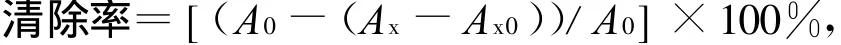
其中,A0为空白对照液的吸光度;A x为加入多糖溶液后的吸光度;A x0为不加显色剂H2 O2多糖溶液本底的吸光度。
[18]的方法进行。取3m L不同质量浓度(0.2、0.4、0.6、0.8、1.0 g/L)多糖溶液,2m L PBS溶液(pH值为 6.0)和 0.1 m L 200μg/m L NaNO2溶液于试管中,用水添加至10 m L后,将混合液置于37℃恒温1 h。然后与等容积的G riess试剂(1%对氨基苯磺酸、0.1% N-1-萘基乙二胺、2.5%H3PO4)混合,静置10 m in后,蒸馏水做参比,于538 nm处测其吸光度,同时测定对照样(不含亚硝酸钠,含有多糖)和空白样(不含多糖,蒸馏水代替多糖)吸光度。VC作为样品对照。亚硝酸钠的清除活性公式为:
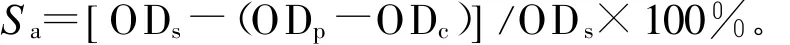
其中,S a为亚硝酸钠的清除率;ODs为空白样品的OD值;ODp为试验的OD值;ODc为对照的OD值。
2 结果和分析
2.1 碳、氮源对YM 328胞外多糖发酵的影响
当以5 g/L蛋白胨为氮源,20 g/L麦芽糖、蔗糖、可溶性淀粉、葡萄糖和CMC-Na为碳源时,YM 328胞外多糖产量如图1a所示。从图1a可看出,以葡萄糖为碳源时,YM 328胞外多糖产量最高,说明以葡萄糖为碳源便于菌株YM 328的利用和多糖的积累。氮源对菌株YM 328胞外多糖产量的影响较大。当以葡萄糖为碳源,酵母膏为氮源时,YM 328胞外多糖的产量最高,达到1.841mg/m L,如图1b所示。
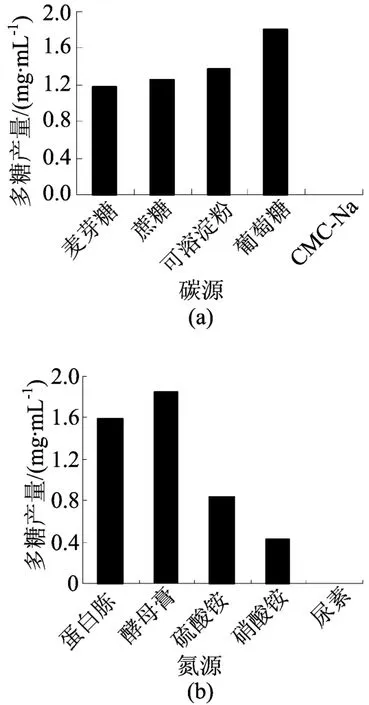
图1 碳氮源对YM 328胞外多糖产量的影响
2.2 金属离子对YM 328胞外多糖发酵的影响
金属离子对菌株YM 328胞外多糖发酵的影响如图2所示。由图2可知,除Cu2+外,添加Mg2+、Fe2+、Zn2+、M n2+对YM 328胞外多糖的产量都有很大的影响,由此可以推测金属离子对于多糖的合成起重要作用,具体机理尚待研究。
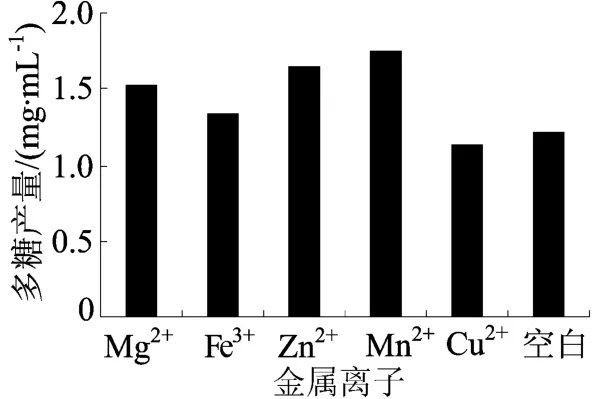
图2 金属离子对胞外多糖产量的影响
2.3 培养时间对YM 328胞外多糖发酵的影响
培养时间对YM 328胞外多糖发酵的影响如图3所示。由图3可知,YM 328胞外多糖发酵到10 d时,其产量达到1.548 mg/m L,随着发酵时间的延长,多糖产量较稳定,直到14 d后多糖产量有所下降。
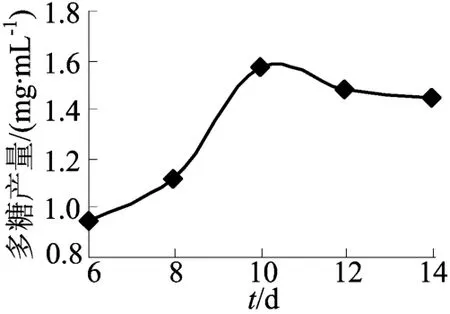
图3 培养时间对胞外多糖产量的影响
2.4 正交试验
YM 328胞外多糖发酵的正交试验极差分析结果见表1所列。
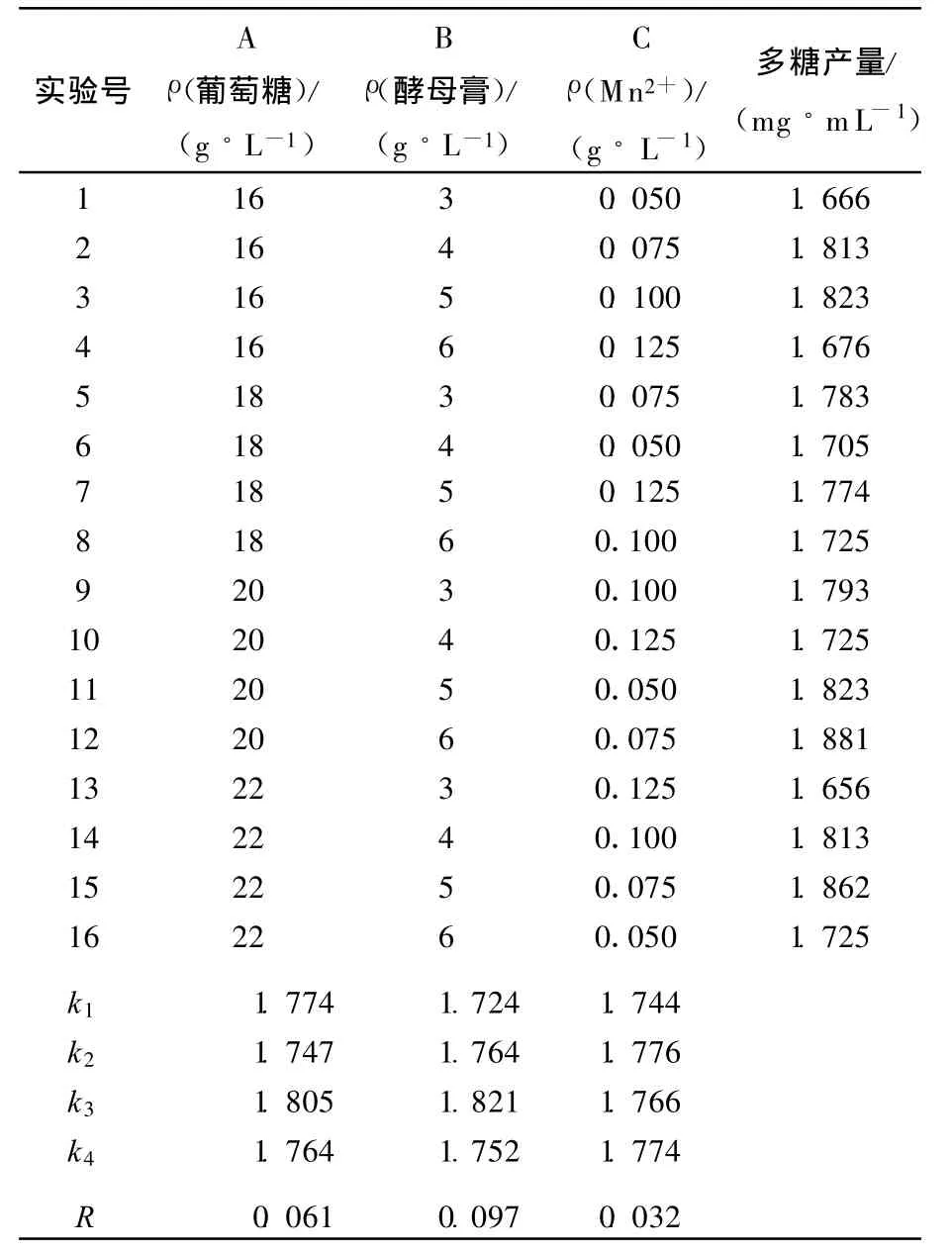
表1 YM 328胞外多糖发酵正交试验结果
由表1可知,影响YM 328胞外多糖产量的因素依次是C(金属离子)>B(氮源)>A(碳源)。由试验结果可直接得其最佳组合为A3B3C2,最佳发酵条件为:ρ(葡萄糖)=20 g/L,ρ(酵母膏)= 5 g/L,ρ(硫酸锰)=0.075 g/L。这与直观分析所得试验多糖产量最大有差异,故进行验证试验。在此条件下进行验证试验得出胞外多糖最大产量为1.895m g/m L。
2.3.1.2 术后6周后Harris髋关节功能评分 纳入了4个研究,共179例(SuperPATH组89例,传统入路组90例),经χ2检验,研究间有异质性 ( I2>50%),采用随机效应模型进行统一Meta 分析。结果显示:SuperPATH组术后6周后Harris髋关节功能评分优于传统入路组,且差异有统计学意义(WMD=7.62,95%CI=2.09~13.16,P=0.007)。见图2。
方差分析见表2所列。由表2可以看出,A因素对该多糖的产率没有显著影响,B因素对该多糖的产率具有显著影响,C因素对其产量具有高度显著影响。
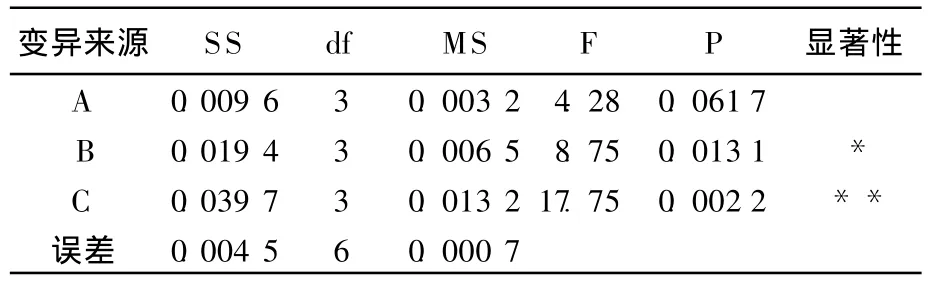
表2 方差分析
2.5 YM 328胞外多糖对◦OH的清除作用
YM 328胞外多糖对◦OH的清除如图4所示,由图4可知,YM 328多糖对◦OH有清除作用,而且随着质量浓度的增加,对◦OH的清除作用增强,且清除能力均高于等质量浓度的VC。
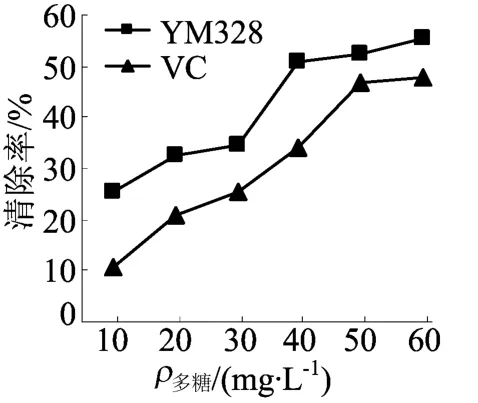
图4 YM 328胞外多糖对◦OH的清除作用
2.6 YM 328胞外多糖对亚硝基的清除作用
YM 328胞外多糖对亚硝基的清除如图5所示,由图 5可知,随着多糖质量浓度的增加,YM 328胞外多糖对亚硝基的清除作用逐渐增强,但清除能力均弱于等质量浓度的VC。当质量浓度为1 g/L时,两者对亚硝基的清除能力差异较大,分别为51.07%和65.32%。
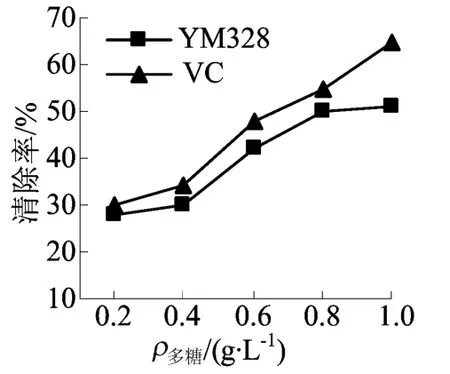
图5 YM 328胞外多糖对亚硝基的清除作用
3 结束语
本研究表明,碳源、氮源、金属离子及培养时间对 YM 328胞外多糖产量都有不同程度的影响。在最佳发酵条件下,多糖产量比在基础发酵培养条件下培养10 d的产量提高了36.27%,说明发酵条件对YM 328多糖代谢具有重要的调控作用。
YM 328胞外多糖对◦OH和亚硝基离子的清除作用随着多糖质量浓度的增加,呈增强的趋势。◦OH是生物体内主要的活性自由基,由它引发的体内脂质过氧化是机体衰老、心血管病及肿瘤发生的重要原因[19]。文献[20]报道大球盖菇多糖(质量浓度为583.1 mg/L)对◦OH的清除率为50%,而在本研究中40 mg/L的YM 328胞外多糖对◦OH的清除率就已达到50.98%,这说明粒毛盘菌胞外多糖对◦OH的清除作用较强,是一种很有开发潜力的抗氧化、防衰老的活性物质。
[参 考 文 献]
[1] Brauer D,K immons T,PhilipsM.Comparision of tw omethods for the quantitation of B-glucans from shiitake mushroom s[J].H erbs Spices Medicinal Plants,2007,13(3): 15-26.
[2] 欧阳学农,余宗阳,王文武,等.香菇多糖抗炎作用的实验研究[J].军医进修学院学报,2006,27(1):56-57.
[3] 侯 元,霍德胜,魏艳君,等.草苁蓉多糖的抗肿瘤作用及免疫调节作用[J].吉林大学学报:医学版,2007,33(2): 1022-1025.
[4] 聂少平,谢明勇,曹树稳.纯化茶多糖的抗氧化活性及其对两种结肠癌细胞增殖抑制作用[J].营养学报,2007,29(1): 46-50.
[5] Lin C L,Wang CC,Chang SC,et al.Antioxidative activity of polysaccharide fractions isolated from Ly cium ba rbarum Linnaeus[J].International Jou rnal of Biological Macromolecules,2009,45(2):146-151.
[6] Selbmann L,Onofri S,Fenice M.Production and structural characterization of the exopolysaccharide of the Antarctic fungus Phoma herbarum CCFEE 5080[J].Research in M icrobiology,2002,153(9):585-592.
[7] ZhuangW Y,Wang Z.Some new speciesand new recordsof Discomycetes in China:Ⅷ[J].M ycotaxon,1998a,66: 429-438.
[8] Zhuang W Y,Wang Z.Discomy cetes of tropical ChinaⅠ: collections from H ainan island[J].M ycotaxon,1998b,57: 21-23.
[9] Zhuang W Y,Wang Z.Discomycetes of tropical ChinaⅡ: collections from Yunnan[J].M ycotaxon,1998c,69: 339-358.
[10] Zhuang W Y,H yde K D.New species of Lachnum and Perrotia from Hong Kong[J].M ycologia,2001,93(3): 606-611.
[11] Stadler M,Anke H,A rendhdz W R,et al.Lachnumon and Lachnumo l A,new metabolitesw ith nematicidal and antim icrobial activities from the ascomycete Lachnum pa pyraceum(Karst)KarstⅠ:producing organism,fermentation,isolation,and biological activities[J].The Jou rnal of Antibiotics,1993,46(6):961-967.
[12] Stadler M,Anke H,Show R,et al.New m etabolites with nematicidal and an tim icrobial activities from the ascomycete Lachnum papyraceum(Karst)Ⅵ:structure determ ination of non-halogenated metabolites structu rally related tomycorrhizin A[J].The Journal of Antibiotics,1995,48 (2):154-157.
[13] Stadler M,Anke H,Sterner O.Metabolites w ith nematicidal and Antim icrobial activities from the ascomy cete Lachnum pap yraceum(Karst)KarstⅤ:production is olation and biologicalactivitiesof brom ine-containingmycorrhizin and lachnumon derivatives and four additional new bioactivemetabolites[J].The Journalof Antibiotics, 1995,48(2):149-153.
[14] Qin C G,Huang K X,Xu H B.Isolation and characterization of the loach,M isgu rnus Anguillicaudatus[J].Carbohydrate Polym ers,2002,49(3):367-371.
[15] Vinarta S C,MolinaO E,Figueroa LC,et al.A further insigh t into the practical applications of exopolysaccharides from Sclerotium rol fsii[J].Food H ydrocolloid s,2006,20(5):619-629.
[16] 李宜明,沈业寿,季俊虬,等.桑黄菌质多糖的固态发酵及其抗氧化作用[J].合肥工业大学学报:自然科学版,2006,29(12):1580-1583.
[17] Sm irnoff N,CumbesQ J.Hyo rxy l radicalscavenging activity of compatible solutes[J].Phy tochem istry,1989,28(4):1057-1060.
[18] 焦中高,刘杰超,周红平,等.硫酸化修饰对红枣多糖自由基和亚硝基清除活性的影响[J].中国食品学报,2007,7(2):17-21.
[19] 王 峰,王晓炜,陶明煊,等.大球盖菇多糖清除自由基活性和对D-半乳糖氧化损伤小鼠的抗氧化作用[J].食品科学,2009,30(5):233-238.
[20] 钟颜麟,彭志英,赵谋明.乳酸菌胞外多糖的研究[J].中国乳品工业,1999,27(4):7-10.
