HPLC法同步检测鲤鱼、对虾中喹乙醇与MQCA残留
2011-03-14梅景良吴聪明程林丽沈建忠钱民怡邵梦瑜
梅景良,吴聪明,程林丽,沈建忠,薛 麒,钱民怡,邵梦瑜
(1.中国农业大学 动物医学院,北京 100193; 2.福建农林大学 动物科学学院,福建 福州350002)
喹乙醇(Olaquindox,OLA)是一种化学合成的广谱抗菌药,对革兰氏阴性菌和革兰氏阳性菌均具有一定的抑制作用,同时对动物具有显著的促生长作用[1-2]。因此自20世纪70年代起,欧共体、澳大利亚、日本和中国等陆续批准该药作为饲料添加剂使用,在畜禽和水产养殖中曾得到广泛应用[3]。但后来逐渐发现,喹乙醇具有光敏毒性[4]、致突变和致癌作用[5-8],是一种潜在的基因毒剂[9-11]。基于此,欧盟认为喹乙醇的休药期不能确定,并对人体健康可能存在不良影响,因此,于 1999年禁止在食品动物生产中使用该药作促生长添加剂[8,12]。我国于 2000年规定喹乙醇禁用于禽类和体重超过35 kg的猪,在2005年又规定禁用于鱼类。尽管如此,喹乙醇在我国仍然作为抗菌促生长添加剂被广泛使用[8]。
由于喹乙醇具有较大危害性,对其进行残留监控是十分必要的。但喹乙醇本身不稳定,在动物体内能够于短时间内被代谢,其代谢产物有十多种,其中 3-甲基-喹噁啉-2-羧酸(methyl-3-quinoxaline-2-carboxylic acid,MQCA)是主要代谢物,在体内相对稳定,现已成为国际公认的喹乙醇在可食性动物组织中的残留标示物[13]。国内外已有较多关于喹乙醇及其代谢物MQCA的残留检测方法,如高效液相色谱(HPLC)法、色谱-质谱联用(LC-MS/MS)、免疫分析法等[14-18]。这些检测方法有的是针对喹乙醇的原药残留的测定,其结果不能体现喹乙醇在动物体内的真实残留情况,而有的方法虽然是针对 MQCA的检测,但未测定原药的残留量,而且其前处理过程太繁琐,耗时较长,显然不利于实际样品的大规模检测[19-21]。更主要的是,由于MQCA既是喹乙醇在动物源食品中的残留标示物,同时也是喹烯酮等其他喹啉类药物的残留标示物[22-23],因此若单纯以 MQCA为残留分析物,即使检测到阳性样品,也只能说明阳性样品曾用过喹啉类药物,并不能知道用的是这一类药物中的哪一具体品种。但对水产养殖动物而言,喹乙醇是禁用药,其他喹啉类药物为非禁用药,也就是说,如果想知道这些阳性样品是否是因使用喹乙醇而导致的 MQCA残留,就必须再进行一次喹乙醇的残留检测才能确定。本项目的研究旨在建立一种能同时检测鱼、虾中喹乙醇及其代谢物MQCA残留的HPLC方法,以利于基层质检机构更有效、更快捷地检测喹乙醇及其代谢物的残留。
1 材料与方法
1.1 仪器与试验材料
Waters2695高效液相色谱仪,配二极管阵列检测器(美国Waters公司); 离心机; Bond Elut C18固相萃取柱,500 mg,6 mL(美国Varian公司); 组织匀浆机;氮吹仪; 涡旋混合器; 微孔滤膜,0.22 μm。
甲醇、乙腈、甲酸均为色谱纯; 其他试剂均为国产分析纯; 水为超纯水。
OLA 标准储备液(100 mg/L):准确称取(10±0.01)mg的喹乙醇标准品(纯度98.4%,中国兽医药品监察所),用甲醇溶解并转移到棕色容量瓶中定容至100 mL。
MQCA 标准储备液(100 mg/L):准确称取(10±0.01) mg 的 3-甲基-喹啉-2-羧酸标准品(纯度94%,德国Dr.Ehrenstorfer公司),用甲醇溶解并转移到棕色容量瓶中定容至100 mL。
标准工作液:根据使用需要,用甲醇将标准储备液稀释成不同浓度的标准工作液,在4℃冰箱中保存,可使用2周。
复溶液:水-0.5%甲酸水-乙腈-甲醇混合溶液(30:40:5:25,V/V)。
供试验所用的活鲤鱼及活对虾均购自北京某超市,将其可食用部分绞碎匀浆,于-20℃冰箱中贮存备用。
1.2 试验方法
1.2.1 样品处理
将组织样品从低温冰箱中取出,室温解冻。取2.5 g组织至50 mL的离心管中,加入7 mL 0.3 mol/L和1 mL 1mol/L 的HCl溶液,涡旋振荡提取2 min,3 900 r/min离心10 min,将上清液转至15 mL尖底塑料离心管中。残渣加入6 mL 0.3 mol/L HCl溶液再提取1次,将上清液合并至尖底塑料离心管中。上清液以3 900 r/min离心10 min,于冰箱冷藏静置1 h,最后用C18固相萃取柱净化。依次用5 mL甲醇和3 mL 0.3 mol/L HCl活化小柱,2 mL超纯水淋洗,再依次用3 mL甲醇和1 mL乙腈洗脱至玻璃试管中,于35℃氮气吹干。最后各组织残渣用0.5 mL复溶液涡旋振荡溶解1 min,并于3 900 r/min离心15 min,用0.22 µm滤膜过滤,滤液进行HPLC分析。
1.2.2 HPLC色谱条件
色谱柱:Inertsil® ODS-3 C18 柱(250 mm×4.6 mm,5 μm),日本 GL Sciences公司产品; 柱温 30℃; 进样量 100 μL; 样品运行时间为 20 min; 双波长检测,OLA的检测波长为 372 nm,MQCA的检测波长为320 nm; 流动相由纯水、乙腈、甲醇和0.5%甲酸水组成,梯度洗脱,具体设定条件见表 1。采用外标法定量。

表1 测定OLA与MQCA的流动相梯度洗脱条件Tab.1 Gradient elution for OLA and MQCA analysis
1.2.3 标准曲线的制备
标准贮备液用复溶液稀释配制成各含 OLA和MQCA 为 0.02、0.05、0.1、0.2、0.5 和 1 μg/mL 的系列混合标准溶液,取100 μL按1.2.2项下的 HPLC色谱条件进样分析。分别以OLA和MQCA的峰面积为纵坐标(Y),OLA和MQCA的质量浓度为横坐标(X)绘制标准曲线,并求回归方程和相关系数。
1.2.4 检测限与定量限的确定
称取6个空白组织样品,按1.2.1项下的样品处理方法进行提取和净化,同时设 0.02 μg/mL标准工作液作对照,对空白组织样品和标准工作液进行HPLC分析。计算OLA和MQCA色谱保留时间位置的信噪比,以空白样品的 3倍信噪比(S/N=3)计算检测限(limits of detection,LOD),以 10倍信噪比(S/N=10)计算定量限(limits of quantification,LOQ)。
1.2.5 回收率与精密度的测定
取2.5 g(精确至0.01g)空白鲤鱼、对虾组织样品,鲤鱼组织样品OLA以20、80、200 μg/kg,MQCA以35、100、200 μg/kg; 对虾组织样品 OLA 以 15、80、200 μg/kg,MQCA 以 30、100、200 μg/kg 各 3 个浓度,分别进行添加回收试验,按 1.2.1项下方法处理,在1.2.2项条件下进行 HPLC测定,将峰面积乘以样品处理中的稀释倍数,与相应浓度的 3个随行标准工作液峰面积平均值比较,计算回收率。每个浓度设5个平行,连续做 3 d,计算日内和日间变异系数即批内和批间相对标准偏差。
2 结果
2.1 方法的线性范围及检测限
在本试验所建立的色谱条件下,OLA和MQCA标准工作液在0.02~1.00 μg/mL浓度范围内,峰面积(Y)与浓度(X)呈良好的线性关系,其线性回归方程分别为:Y=266652X-523.88,R=0.9999;Y=181144X-25.76,R=0.9999。
根据 6个空白组织样品基线噪音值的平均值,按信噪比S/N=3计算LOD,信噪比S/N=10计算LOQ,求的鲤鱼肌肉组织中OLA和MQCA的LOD分别为6 和 10 μg/kg,LOQ 分别为 20 和 35 μg/kg; 对虾组织中OLA和MQCA的LOD分别为4.5和8 μg/kg,LOQ分别为 15和 30 μg/kg。
2.2 药物的色谱行为
在 1.2.2项色谱条件下测定,色谱峰对称性好,药物峰与溶剂峰及基质干扰峰分离较好,可准确测定其峰面积(见图1~图4)。且该条件下药物保留时间的重现性好,以虾某浓度添加水平为例,OLA及MQCA 的保留时间分别为(4.464±0.009)min和(12.657±0.028)min,变异系数分别仅为 0.20%和0.22%(n=15)。
2.3 回收率和精密度
在空白鲤鱼肌肉组织和对虾组织中分别添加低、中、高3个不同浓度水平OLA和MQCA的标准溶液,按所述方法进行测定,并计算出各加标样品的回收率,见表 2、表 3。鲤鱼肌肉组织中 OLA3个不同添加浓度的平均回收率为 83.5%~87.7%,MQCA 的平均回收率为 79.6%~87.4%; 对虾肌肉组织中 OLA3个不同添加浓度的平均回收率为74.6%~80.9%,MQCA的平均回收率为81.0%~86.6%,均符合兽药残留分析的准确度要求。批内相对标准偏差为 0.51%~4.47%,小于 5%; 批间相对标准偏差为0.66%~7.58%,小于10%,皆符合兽药残留分析的精确度要求。

图1 鲤鱼鱼肌肉组织中OLA的HPLC色谱图Fig.1 Liquid chromatograms of OLA in carp muscle tissues
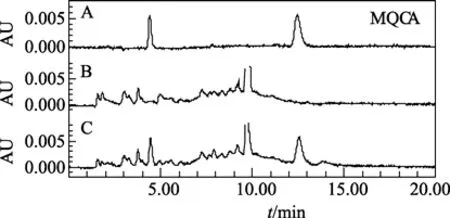
图2 鲤鱼肌肉组织中MQCA的HPLC色谱图Fig.2 Liquid chromatograms of MQCA in carp muscle tissues
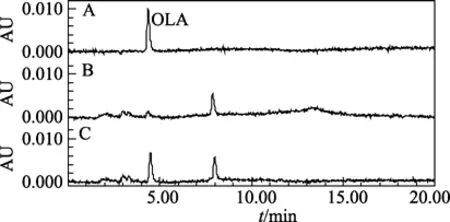
图3 对虾肌肉组织中OLA的HPLC色谱图Fig.3 Liquid chromatograms of OLA in shrimp muscle tissues
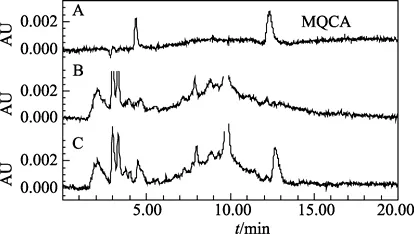
图4 对虾肌肉组织中MQCA的HPLC色谱图Fig.4 Liquid chromatograms of MQCA in shrimp muscle tissues
3 讨论
3.1 提取与净化条件的选择
目前在OLA或MQCA残留色谱法检测的样品制备中,残留物的提取主要是采用水提取[24-27],偏磷酸甲醇溶液、乙酸乙酯及磷酸盐缓冲液依次提取[21,28-29],氢氧化钠溶液水解、乙酸乙酯重复提取[22-23,30],蛋白酶酶解、盐酸溶液或乙酸乙酯提取[19-20,31],以及用乙腈和乙酸乙酯提取[32]。在本研究中比较了盐酸溶液、氢氧化钠溶液、乙酸乙酯等有机溶剂提取,以及这些提取液的不同组合提取,并比较了提取液的用量、用时、温度、次数和pH值。结果表明,仅采用 0.3 mol/L盐酸溶液水解即可将OLA及MQCA从鲤鱼组织或对虾组织中同时分离提取出来,且与同等试验条件下氢氧化钠溶液水解相比,盐酸水解可减少提取液中的杂质成分,提高后续的净化效果和方法回收率。本文经过对比研究之后尚发现,若再适当增加提取液的酸性还可提高MQCA的提取效果,因此在初次提取液 7 mL 0.3 mol/L中增加使用了1 mL 1 mol/L盐酸。

表2 鲤鱼肌肉组织中OLA及MQCA的提取回收率与相对标准偏差Tab.2 Recoveries and RSDs of OLA / MQCA in carp muscle tissues
在OLA及MQCA残留检测的样品制备过程中,提取液内残留物的纯化技术基本上是采用固相萃取法,并以使用MAX小柱[20-21,28-29]和SCX小柱[19]为主,但也有的是直接利用液液萃取进行净化的[22-23,30]。本研究采用的是固相萃取法,并对MAX、MCX、HLB、C18、中性氧化铝柱等几种小柱的净化效果进行了比较,结果发现 C18小柱可同时较好地保留 OLA和M Q C A。研究中尚对淋洗液和洗脱液的种类及用量进行了大量的筛选和优化,结果表明用2 mL超纯水淋洗、3 mL甲醇和1 mL乙腈依次洗脱即可达到较好的净化效果和较高的方法回收率。至于在净化过程中是否需要采用正己烷进行脱脂这一步骤,可视情况而定,以尽量避免不必要的回收率损失。如虾肌肉组织的含脂量极低,对检测基本不存在干扰现象,可不必进行脱脂; 而鱼肌肉组织存在一定的含脂量,但其高低与鱼的种类和不同季节有很大的关系,在实际工作中若发现含脂量较大而干扰正常检测时,就必须采用适量的正己烷进行脱脂,一般可在氮吹残渣复溶后用2 mL正己烷脱脂即可获得满意的效果。

表3 对虾肌肉组织中OLA及MQCA的提取回收率与相对标准偏差Tab.3 Recoveries and RSDs of OLA / MQCA in shrimp muscle tissues
3.2 色谱条件的选择
由于在OLA及MQCA的HPLC法残留分析中,使用的色谱柱基本上是 C18柱[19-21,28-32],本研究便直接采用色谱性能较好的Inertsil ODS-3 C18柱作为HPLC柱。不过,在不同的研究中所使用的流动相却存在着很大的差别[19-21,28-30]。经过对比发现,这些流动相也基本上都是由水相和有机相混合而成,水相一般是纯水或低浓度甲酸水,有机相是甲醇、乙腈或二者都有,采用等度或梯度洗脱。因此,在选定色谱柱之后,本研究对以水、甲酸水、甲醇及乙腈组成的不同组合流动相进行了比较,结果表明以 0.1%甲酸水-甲醇-乙腈为流动相时分离效果较好,但 MQCA的峰型较宽,拖尾现象严重。又对流动相继续进行了优化,最后发现当采用1.2.2项下的流动相进行梯度洗脱时,OLA及MQCA的保留时间和峰型均非常理想,且与干扰峰之间能获得很好的分离结果。
OLA和MQCA在近紫外光区有较强的特征吸收峰,但是二者的最大吸收波长不同。为了使OLA和MQCA均能获得较高的灵敏度,本研究通过DAD全波段扫描(200~400 nm),考察了不同检测波长对OLA、MQCA测定灵敏度的影响,结果表明,当OLA以372 nm,MQCA以320 nm为检测波长时,检测的灵敏度均较高,并且在空白样品添加测定中能排除其他物质峰的干扰,因而将其作为鲤鱼、对虾组织中OLA和MQCA同步测定的最佳检测波长。在选定的色谱条件下对鲤鱼、对虾两种组织中添加的OLA和MQCA进行同步测定,获得了较为理想的研究结果。
4 结论
采用高效液相色谱法同时检测鲤鱼、对虾肌肉组织中喹乙醇及其代谢物MQCA残留,通过稀盐酸提取,优化流动相的配比,可有效分离干扰峰和喹乙醇及其代谢物的色谱峰。本方法可操作性强、重复性好,将有助于基层质检机构更有效、更快捷地检测喹乙醇及其代谢物的残留,以避免含喹乙醇残留的同类水产品在国内市场流通和进入国际市场。
[1]Williams B J,Shively J E.In vitro antitreponemal activities of carbadox,virginiamycin,olaquindox,and tylosin as indices of their effectiveness for preventing swine dysentery[J].Veterinary Medicine and Small Animal Clinician,1978,73:349-354.
[2]Barber R S,Braude R,Hosking Z D,et al.Olaquindox as performance-promoting feed additive for growing pigs[J].Animal Feed Science and Technology,1979,4(2):117-123.
[3]孙雷,韩嘉媛,汪霞,等.喹乙醇的毒理学研究概况[J].中国兽药杂志,2008,42(1):41-44.
[4]De Vries H,Bojarski J,Donker A A,et al.Photochemical reactions of quindoxin,olaquindox,carbadox and cyadox with protein,indicating photoallergic properties[J].Toxicology,1990,63(1):85-95.
[5]Yoshimura H,Nakamura M,Koeda T,et al.Mutagenicities of carbadox and olaquindox—Growth promoters for pigs[J].Mutation Research/Genetic Toxicology,1981,90(1):49-55.
[6]WHO.Evaluation of certain veterinary drug residues in food[S].WHO Technical Report Series 799,Geneva,1990.45-50.
[7]WHO.Toxicological evaluation of certain veterinary drug residues in food[S].WHO Food Additive Series 27,Geneva,1991.141-173.
[8]Hao L H,Chen Q,Xiao X L.Molecular mechanism of mutagenesis induced by olaquindox using a shuttle vector pSP189/mammalian cell system[J].Mutation Research,2006,599:21-25.
[9]Nunoshiba T,Nishioka H.Genotoxicity of quinoxaline 1,4-dioxide derivatives inEscherichia coliandSalmonella typhimurium[J].Mutation Research/DNA Repair,1989,217(3):203-209.
[10]WHO.Toxicological evaluation of certain veterinary drug residues in food[S].WHO Food Additive Series 27,Geneva,1991.175-210.
[11]Zou J J,Chen Q,Tang S S,et al.Olaquindox-induced genotoxicity and oxidative DNA damage in human hepatoma G2 (HepG2) cells[J].Mutation Research/Genetic Toxicology and Environmental Mutagenesis,2009,676(1-2):27-33.
[12]Commission Regulation (EC) No.2788/98.On measures to monitor certain substances and residues thereof in live animals and animal products and repealing[S].Official Journal of the European Communities,1998,L347(31-32):12-23.
[13]FAO/WHO,Joint Expert Committee on Food Additives.Evaluation of Certain Veterinary Drug Residues in Food,Technical Series,1995,851:19.
[14]张昱,冀宝庆,胥传来.动物源食品中喹嗯啉及其代谢物的分析方法研究进展[J].食品科学,2008,29(9):668-671.
[15]Toldrá F,Reig M.Methods for rapid detection of chemical and veterinary drug residues in animal foods[J].Trends in Food Science & Technology,2006,17:482-489.
[16]Blasco C,Torres C M,Picó Y.Progress in analysis of residual antibacterials in food[J].Trends in Analytical Chemistry,2007,26(9):895-913.
[17]De Brabander H F,Noppe H,Verheyden K,et al.Residue analysis:Future trends from a historical perspective[J].Journal of Chromatography A,2009,1216:7964-7976.
[18]Chen W,Jiang Y,Ji B Q,et al.Automated and ultrasensitive detection of methyl-3-quinoxaline-2-carboxylic acid by using gold nanoparticles probes SIA-rt-PCR[J].Biosensors and Bioelectronics,2009,24:2858-2863.
[19]Hutchinson M J,Young P B,Kennedy D G.Confirmation of carbadox and olaquindox metabolites in porcine liver using liquid chromatography-electrospray,tandem mass spectrometry[J].Journal of Chromatography B,2005,816:15-20.
[20]Boison J O,Lee S C,Gedir R G.A determinative and confirmatory method for residues of the metabolites of carbadox and olaquindox in porcine tissues[J].Analytica Chimica Acta,2009,637:128-134.
[21]Yang B,Huang L L,Wang Y L,et al.Residue depletion and tissue-plasma correlation of methyl-3-quinoxaline-2-carboxylic acid after dietary administration of olaquindox in pigs[J].J Agric Food Chem,2010,58(2):937-942.
[22]张丽芳,薛飞群,刘元元,等.高效液相色谱-串联质谱法测定鸡组织中的喹烯酮标示残留物[J].分析测试学报,2006,25(5):63-65.
[23]董义春,张丽芳,张可煜,等.高效液相色谱-串联质谱法检测猪、鸡可食性组织中喹啉类兽药残留标示物[J].中国兽医学报,2010,10:110-114.
[24]Kinsella B,O’Mahonya J,Malone E,et al.Current trends in sample preparation for growth promoter and veterinary drug residue analysis[J].Journal of Chro-matography A,2009,1216:7977-8015.
[25]艾晓辉,刘长征,文华.鱼组织中喳乙醇残留量高效液相色谱检测方法研究[J].湖北农学院学,2003,23(4):266-270.
[26]于慧娟,毕士川,黄冬梅,等.高效液相色谱法测定水产品中喹乙醇的残留量[J].分析科学学报,2004,20(3):281-283.
[27]曾静,朱宽正,王鹏,等.高效液相色谱-串联质谱法测定水产品中的喹乙醇[J].中国食品卫生杂志,2006,18(5):423-425.
[28]吴玉杰,陈冬梅,陶燕飞,等.高效液相色谱法测定动物组织中3-甲基喹喔啉-2-羧酸残留量[J].分析科学学报,2009,25(4):427-430.
[29]Wu Y J,Yu H,Wang Y L,et al.Development of a high-performance liquid chromatography method for the simultaneous quantification of quinoxaline-2-carboxylic acid and methyl-3-quinoxaline-2-carboxylic acid in animal tissues[J].Journal of Chromatography A,2007,1146:1-7.
[30]王霄旸,张丽芳,薛飞群,等.采用高效液相色谱-串联质谱法检测鲫鱼组织 3-甲基喹啉-2-羧酸残留量[J].中国兽医科学,2007,37(8):718-720.
[31]欧阳姗,庞国芳,谢丽琪,等.动物组织中卡巴氧和喹乙醇以及相关代谢产物的液相色谱-串联质谱检测方法[J].分析测试学报,2008,27(6):590-594.
[32]殷居易,倪梅林,寿成杰,等.鸡肉中喹乙醇、卡巴多及其代谢物的残留检测[J].中国兽药杂志,2006,40(1):11-15.
