鼠双微粒体2蛋白、P53在口腔白斑和鳞癌中的表达及其相关性的研究
2011-03-07韩帮锋吴平凡潘剑李一李龙江
韩帮锋 吴平凡 潘剑 李一 李龙江
(口腔疾病研究国家重点实验室,四川大学,成都 610041)
鼠双微粒体2蛋白、P53在口腔白斑和鳞癌中的表达及其相关性的研究
韩帮锋 吴平凡 潘剑 李一 李龙江
(口腔疾病研究国家重点实验室,四川大学,成都 610041)
目的 研究鼠双微粒体2(MDM2)和P53在口腔白斑及鳞癌中的表达及其相关性。方法 采用免疫组织化学SP方法对15例正常口腔黏膜组织、24例口腔白斑(OLK)组织及41例口腔鳞癌组织中的MDM2蛋白和P53蛋白进行检测。结果 正常黏膜中未见MDM2和P53阳性表达,口腔白斑和口腔鳞癌组织中MDM2阳性率分别为58.3%和75.6%,P53的阳性率分别为37.5%和68.3%,与正常组相比均具有显著性差异(P<0.05)。口腔白斑和口腔鳞癌组相比,MDM2阳性率没有显著性差异(P>0.05),P53阳性率具有显著性差异(P<0.05)。两种指标进一步的相关性分析显示,MDM2与P53蛋白在口腔白斑组(P=0.018)及口腔鳞癌组(P=0.000)中均呈现正相关的关系。结论 MDM2在口腔白斑和口腔鳞癌中的高表达提示该基因在口腔鳞癌的发生发展中起显著作用,其与P53表达的相关性表明这二者可能在口腔鳞癌的形成过程中起协同作用。
鼠双微粒体2; P53蛋白; 口腔白斑; 口腔鳞状细胞癌
口腔白斑(oral leukoplakia,OLK)是口腔黏膜的常见癌前病变,约有3%~5%的白斑会转变为口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)。鼠双微粒体2(murine double minute 2,MDM2)具有癌基因的功能,它可以和P53结合并抑制P53的功能,36%的肉瘤存在MDM2的扩增,而大约5%~10%的人类肿瘤有MDM2的过度表达[1]。本文着重探讨MDM2及P53在OLK和OSCC组织中的表达及其相关性,以期有助于探讨OLK的癌变机制及OSCC的早期诊断。
1 材料和方法
1.1 材料
OLK及OSCC标本均来自2009年1—9月在四川大学华西口腔医院头颈肿瘤外科住院手术的患者。其中,OLK组24例,OSCC组41例,所有患者术前均无放化疗史,并且术后经过病理科确诊。15例口腔正常黏膜组标本来源于肿瘤术后标本,所取组织肉眼观察距肿瘤边缘至少2 cm以上,并且显微镜下检查证实没有癌细胞。所有标本均经过甲醛固定,石蜡包埋,4μm层厚连续切片。
1.2 试剂与方法
小鼠抗人MDM2单克隆抗体由福州迈新生物技术开发有限公司提供,小鼠抗人P53单克隆抗体由基因科技(上海)有限公司提供,SP试剂盒由北京中杉金桥生物技术有限公司提供。染色步骤按说明书进行,用PBS代替一抗作为阴性对照,已知阳性片作为阳性对照。
1.3 结果判断
MDM2蛋白以胞核和胞浆出现棕黄色颗粒为阳性反应,P53蛋白以胞核出现棕黄色颗粒为阳性反应。每张切片400倍显微镜下随机选取5个视野,每个视野记数100个细胞,计算5个视野的阳性细胞的平均百分数,将平均百分数分为5级:-,阳性细胞数<5%;+,阳性细胞数为5%~25%之间;++,阳性细胞数为26%~50%之间;+++,阳性细胞数为51%~75%之间;++++,阳性细胞数>75%。其中出现阳性反应的组织中,+、++定为低表达组,+++、++++定为高表达组。
1.4 统计学处理
采用SPSS 13.0统计软件,计数资料进行χ2检验,相关性分析采用Spearman检验,以P<0.05为差异有统计学意义。
2 结果
2.1 MDM2蛋白在OLK和OSCC中的表达
MDM2蛋白主要在OLK及OSCC的细胞核和细胞浆中着色,颜色从黄色到深棕色(图1)。
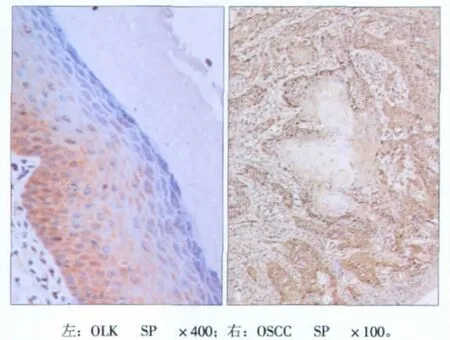
图1 MDM2蛋白在OLK和OSCC中的表达Fig 1 Expression of MDM2 in OLK and OSCC
口腔正常黏膜、OLK及OSCC组织中MDM2的阳性表达率分别为:0、58.3%和75.6%。MDM2在OLK组和OSCC组的阳性表达率与正常组相比均具有统计学差异(P<0.05),OLK组和OSCC组之间没有统计学差异(P=0.145>0.05)。对OLK组和OSCC组中MDM2表达阳性的低表达组和高表达组进行了统计分析,结果发现OLK组和OSCC组中MDM2的表达没有统计学差异(P=0.511)。但是MDM2在不同病变组织中的阳性表达率随组织恶性程度增高呈上升趋势,见表1。MDM2蛋白在OSCC组织中的表达与肿瘤部位、肿瘤大小、淋巴结转移及分化程度均无明显相关性(P>0.05),见表2。
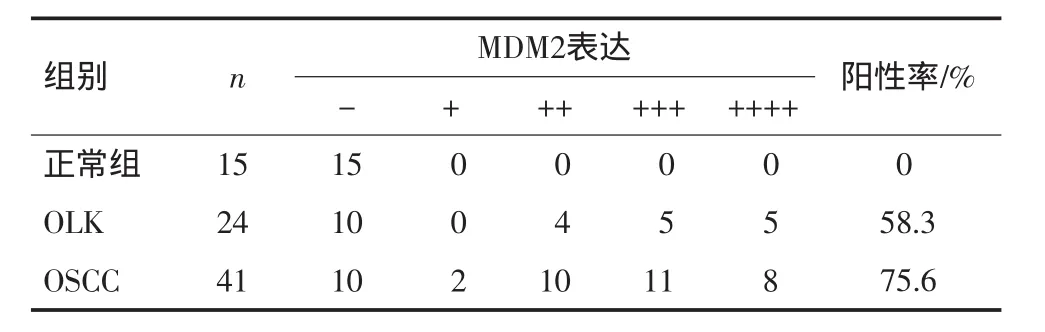
表1 口腔正常黏膜、OLK、OSCC中MDM 2的表达Tab 1 Expression of MDM 2 in normal oral mucosa,OLK and OSCC
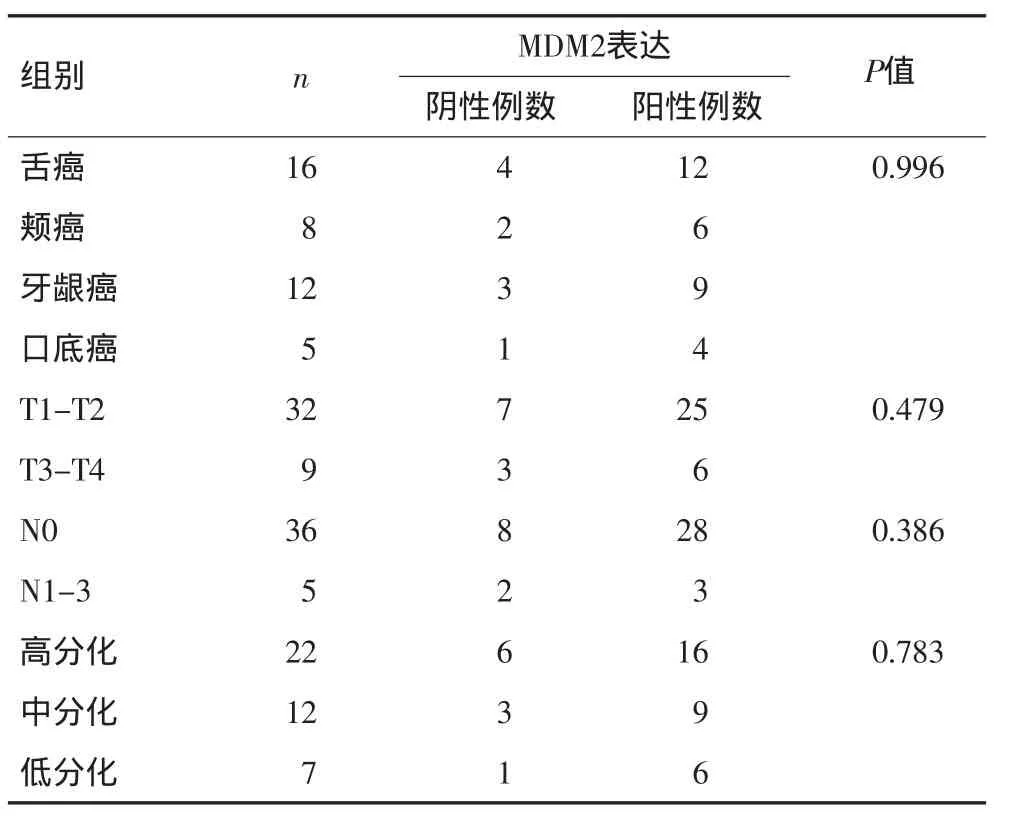
表2 MDM 2在OSCC中的表达与临床病理数据关系Tab 2 Correlation of MDM 2 protein expression in OSCC with clinicopathological parameters
2.2 P53蛋白在OLK和OSCC中的表达
P53蛋白主要在OLK及OSCC的细胞核中着色,为粗细不一的黄色颗粒状(图2)。口腔正常黏膜、OLK及OSCC组织中P53的阳性表达率分别为:0、37.5%和68.3%。P53在OLK组和OSCC组的阳性表达率与正常组相比均具有统计学差异(P<0.05),OLK组和OSCC组之间也具有统计学差异(P=0.016)。对OLK组和OSCC组中P53表达阳性的低表达组和高表达组也进行了统计分析,结果发现OLK组和OSCC组中P53的表达没有统计学差异(P=0.772)。但是P53在不同病变组织中的阳性表达率随组织恶性程度增高呈上升趋势,见表3。

图2 P53蛋白在OLK和OSCC中的表达Fig 2 Expression of P53 in OLK and OSCC
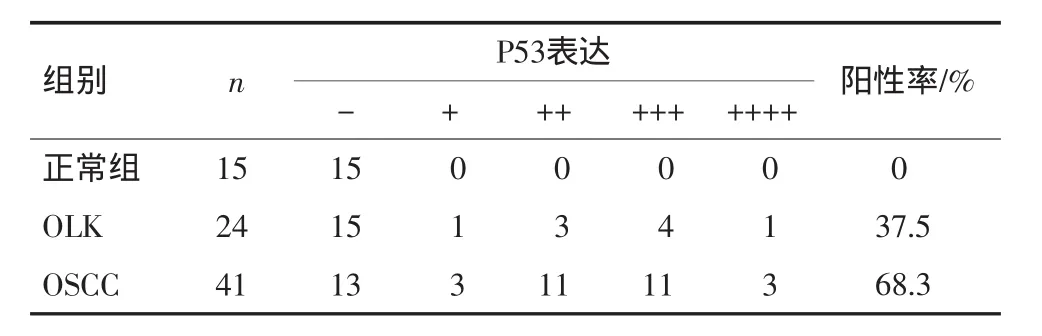
表3 口腔正常黏膜、OLK、OSCC中MDM 2的表达Tab 3 Expression of P53 in normal oral mucosa,OLK and OSCC
2.3 MDM2与P53蛋白表达的相关性
通过对MDM2和P53蛋白表达的相关性进行统计分析发现:MDM2与P53蛋白在OLK及OSCC中均呈现正相关的关系(P=0.018和P=0.000)。
3 讨论
口腔鳞状细胞癌作为口腔最常见的恶性肿瘤,其预后往往较差,对患者的生活质量影响甚大。OLK在组织病理学上表现为上皮单纯性增生或上皮异常增生,约有3%~5%的OLK会转变为OSCC。对OLK和OSCC的关系进行研究有助于探讨OSCC发生的作用机制,对OSCC的预防及早期诊断有重要意义。
MDM2最初由Cahilly-Snyder等[2]在Ballb/c3T3成纤维细胞系中鉴定出来,它在进化过程中很保守,在鼠和人的许多组织中都有表达。人类MDM2定位于12p13-14,其表达的调节相当复杂,并且mRNA剪接形式的方式多样[3]。MDM2有5个保守区,其中在V区含有一个环指结构域,可介导蛋白质-蛋白质的相互作用,也可以与DNA或RNA结合[4]。MDM2具有癌基因的功能,它可以和P53结合并抑制P53的功能,36%的肉瘤存在MDM2的扩增,而大约5%~10%的人类肿瘤有MDM2的过度表达[1]。MDM2的癌基因功能已经在肺癌、乳腺癌等恶性肿瘤中得到证实[5-7]。 MDM2在OSCC中的作用国外报道也有很多[8-10],国内唐瞻贵等[11-12]发现其在口腔疣状癌中发挥重要作用。虽然MDM2在OLK中的作用国外早有文献报道[13],但是近年来一直没有进展,而国内这方面的报道则少见。
p53被称为基因组卫士,大约50%以上的人类恶性肿瘤中发生了p53基因的突变[14]。p53介导的信号途径在细胞的生长、分化、衰老、应激等生命过程中起着重要的调控作用,而且与细胞内其他信号转导通路间存在着错综复杂的相互关系[15],其中P53与MDM2形成的负反馈调节环最引人注目。MDM2是p53的转录靶基因,含有2个p53基因结合位点,在抑制p53的活性过程中发挥关键的作用。P53的过表达或活性上升可促进MDM2表达,致使细胞中MDM2蛋白水平升高,并转而与P53的N末端转录激活区结合形成复合物,封闭其转录活性,抑制其功能,而MDM2水平的升高,反过来激活P53,抑制MDM2,这样就形成了一个P53/MDM2负反馈调节环,调节P53的稳定性[16]。另外,在没有应激刺激的条件下,MDM2通过泛素蛋白连接酶,使P53羧基末端多个赖氨酸泛素化,促使P53的降解[17]。
本研究表明:MDM2在OLK组和OSCC组的阳性表达率与正常组相比均具有统计学差异(P<0.05),并且MDM2在不同病变组织中的阳性表达率随组织恶性程度增高呈上升趋势。这说明MDM2蛋白在正常黏膜组织到癌转化的初始阶段(癌前病变,如白斑)就已经参与其中并起到重要的作用,并且它的作用有随组织的恶性程度升高而增加的趋势。然而MDM2在OLK组和OSCC组之间的阳性表达率却没有统计学差异(P=0.145>0.05),这说明虽然MDM2的作用有随组织的恶性程度升高而增加的趋势,但是其在OLK组和OSCC组中所起的作用却相差不大。推测这是因为MDM2的过表达在口腔正常黏膜到OLK的转化过程中就已经频繁发生,而不是OSCC阶段才发生的事件。Lim等[8]也证明:在OSCC的发生中经常发生MDM2的过表达事件。另外,本研究还发现OLK组中MDM2染色的细胞主要位于上皮基底层,而在OSCC组中MDM2染色的细胞则基本布满整个上皮层,这也与国外的报道[18]相一致。
野生型P53的半衰期很短,不易检测到,而突变型P53蛋白其半衰期延长,能够用免疫组织化学的方法检测出。本研究中P53在OLK组和OSCC组的阳性表达率与正常组相比均具有统计学差异(P<0.05),并且P53在不同病变组织中的阳性表达率也随组织恶性程度增高而呈现上升的趋势,这与之前的研究结论相符[13,19]。
肿瘤的形成往往是多种因素同时或先后作用的结果,为此本实验进一步研究了2种蛋白出现阳性表达的相关性。Yanamoto等[9]研究发现P53/MDM2的联合表达与OSCC的侵袭程度有关。本实验结果表明:MDM2与P53蛋白在OLK及OSCC中的表达均呈现正相关的关系。这说明:从口腔正常黏膜向OLK乃至OSCC转变的过程中,MDM2与P53蛋白的作用密切相关,很可能是这二者的协同作用最终导致了OSCC的发生。
目前,对肿瘤发生的分子机制、基因治疗等研究主要集中在“基因组卫士”P53身上,P53基因治疗OLK的研究方兴未艾[20-21],而MDM2作为P53主要的抑制因子,对MDM2与P53蛋白在口腔肿瘤中的表达及相关性进行研究显得尤为必要。本研究对MDM2与P53蛋白在口腔正常黏膜、OLK及OSCC不同疾病阶段的表达及相关性进行了初步研究,这将有助于阐明口腔肿瘤发生及转归的机制,对口腔肿瘤的临床预防、监测具有一定的指导意义。
[1] Schon O,Friedler A,Bycroft M,et al.Molecular mechanism of the interaction between MDM2 and p53[J].JMol Biol,2002,323(3):491-501.
[2] Cahilly-Snyder L,Yang-Feng T,Francke U,et al.Molecular analysis and chromosomal mapping of amplified genes isolated from a transformed mouse 3T3 cell line[J].Somat Cell Mol Genet,1987, 13(3):235-244.
[3] Momand J,Zambetti GP.MDM2:“big brother”of p53[J].J Cell Biochem,1997,64(3):343-352.
[4] Juven-Gershon T,Oren M.Mdm2:The ups and downs[J].Mol Med,1999,5(2):71-83.
[5] Dworakowska D,Jassem E,Jassem J,et al.MDM2 gene amplification:A new independent factor of adverse prognosis in nonsmall cell lung cancer(NSCLC)[J].Lung Cancer,2004,43(3):285-295.
[6] Turbin DA,Cheang MC,Bajdik CD,et al.MDM2 protein expression is a negative prognostic marker in breast carcinoma[J].Mod Pathol,2006,19(1):69-74.
[7] Hu Z,Ma H,Lu D,et al.Genetic variants in the MDM2 promoter and lung cancer risk in a Chinese population[J].Int J Cancer,2006,118(5):1275-1278.
[8] Lim KP,Sharifah H,Lau SH,et al.Alterations of the p14ARF-p53-MDM2 pathway in oral squamous cell carcinoma:MDM2 overexpression is a common event[J].Oncol Rep,2005,14(4):963-968.
[9] Yanamoto S,Kawasaki G,Yoshitomi I,et al.p53,mdm2,and p21 expression in oral squamous cell carcinomas:Relationship with clinicopathologic factors[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2002,94(5):593-600.
[10]Hamid S,Yang YH,Peng KN,et al.MDM2 SNP309 does not confer an increased risk to oral squamous cell carcinoma but may modulate the age of disease onset[J].Oral Oncol,2009,45(6):496-500.
[11]唐瞻贵,邹萍,姚志刚,等.MDM2在口腔疣状癌中的表达及意义[J].实用口腔医学杂志,2004,20(3):375-376.
TANG Zhan-gui,ZOU Ping,YAO Zhi-gang,et al.Expression of MDM2 protein in oral verrucous carcinoma[J].J Pract Stomatol, 2004,20(3):375-376.
[12]唐瞻贵,邹萍,姚志刚,等.MDM2及p53在口腔疣状癌中的表达研究[J].口腔颌面外科杂志,2004,14(4):304-306.
TANG Zhan-gui,ZOU Ping,YAO Zhi-gang,et al.The expression study of MDM2 and p53 in oral verrucous carcinoma[J].J Oral Maxillofac Surg,2004,14(4):304-306.
[13]Agarwal S,Mathur M,Srivastava A,et al.MDM2/p53 co-expression in oral premalignant and malignant lesions:Potential prognostic implications[J].Oral Oncol,1999,35(2):209-216.
[14] Vousden KH,Prives C.P53 and prognosis:New insights and further complexity[J].Cell,2005,120(1):7-10.
[15]Vogelstein B,Lane D,Levine AJ.Surfing the p53 network[J]. Nature,2000,408(6810):307-310.
[16]Momand J,Wu HH,Dasgupta G.MDM2—master regulator of the p53 tumor suppressor protein[J].Gene,2000,242(1/2):15-29.
[17]Fang S,Jensen JP,Ludwig RL,et al.Mdm2 is a RING fingerdependent ubiquitin protein ligase for itself and p53[J].J Biol Chem,2000,275(12):8945-8951.
[18] Ganguli G,Abecassis J,Wasylyk B.MDM2 induces hyperplasia and premalignant lesions when expressed in the basal layer of the epidermis[J].EMBO J,2000,2(19):5135-5147.
[19]Khan Z,Tiwari RP,Mulherkar R,et al.Detection of survivin and p53 in human oral cancer:Correlation with clinicopathologic findings[J].Head Neck,2009,31(8):1039-1048.
[20]徐波,张松涛,李龙江,等.重组腺病毒p53转染口腔黏膜异常增生细胞的实验研究[J].华西口腔医学杂志,2009,27(2):122-125.
XU Bo,ZHANG Song-tao,LI Long-jiang,et al.An experimental study on recombinant adenovirus p53 transfected in oral dysplastic epithelial cells[J].West China J Stomatol,2009,27(2):122-125.
[21] Zhang S,Li Y,Li L,et al.PhaseⅠstudy of repeated intraepithelial delivery of adenoviral p53 in patients with dysplastic oral leukoplakia[J].J Oral Maxillofac Surg,2009,67(5):1074-1082.
(本文编辑 汤亚玲)
Expression and its relationship of murine double m inute 2 and P53 protein in oral leukoplakia and squamous cell carcinoma
HAN Bang-feng,WU Ping-fan,PAN Jian,LI Yi,LI Long-jiang.(State Key Laboratory of Oral Diseases,Sichuan University,Chengdu610041,China)
ObjectiveTo study the expression and its relationship of murine double minute 2(MDM2),P53 protein in oral leukoplakia and squamous cell carcinoma.MethodsImmunohistochemical assay was used to detect the expression of MDM2 and P53 proteins in 15 normal oral epithelium tissues,24 cases of oral leukoplakias and 41 cases of oral squamous cell carcinomas.Results There were no positive expression of MDM2 and P53 in normal mucosa.With significantly difference compared with the normal group(P<0.05),the positive rates of MDM2 and P53 were 58.3%,75.6%and 37.5%,68.3%in oral leukoplakia and squamous cell carcinoma.MDM2-positive rate had no significant difference(P>0.05),while P53-positive rate was significant difference(P<0.05)compared with oral leukoplakia and oral squamous cell carcinoma.Two kinds of indicators for further correlation analysis showed that MDM2 and P53 protein showed a positive correlation relationship both in oral leukoplakia(P=0.018)and oral squamous cell carcinoma(P=0.000).ConclusionThe expression of MDM2 in oral leukoplakia and oral squamous cell carcinoma suggests that this gene may play a significant role in the process of carcinogenesis of oral squamous cell carcinoma.The correlation of MDM2 and P53 expression indicates that both of them may play a synergistic role in the process of carcinogenesis of oral squamous cell carcinoma.
murine double minute 2; P53 protein; oral leukoplakia; oral squamous cell carcinoma
R 782.2
A
10.3969/j.issn.1000-1182.2011.01.019
1000-1182(2011)01-0079-04
2009-11-25;
2010-03-02
国家自然科学基金资助项目(30973345和30471901)
韩帮锋(1982—),男,山东人,硕士
李龙江,Tel:028-85501428
