腰椎间盘镜融合术后早期感染的影像学分析
2011-03-07吕浩然何二兴杨进顺
吕浩然 何二兴 黄 彦 杨进顺
(广州医学院第二附属医院骨外科,广州市 510260)
腰椎间隙感染是腰椎间盘术后一种严重的脊柱疾病及并发症,早期常因对本病认识不足而发生延误诊治[1]。近年来随着脊柱手术尤其是经皮旋切、溶核术、椎间盘镜技术的开展以及合并糖尿病和免疫抑制剂的应用,术后感染的发病率有上升趋势。我科应用自主研发的微创脊柱内窥镜下应用的手术器械联合改进创新的内镜下手术方法,对术后经临床和手术病理证实的12例椎间隙感染患者均行影像学检查,以期总结并提高临床对术后早期椎间隙感染影像特点的认识。
1 临床资料
1.1 一般资料 2006年10月至2010年11月我科应用椎间盘镜及自主研发的脊柱微创手术器械治疗腰椎间盘退行性疾病发生术后椎间隙感染者12例,其中男5例,女7例;年龄23~51岁,平均45.1岁;L4、5椎间盘6例,L5~S1椎间盘5例,L2、3椎间盘1例;均采用椎间盘镜下半椎板术式减压。椎间盘摘除后,应用可膨胀椎间融合器进行椎体间的融合固定;术后感染发病为3~12 d,平均6.2 d。临床表现为原有腰腿痛症状在手术第1天明显缓解后,术后3~12 d再发生较术前更为剧烈的疼痛,以腰痛为主,甚至疼痛放射到臀部、髋部及会阴部,夜间较剧,身体的移动、滚动可诱发或加剧疼痛,体温低热或高热;血沉明显加快,白细胞及分叶中性粒细胞均有升高,C反应蛋白异常。查体:被动强直体位,腰肌紧张,病变部位深压痛、叩击痛,镇痛药物止痛时效短暂,缓解症状不明显。术前查体直腿抬高试验阳性征再次出现并多有加重,部分病人单侧或双侧下肢肌力较术前减退。
1.2 诊断方法 全部病例均摄腰椎正、侧位片,CT成像采用Solnaton CRF全身CT扫描仪,层厚4 mm、层距4 mm,每层间隔扫3~4层。MRI使用美国Techni-care车载Ⅱ型场强0.6T超导扫描机和脊柱表面线图,常规采用自旋回波(sE)扫描矢状、横断,TWI、T2WI。T1WI(TR 500 ms/TE 28 ms)、T2WI(TR 2000 ms/TE 45~90 ms)。层厚及间距为5 mm,扫描距阵256×256。积极完善术前准备行开放手术,手术中均在原手术椎间隙发现病灶组织及脓液,手术清除的病灶组织或脓液进行细菌培养,2例阴性,3例为阴性葡萄球菌,3例为表皮葡萄球菌,4例为金黄色葡萄球菌。
2 结果
2.1 X线检查 早期均未见明显局限性骨破坏及骨密度增高等异常,3例可见局部腰大肌影略有扩大,由于病变累及纤维环、软骨板和软骨下骨,X平片表现为椎间隙轻度狭窄或不窄,骨性关节面疏松、模糊不清呈云雾状,腹腔气体多,为反射性肠淤胀(见图1)。

图1 未见明显局限性骨破坏及骨密度增高,局部可见肠胀气
2.2 CT检查 患者术后感染早期,感染的椎间隙临近椎体均有不同程度骨质疏松,所有患者相应的椎间隙有低密度软组织阴影(炎性渗出物和残留的髓核组织)向周边膨出挤压椎管内硬膜组织与硬膜囊,但是与椎管之间的边界显示不清楚,CT值为30~50 HU,腰大肌与椎体之间的脂肪间隙消失。7例患者的感染椎间盘层面见椎间盘密度明显减低。5例中部分患者的CT扫描,可见病变间隙出现模糊的假性椎间盘突出,有界线不清的软组织影挤压硬膜囊(见图2)。
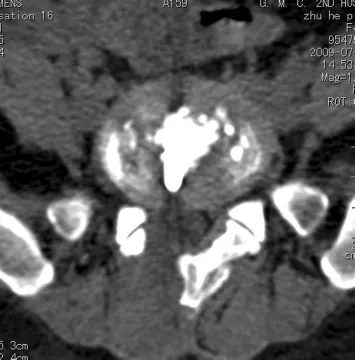
图2 炎性渗出物挤压椎管内硬膜组织与硬膜囊,边界不清
2.3 MRI检查 12例病变椎间盘邻近椎体带状均匀异常信号,T1W I呈低信号、T2WI呈高信号,横断面T加权清晰地显示病变相邻的腰大肌内缘的脂肪信号消失,椎体及椎弓根亦有异常的信号充填。椎间隙变窄,边缘模糊粗糙,椎间盘变形,碎裂变小或消失,残余部分呈略低信号,正常髓核信号内的裂隙消失(见图3)。3例出现椎旁脓肿,表现为围绕椎体呈环状软组织影为稍短的T信号,其中2例见到小的液化区,1例脓肿向外成软组织肿块,累及右侧腰大肌、椎管及硬膜外间隙;1例蛛网膜炎囊肿形成,硬膜囊充盈缺损,脊髓稍移位,信号稍高于脑脊液。Gd-DTPA增强扫描清楚显示病变椎体、椎间盘及周围组织结构信号异常-对比增强。早期的感染椎间隙未见骨质增生硬化及周围形成骨桥及椎体融合。
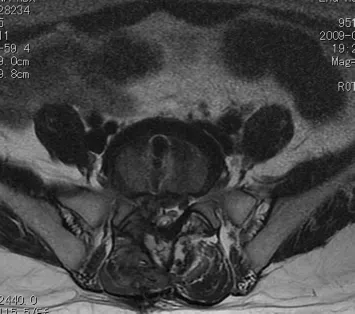
图3 清楚显示病变椎间盘及渗出坏死组织结构信号异常
2.4 治疗 急性椎间隙感染被确诊后应立即给予联合两组以上的大剂量敏感抗生素静脉注射;同时,尽早行开放手术,彻底清除病灶组织及脓液,并于感染局部放置混合万古霉素的人工骨颗粒;感染侵犯到已经手术的椎间隙,则应拆除椎间融合器,术后继续联合两组以上大剂量敏感抗生素抗感染治疗3周以上。所有患者症状均得到控制,疼痛、麻痹等症状迅速好转并逐渐消失,患者均痊愈出院。
3 讨论
3.1 椎间隙感染的特点 腰椎间盘突出症行椎间盘镜手术后的椎间隙感染,其病因尚不十分清楚[2],因微创内窥镜手术需要的显示屏、连接线、操作杆等众多的辅助器械明显多于常规的开放手术,大量的辅助器械消毒容易出现疏漏,故本治疗组倾向于微创脊柱手术多为细菌性感染,其感染途径为术中污染或细菌经血源感染。有动物模型研究椎间隙感染的形成原因和病理过程,发现致病细菌侵入椎间隙后大量繁殖可以引起炎症细胞浸润、血管增生、肉芽增生、终板破坏、椎间隙狭窄等系列病理改变[3]。由于终板的屏障作用,椎间盘的血运差,椎盘退变后丧失屏障作用尤其明显。所以,感染病变的椎间隙相当于一个生理性死腔,一旦手术野污染,术后引流不通畅,或椎间隙未作彻底冲洗,残留的血肿就成为细菌最好的培养基[4]。由于椎间隙的独特环境导致椎间隙的感染症状常常表现较局限,并且进展较慢,所以血象可以不高,患者全身高热症状少见。其临床特点是起病分急性、亚急性、慢性,本组为急性。术后一周左右,手术切口处无红肿热等炎症表现,但原有的腰腿痛消失后出现明显剧烈腰痛,椎旁叩击痛显著,卧床不能缓解,翻身等活动时诱发剧烈疼痛,且椎旁肌肉痉挛。
3.2 影像学表现 影像学检查在椎间隙感染的诊断中起着重要的作用,X线平片、CT、ECT、MRI均有诊断价值[5]。X线平片早期变化不大,骨质破坏、软组织肿胀不如MRI、CT清晰,但只要密切结合病史、体征,定期复查,追踪可疑病例,并认真仔细阅读X线片与其他检查手段,综合分析,完全可以在Ⅰ期做出正确诊断,进行及时有效的治疗。有报道断层X片早期诊断率好于普通X片,平片上能显示骨质疏松、椎间隙狭窄、终板破坏等改变,但这些改变一般在4~6周才能清楚地显现出来,发病3个月左右出现椎间隙变窄,相邻椎体骨破坏、增生及形成骨唇,而骨质硬化、骨质融合则要在6个月至2年后方能出现。
CT扫描在显示骨小梁改变和骨破坏方面比X线平片早,CT平扫可证实椎体骨质破坏,椎体前方不规则形低密度病灶,与腰大肌界限不清;增强扫描后,可见病灶周边出现环状强化则诊断更明确。CT扫描诊断本病的灵敏度、准确率和特异性尽管不如MRI高,但显示病灶及其周围组织解剖关系比较清楚,并可弥补X线平片对软组织分辨率低的缺陷,通过测定CT值可判断突向椎管内的物质是椎间盘组织还是感染物质。但CT的单平面(横断面)、单因素(组织密度)成像能力难以显示椎间盘及椎体的化脓性感染及炎性渗出的病理特征,很难将肉芽组织、纤维变性组织与炎性组织相区分。
MRI具有组织分辨力高及多方位成像的优点[6],对病变组织形态学及生化环境的改变极为敏感,它不仅能全面显示椎间隙感染病理改变的特征,还能观察到椎管内结构的形态和信号改变,如硬膜外脓肿、蛛网膜炎等。MRI可比X线平片和CT提早两周敏感地显示出椎间盘、椎体及椎旁软组织的信号异常,尤其是感染椎间盘相邻上下椎体的长T1信号改变,特别有利于发现病变,可作出椎间隙感染的早期诊断,为治疗与预后判断提供依据。MRI对于椎间隙感染的诊断具有高度的特异性、敏感性及准确性,尤其在早期诊断中独具优势,应作为诊断腰椎间隙感染的“金标准”。早期在X平片没有任何改变之前,MRI可清楚显示间隙及椎体被炎症浸润改变。同时,局部脓液的位置及范围清楚可见,可为手术探查的入路及范围提供宝贵的指引。
[1] 陆禹严,黄德征,李 春.腰椎间盘镜治疗腰椎间盘突出症187例报告[J].微创医学,2008,3(2):151-152.
[2] Eguchi Y,Ohtori S,Yamashita M,et al.Diffusion magnetic resonance imagingto differentiate degenerative from infectious endplate abnormalities in the lumbar spine[J].Spine,2011,36(3):198-202.
[3] Deshmukh VR.Midline trough corpectomies for the evacuation of an extensive ventral cervical and upper thoracic spinal epidural abscess[J].J Neurosurg Spine,2010,13(2):229-233.
[4] Yang HS,Chen DY,Yuan W,et al.Paresis associated with aconuresis caused by intervertebral disc calcification at c7-t1:a case report and review of the literature[J].Spine(Phila Pa 1976),2010,35(10):E434-439.
[5] Ito M,Sudo H,Abumi K,et al.Minimally invasive surgical treatment for tuberculous spondylodiscitis[J].Minim Invasive Neurosurg,2009,52(5-6):250-253.
[6] Gerlach UA,Kohler S,Sauer IM,et al.Aspergillus spondylodiscitis after multivisceral transplantation[J].Ann Transplant,2009,14(4):52-57.
