基质金属蛋白酶组织抑制因子-1、2在宫颈鳞癌中的表达及意义*
2011-02-28南云泽刘丽利林贞花金仁顺
南云泽 刘丽利 林贞花 金仁顺
宫颈癌是妇女最常见的恶性肿瘤之一,全球范围内宫颈癌的发病率虽有下降趋势,但仍是恶性肿瘤造成妇女死亡的第二位因素。肿瘤细胞侵袭和转移是宫颈癌患者死亡的根本原因。控制肿瘤的侵袭和转移是当前研究的重点。基质金属蛋白酶(MMPs)可降解细胞外基质和基底膜,是与肿瘤侵袭、转移关系最为密切的一类蛋白水解酶,而MMPs活性又可被基质金属蛋白水解酶组织抑制因子(tis⁃sue inhibitor of matrix metalloproteinase,TIMPs)所抑制。本文旨在应用免疫组化技术检测TIMP-1和TIMP-2在宫颈鳞癌组织中的表达情况,并探讨其与宫颈癌生物学行为的关系,从而明确其在肿瘤侵袭转移过程中的作用。
1 资料与方法
1.1 一般资料 标本选自2001年7月—2009年7月我院妇产科住院手术切除的组织,其中宫颈鳞癌标本(鳞癌组)46例,年龄22~59岁,平均年龄(42.89±7.16)岁,临床分期采用国际妇产科联盟(FIGO)2000年修订的标准[1]。宫颈原位癌标本(原位癌组)34例,年龄25~64岁,平均年龄(38.97±8.09)岁。选取20例同期因子宫肌瘤行子宫切除的正常宫颈标本作为对照组,年龄25~64岁,平均年龄(40.25±8.90)岁。全部病例在术前均未接受放疗、化疗,临床及病理资料完整。3组间年龄比较差异无统计学意义(F=2.56,P>0.05)。
1.2 主要试剂 兔抗人TIMP-1免疫组化多克隆抗体(40282Ra),兔抗人TIMP-2免疫组化多克隆抗体(40283Ra),即用型快捷免疫组化MaxvisionTM试剂盒(鼠/兔),DAB显色试剂盒,均购自福州迈新生物技术有限公司。
1.3 染色方法 所有标本均经10%中性福尔马林固定,常规石蜡包埋,4 μm厚连续切片,并行常规HE染色经病理科专家阅片复诊。免疫组织化学MaxvisionTM法严格按试剂盒说明书进行,DAB显色,苏木素复染,封片后用光学显微镜观察。同时设置阴性对照(用PBS代替一抗),阳性对照用已知阳性片。
1.4 结果判定标准 TIMP-1、TIMP-2蛋白阳性信号呈棕黄色颗粒样,位于细胞质内。观察全片,按阳性细胞所占百分比及着色程度进行结果判定[2]。按阳性细胞比例判定:阳性细胞≤10%1分,10%~50%2分,>50%3分;按染色程度判定:阴性为0分,淡黄色1分,中度黄色2分,棕黄色3分。按阳性细胞得分×染色程度得分计总分,总分<3为阴性,≥3为阳性。
1.5 统计学处理 采用SPSS 17.0统计软件,计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 宫颈病变组织中TIMP-1和TIMP-2蛋白的表达 TIMP-1和TIMP-2蛋白在原位癌组及鳞癌组的阳性表达率均较高,与对照组比较差异均有统计学意义(P<0.05),但鳞癌组与原位癌组比较差异无统计学意义(P>0.05),见表1,图1~6。
2.2 TIMP-1和TIMP-2蛋白的表达与子宫颈鳞癌临床病理特征的关系 不同临床分期和病理类型的患者TIMP-1和TIMP-2蛋白的阳性表达率差异无统计学意义(P>0.05),有无淋巴结转移的患者TIMP-2阳性表达率差异有统计学意义(P<0.05),见表2。
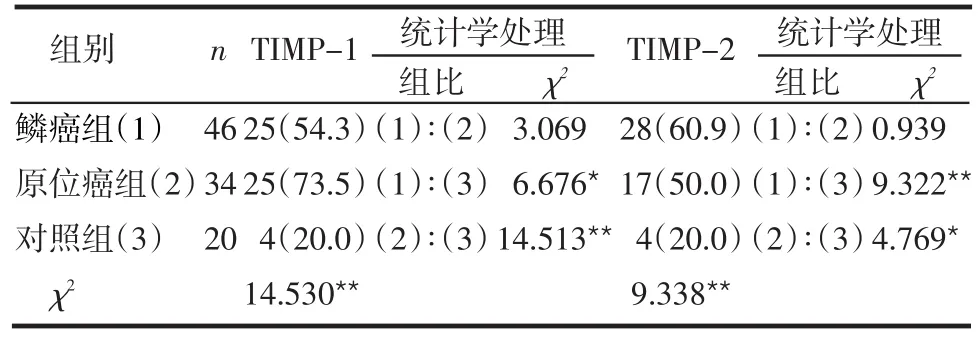
表1 TIMP-1及TIMP-2在不同宫颈组织中的阳性表达例(%)
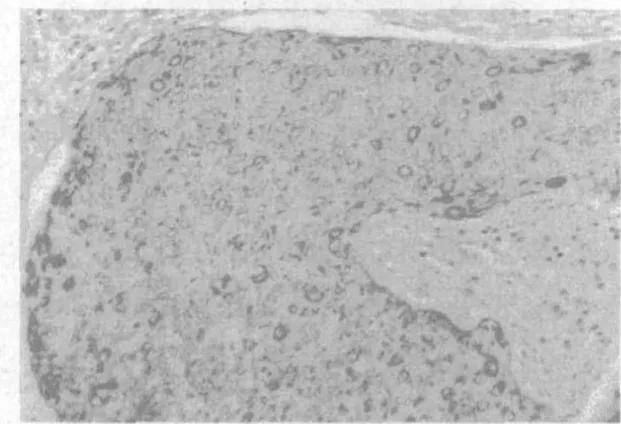
图1 宫颈鳞癌TIMP-1(MaxvisionTM×100)
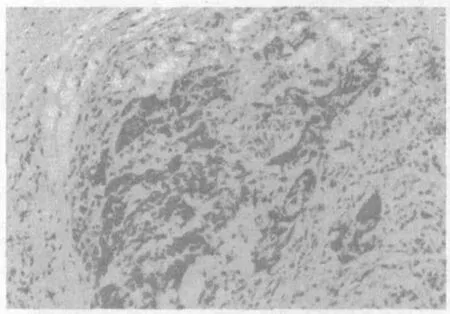
图2 宫颈鳞癌TIMP-2(MaxvisionTM×100)

图3 宫颈原位癌TIMP-1(MaxvisionTM×100)

图4 宫颈原位癌TIMP-2(MaxvisionTM×100)

图5 正常宫颈上皮TIMP-1(MaxvisionTM×100)

图6 正常宫颈上皮TIMP-2(MaxvisionTM×100)
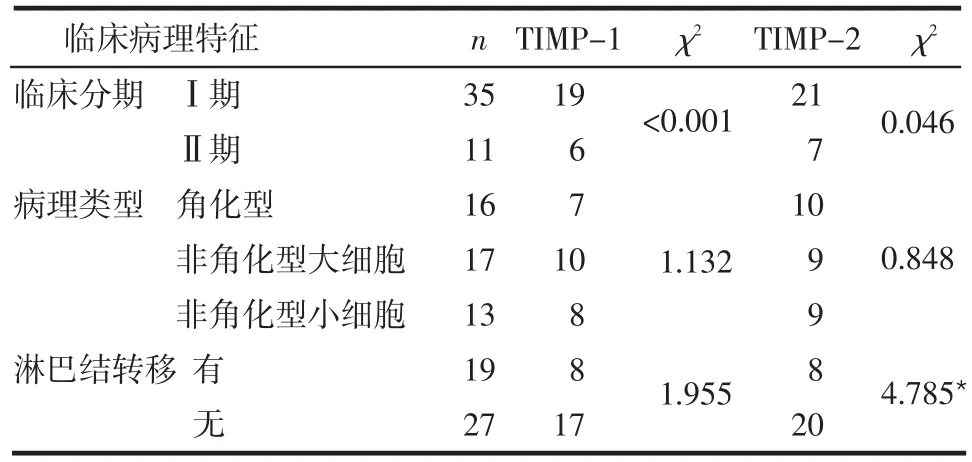
表2 宫颈鳞癌TIMP-1及TIMP-2的免疫组化结果
3 讨论
浸润和转移是恶性肿瘤的典型特征,是导致肿瘤患者死亡的主要原因。肿瘤的浸润与转移是一个动态的、复杂的、多步骤的过程,其中细胞外基质的降解是肿瘤浸润正常组织及开始转移的基本途径,基质金属蛋白酶为降解细胞外基质的一组最重要的酶,该过程对肿瘤细胞的浸润以及相继发生的转移较为重要。而其中与妇科恶性肿瘤关系较为密切的为MMP-2和MMP-9,同时MMPs活性又受到其抑制剂的调节,MMP-2、MMP-9的特异性组织抑制剂分别为TIMP-2和TIMP-1[3]。有研究表明,对MMPs的适当抑制和调控可以对肿瘤细胞的侵袭和转移进行控制,阻断肿瘤血管的生成,从而阻断肿瘤的生长和发展[4]。本研究表明,TIMP-1和TIMP-2蛋白在鳞癌组和原位癌组的阳性表达率均高于对照组,这表明在细胞发生癌变过程中TIMP-1、2起着重要的作用。但鳞癌组与原位癌组比较差异无统计学意义,可推测在子宫颈鳞癌的发展过程中TIMP-1、2的表达是一早期事件。
宫颈癌的转移方式主要是淋巴道转移,临床上也是以有无淋巴结的转移来判断预后和指导临床治疗。有无淋巴结转移的宫颈鳞癌患者TIMP-2阳性表达率差异有统计学意义,提示TIMP-2在宫颈鳞癌的肿瘤细胞的浸润和转移中起抑制作用。在宫颈鳞癌中TIMP-1的阳性表达率较原位癌组低,但有无淋巴结转移的宫颈鳞癌患者TIMP-1阳性表达率差异无统计学意义。据此推测,TIMP-1对于肿瘤细胞的浸润和转移是一双向调节因子。有报道,TIMP的超表达与恶性肿瘤的侵袭转移行为呈正相关[5]。也有研究表明TIMP-1对肿瘤的侵袭既有保护作用又有抑制作用,这依赖于肿瘤的TIMP-1的基因型而不是宿主本身[6]。在以后的研究中,笔者要对其进行深入研究,从而进一步确定TIMP-1是否能够作为治疗肿瘤的药物用于临床。
[1]乐杰.妇产科学[M].第7版.北京:人民卫生出版社,2008:265-266.
[2]杜华贞,张延新,李维山,等.KISS-l与TIMP-1在胃癌中的表达及临床病理意义[J].临床与实验病理学杂志,2008,24(3):374-376.
[3]Cruz-Munoz W,Khokha R.The role of tissue inhibitors of metallo⁃proteinases in tumorigenesis and metastasis[J].Crit Rev Clin Lab Sci,2008,45(3):291-338.
[4]Raffetto JD,Khalil RA.Matrix metalloproteinases in venous tissue remodeling and varicose vein formation[J].Curr Vasc Pharmacol, 2008,6(3):158-172.
[5]Murphy PM.Chemokines and the molecular basis of cancer metasta⁃sis[J].N Engl J Med,2001,345(11):833-835.
[6]Soloway PD,Alexander CM,Werb Z,et al.Targeted mutagenesis of Timp-1 reveals that lung tumor invasion is influenced by Timp-1 genotype of the tumor but not by that of the host[J].Oncogene, 1996,13(11):2307-2314.
