汽化过氧化氢(VHP)常温灭菌系统的应用探讨
2011-02-27史云
史 云
(中国医学科学院医学生物学研究所,云南昆明 650118)
汽化过氧化氢(VHP)生物灭菌技术是一种在常温状态下将液态过氧化氢转换成气态过氧化氢的灭菌消毒方法,国内外均有不少研究成果报告,其主要特点是干燥、作用快速、无毒无残留等优越性,该灭菌消毒技术广泛用在生物技术、医药卫生、制药行业等领域。VHP有较好的物质相容性包括很多金属和塑料,适用于房间、生物安全柜、传递窗、动物笼交换站、隔离器和医疗器械等表面的灭菌消毒。汽化过氧化氢(VHP)生物灭菌系统由美国的思泰瑞集团(STERIS)公司开发,是一种新型灭菌消毒工艺,1990年汽化过氧化氢(VHP)被美国EPA(美国环境保护署)注册为一种高效灭菌剂,由35%的双氧水通过VHP发生器汽化产生,实验证明:汽化状态的双氧水,其杀灭细菌芽孢的能力约为液态双氧水大于200倍。《柳叶刀》2004年8月7日的一篇报道指出:“独特的干燥VHP程序能够灭活导致Creutzfeld- Jakob病和疯牛病的朊病毒”。这项工艺正在为许多制药企业和研究实验室提供无菌环境,还被两家美国联邦大楼用于清除炭疽污染。VHP灭菌系统1991年开始投放欧美市场并广泛应用,2000年以后,广泛应用于制药行业空间灭菌。欧美应用VHP灭菌消毒已经接近20年,是十分成熟的工艺。
新版GMP正式颁布之日日益临近,其中变化最大的就是无菌药品生产要求方面新增附录(无菌药品)部分,对无菌药品生产要求较之旧版GMP要求将大幅提高,新版GMP增加了无菌操作的具体要求,强化了无菌保证的措施,净化级别采用欧盟及WHO的标准,实行A、B、C、D四级标准。今后,无菌药品生产要符合其要求,必须依托于与其相适应的制药装备才能实现。
疫苗等生物制品为最终非灭菌产品,在无菌药品生产中属于最高级别,从非无菌端向无菌端传送物料是无菌制剂生产中最关键的操作之一。生物制品生产过程中,经常有很多物料要由低级别区域向高级别区域无菌转运,如D级区域向C级区域转运,或C级区域向B级区域转运等,一些物料(如:装有带有生物活性溶液的移动罐)、器械及设备等的外表面不能采用高温灭菌方式进行无菌转运,传统的酒精喷洒外表面灭菌方式由于不能进行灭菌验证,已不能符合GMP要求,由于臭氧、甲醛、二氧化氯、过乙酸及ETO等低温灭菌方式在欧盟及WHO已经被逐步淘汰,新版GMP又基本参照欧盟及WHO标准执行, 臭氧及甲醛等传统低温灭菌方式的灭菌验证方式在中国GMP认证专家中有很大争议,在即将颁布的新版GMP无菌转运过程要求中,这些冷灭菌方式已经基本被否定或验证条件苛刻难以达到,如果在新建的生物制品药厂项目工艺设计中,还采用臭氧及甲醛等冷灭菌方式进行无菌转运, 在新的GMP认证过程中将面临重大缺陷的存在,今后将可能进行大规模的厂房及设备改造,造成重大的经济损失。VHP灭菌系统是欧盟及WHO及国内众多认证专家普遍认可的冷灭菌方式,与其他传统冷灭菌技术比较的结果见下表。针对热敏产品表面的灭菌消毒,VHP开创了一种可完全验证、符合规范要求安全、可重现的解决方案。VHP灭菌技术可使生物负荷下降 6log,汽化过氧化氢进入腔体后,蒸汽将与产品和腔体内壁接触,利用其强氧化性杀灭所有微生物。由于过氧化氢低温灭菌的特殊工作原理,在灭菌消毒循环结束后没有任何危害物质残留,对人体及环境影响很小, 安装与操作简单、使用安全,消毒过程全自动化控制,低温、低湿、 灭菌时间短,是一种理想的冷灭菌方式。
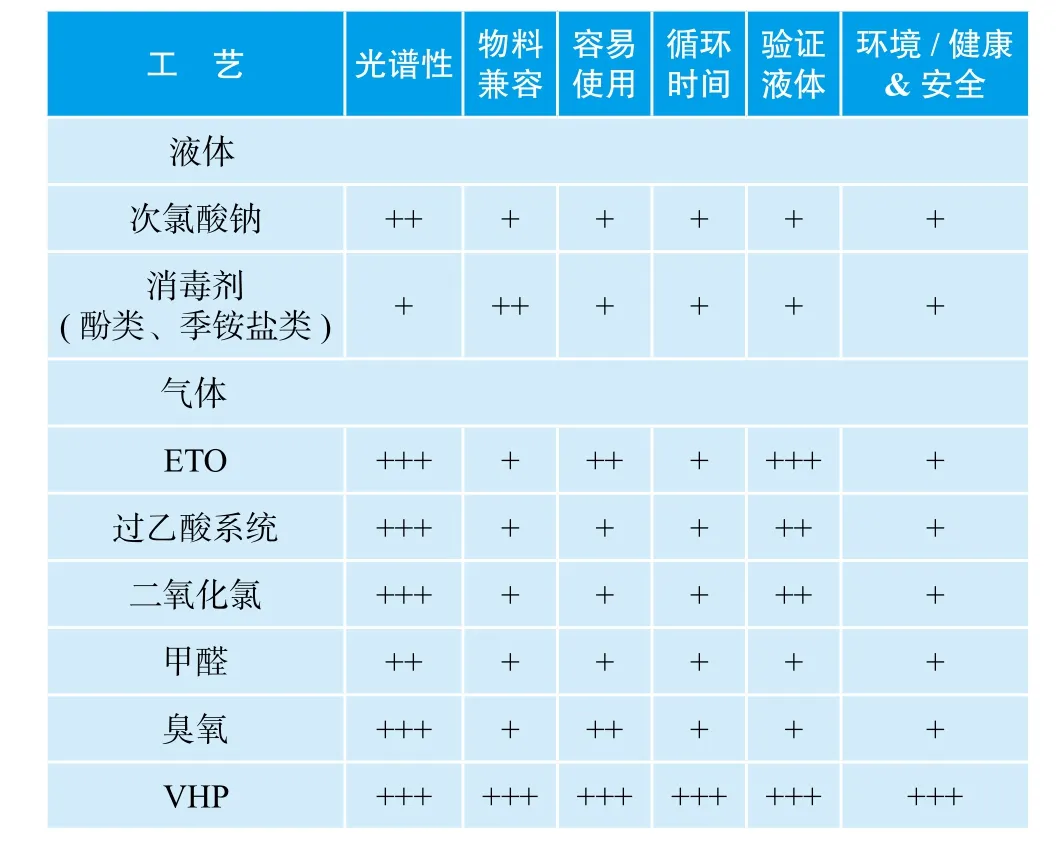
表 VHP与其他传统冷灭菌技术比较表(其中“+”越多表示所具备的能力越强)
VHP较其他冷灭菌方式具有下列优势: 生物净化时间更短,根据待处理产品的物理特性,生物灭菌时间 30-90 min(程序循环总时间);对更广范围的微生物有效 ;友好用户界面,工艺稳定,设备易于维护,生物灭菌循环中不产生有毒残留物;双门互锁,配有双密封圈,密封圈之间充有经过滤的洁净压缩空气; 自控 PC可控制所有的流程阶段,确保操作人员、产品和环境的安全;可提供欧盟及WHO认可的全套标准验证程序。
VHP灭菌过程
如图所示,VHP系统的灭菌过程主要分为4个阶段:
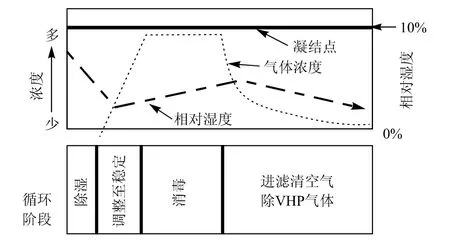
VHP灭菌过程示意图
(1)除湿处理:主要降低相对湿度,真空泵对灭菌腔体抽真空,抽到腔体内气压下降到约133 Pa 时停止,灭菌腔体内水分大部分蒸发并通过真空泵抽出,相对湿度控制在10% ~ 30%,也可进行反复脉动真空,向腔体内注入已加热的低露点压缩空气以进一步降低相对湿度。
(2)进汽稳定阶段,干燥空气携带汽化的过氧化氢通过高效过滤器以一定的速率注入腔体内, 过氧化氢经过一定时间的扩散,浓度逐渐稳定在预期值时进入消毒灭菌阶段。
(3)灭菌消毒阶段,以某一恒定的进汽速率维持室内过氧化氢浓度, 达到规定灭菌消毒时间后停止注入汽化过氧化氢,通过计算 D值并保证净化腔中6log的杀灭率。
(4)汽化过氧化氢的清除,灭菌结束后,经高效过滤器向腔体内充入无菌干燥、空气,当腔体内压力和大气压一致时,停止进气,真空泵将腔体内混合空气抽出,新风与排风均经 HEPA过滤,防止任何再污染(包括停电期间),残留的过氧化氢气体在催化器作用下被转化成对环境无害的氧气和水,只有当腔体内 VHP浓度低于 1ppm时,才能打开无菌端的门,一个灭菌过程结束。
VHP 的验证
汽化过氧化氢(VHP)低温灭菌系统在欧盟及WHO的药品生产及生物安全实验室中被广泛采用,有比较简单而有效且被认证专家普遍认可的灭菌验证方法。灭菌效果的验证方法和湿热灭菌器的验证基本一致,基本采用由STERIS 公司提供的NB305化学指示卡和NA330 生物指示剂,化学指示卡主要监测过氧化氢浓度, 生物指示剂为嗜热脂肪芽孢杆菌片,主要验证灭菌效果。验证方法如下,将化学指示卡和生物指示剂分别放置在待灭菌物品包中央,灭菌结束后,先将化学指示卡取出,观察化学指示卡颜色,由蓝色变为米黄色即为合格,表示过氧化氢浓度达到要求;再将生物指示剂取出,将嗜热脂肪芽孢杆菌菌片接种到符合要求的培养基内, 于55~60 ℃恒温培养箱中培养7 d后观察结果, 培养基保持紫色不变视为无菌生长, 且阳性对照培养基变为黄色或混浊表示有菌生长, 视为灭菌合格。
结论
VHP灭菌系统是新版GMP认证专家最没有争议,最为认可的一种冷灭菌方式,随着新版GMP的颁布执行,汽化过氧化氢(VHP)低温灭菌系统将在GMP生物制品的无菌转运过程中发挥重要作用,将广泛应用于生物制品制药行业各个领域,它将开创中国低温消毒灭菌的新市场,在今后几年内,一定会迅速成为制药低温灭菌设备市场的主流产品。
[1] 2010版药品生产质量管理规范(送审稿)
[2] www.steris.com
