Bcl-2、Bax在百草枯诱导大鼠视网膜损伤中的表达
2011-02-27刘海楠李生莹杨宇平杨锦南
刘海楠,李生莹,杨宇平,杨锦南
(新乡医学院药学院药理学教研室,河南新乡 453003)
百草枯(paraquat,PQ)又名对草快、克芜踪,化学名是1,1'-二甲基-4,4'-联吡啶二氯化物,是目前使用较广泛的除草剂之一,其中毒事件屡有发生,口服致死率高达60%~80%。PQ中毒常可导致肺、心、肝、肾等多脏器损害,也有报道显示眼睛被污染后会引起严重结膜炎或永久性角膜混浊[1],可致人视力严重下降。此外,国外有研究[2]表明玻璃体腔内注射一定剂量的百草枯可诱导小鼠视网膜损伤,国内尚未见百草枯对视网膜损伤的报道。因此,本实验通过观察Bcl-2和Bax在百草枯诱导大鼠视网膜损伤中的表达,探讨百草枯损伤视网膜的机制。
1 材料与方法
1.1 实验动物和主要试剂① 动物:健康无眼疾成年SD大鼠30只,体质量180~200 g,♀♂各半,由河南省实验动物中心提供,动物合格证号:SCXK(豫)2005-0001;② 主要药品与试剂:百草枯(No 50920)购于 Sigma公司,临用前用 0.1 mol·L-1PBS配制成所需浓度;TUNEL凋亡试剂盒(No 11684817910)购于德国 Roche Applied Science公司;蛋白酶 K(No 11175529)购于德国 Roche Applied Science公司;DAB显色试剂盒(No K96712H)购于北京中杉公司;β-actin、Bax、Bcl-2小鼠抗大鼠单克隆抗体(sc-47778、sc-7480、sc-7382)购于美国Santa Cruz公司;③ 主要仪器设备:Anke.TGL-16GA低温离心机购于上海安亭科学仪器厂;电泳仪购于美国Bio-rad公司;DYCZ-40B型转膜仪购于北京六一厂。
1.2 分组与造模30只SD大鼠随机分为5组,每组6只,分别为正常对照组、不同时间点(12 h、1 d、2 d、5 d)PQ组。正常对照组大鼠玻璃体腔内注射0.1 mol·L-1PBS溶液,PQ组双眼玻璃体腔内各注射 4 mmol·L-1的百草枯溶液 2 μl,分别在给药后12 h、1 d、2 d、5 d 处死动物,摘除双侧眼球。左眼置于混合固定液中固定,右眼摘除后立即分离视网膜,分别提取各组样本视网膜总蛋白[3]。
1.3 HE染色摘除左眼后,立即放入混合固定液[4]中固定3 h,之后放入体积分数为0.10的中性甲醛固定过夜,开窗,常规乙醇脱水,二甲苯透明,石蜡包埋,纵向视网膜切片,厚5 μm,常规HE染色,中性树胶封片,光镜下观察病理形态的改变。
1.4 TUNEL法检测细胞凋亡按照凋亡试剂盒说明书要求进行操作,阴性对照不加TDT酶,苏木精复染,中性树胶封片,在显微镜(×400)下观察,正常细胞核为蓝色,凋亡阳性细胞核为棕黄色。400倍镜下自视盘旁开始向锯齿缘方向连续取4个视野,记录每个视野中TUNEL阳性细胞核数和视网膜细胞总数,计算凋亡指数(apoptotic index,AI)。即AI/%=凋亡细胞数/细胞总数×100%。
1.5 Western blot检测大鼠视网膜中 Bcl-2,Bax的表达提取视网膜总蛋白:剥离视网膜于匀浆器中,加入蛋白裂解液冰上匀浆裂解,低温离心后取上清。Bradford法测定蛋白浓度。加Loading buffer水浴煮沸5 min进行蛋白变性,SDS-PAGE电泳分离,电转印至PVDF膜上,5%脱脂奶粉封闭1 h,封闭结束后将PVDF膜与适当浓度的一抗4℃孵育过夜,TBST洗膜3次,常温二抗孵育1 h,TBST洗膜3次,ECL试剂盒检测,显影定影水洗晾干。将晾干的X光片扫描后用Quantity One分析软件进行光密度值分析,以目的条带与内参β-actin的比值作为半定量依据。
1.6 统计学处理实验数据均以±s表示,采用SPSS 17.0统计学软件对数据进行统计学处理,各组数据的差异用one-way ANOVA法,每两组之间的比较用Scheffe法。
2 结果
2.1 视网膜HE染色正常对照组视网膜细胞各层排列整齐,细胞形态正常;12 h PQ组外核层细胞核排列出现轻微紊乱,其它各层细胞排列正常;1 d PQ组可在内核层、外核层观察到少量核固缩,外核层表现出疏松紊乱;2 d PQ组内核层观察到大量核固缩,内核层被严重破坏,外核层明显紊乱,神经节细胞开始出现核固缩;5 d PQ组视网膜细胞被严重破坏,内外核层稀疏严重紊乱,几乎看不到神经节细胞(Fig 1)。
2.2 TUNEL法检测结果正常对照组大鼠视网膜各层中均未检测到凋亡阳性细胞;12 h PQ组在外核层可观察到少量的阳性细胞;1 d PQ组内核层开始出现大量的阳性凋亡细胞,外核层和其他层可见少量阳性细胞,2 d PQ组凋亡细胞指数达到高峰;5 d时阳性细胞与1 d、2 d时相比有所减少(Fig 2)。
2.3 Western blot结果玻璃体腔注射百草枯后12 h时,Bcl-2蛋白表达表现出升高趋势,Bcl-2在1 d时表达水平最高,与正常对照组相比(P<0.01),2 d时开始下降,5 d时基本恢复正常水平;Bax在12 h时蛋白表达明显比正常组高(P<0.01),在2 d时达到最高水平,5 d时表达开始减少,PQ模型组与正常对照组相比均较高(P<0.01);Bcl-2/Bax在12 h时比正常对照组降低(P<0.01),2 d时比值最低,到5 d时比值开始升高(Fig 3,Tab 2)。
3 讨论
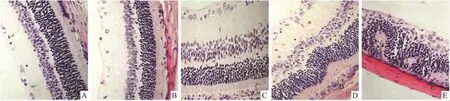
Fig 1 HE staining(×400) A:Normal control;B:12 h after PQ intravitreal injection;C:1 d after PQ intravitreal injection;D:2 d after PQ intravitreal injection;E:5 d after PQ intravitreal injection
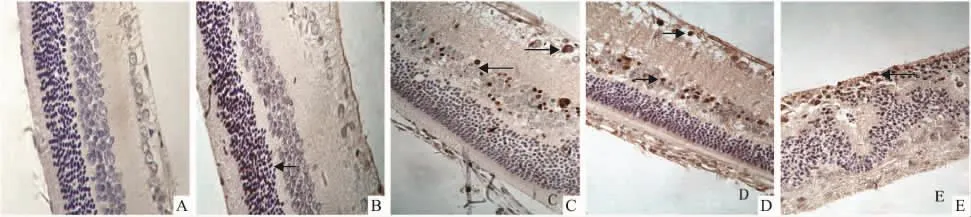
Fig 2 Detection of apoptosis in retinal cells by TUNEL(×400)
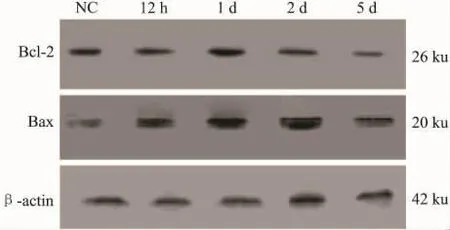
Fig 3 The effect on expression of Bcl-2 and Bax proteins after PQ intravitreal injection by Western blot
Tab 1 The apoptotic rate of cells in PQ models(%,±s,n=6)
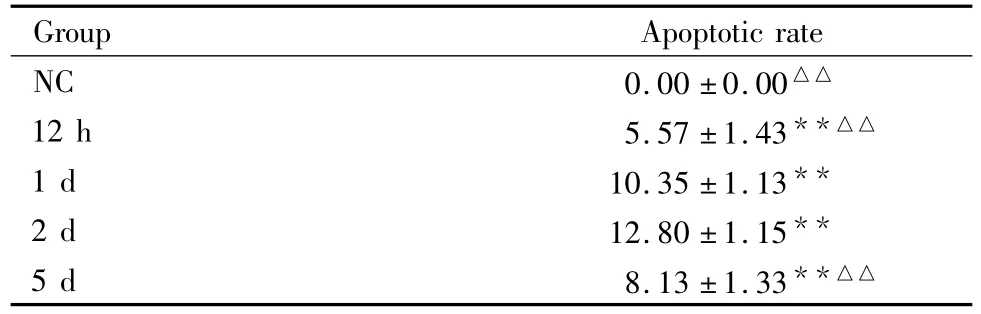
Tab 1 The apoptotic rate of cells in PQ models(%,±s,n=6)
**P <0.01 vs NC,△△P <0.01 vs 2 d
Group Apoptotic rate NC 0.00 ±0.00△△12 h 5.57 ±1.43**△△1 d 10.35 ±1.13**2 d 12.80 ±1.15**5 d 8.13 ±1.33**△△
Tab 2 The effect on expression of Bcl-2 and Bax proteins after PQ intravitreal injection by Western blot(±s)
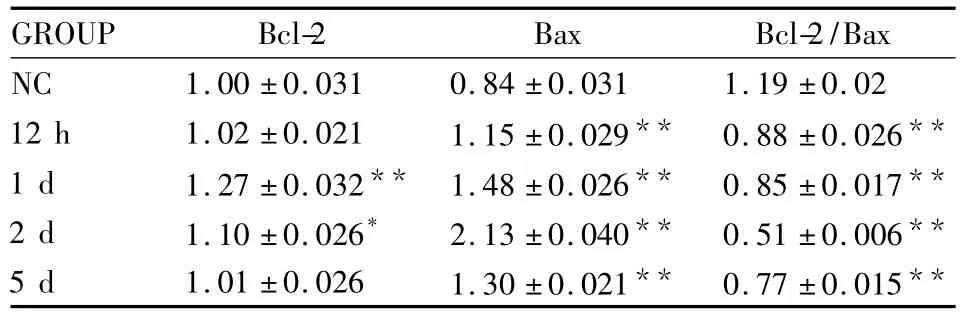
Tab 2 The effect on expression of Bcl-2 and Bax proteins after PQ intravitreal injection by Western blot(±s)
*P <0.05,**P <0.01 vs NC
GROUP Bcl-2 Bax Bcl-2/Bax NC 1.00 ±0.031 0.84 ±0.031 1.19 ±0.02 12 h 1.02 ±0.021 1.15 ±0.029** 0.88 ±0.026**1 d 1.27 ±0.032** 1.48 ±0.026** 0.85 ±0.017**2 d 1.10 ±0.026* 2.13 ±0.040** 0.51 ±0.006**5 d 1.01 ±0.026 1.30 ±0.021** 0.77 ±0.015**
百草枯(paraquat,PQ)是一种非选择性除草剂,可诱导氧化应激反应。有报道[5]某些神经系统变性性疾病与长时间低剂量暴露于PQ密切相关。由于百草枯对氧化应激反应的诱导,可使体外的色素上皮细胞、神经节细胞发生凋亡[2,6]。
细胞凋亡是许多眼部疾病的共同特征,如视网膜色素变性、视网膜剥离、青光眼等。其中Bcl-2家族基因在细胞凋亡过程中起到重要的作用,Bcl-2是一原癌基因,通过编码蛋白Bcl-2发挥抑制细胞凋亡的功能。Bax是Bcl-2家族蛋白中的一员,发挥促进凋亡的作用。Bcl-2和Bax通过自身组成同二聚体和彼此之间组成异二聚体的不同比例介导其对细胞存活的生物学效应,通过调控线粒体外膜通透性,控制体内凋亡因子和细胞色素C等的释放从而调控细胞是否存活。
有研究表明[7],光感受器细胞的凋亡可以诱发Bcl-2的下调和Bax的上调。本实验中发现,在对照组中Bcl-2和Bax的表达处于相对平衡的状态,模型组12 h时Bax开始升高,Bcl-2也开始升高,Bcl-2自身可形成同二聚体,也可与Bax形成异二聚体发挥抗凋亡作用,Bax可自身形成同源二聚体发挥促进凋亡的作用[8-9],Bcl-2/Bax 值的降低,可能使细胞开始向着凋亡的方向发展,与观察到Fig 1B外核层排列开始紊乱,Fig 2B外核层有少量的凋亡细胞检出相符。1 d时Bcl-2继续升高并达到高峰,在该时间点Bcl-2可能通过阻止或降解细胞皱缩、染色质浓缩和DNA裂解的发生来抵抗视网膜细胞的凋亡,过度表达后可抑制钙超载、氧自由基、兴奋性氨基酸等诱发的神经节细胞凋亡[10],Bax表达量在该时间点也达到一定的高度,Bcl-2/Bax比值呈现下降趋势,同时TUNEL观察该时间的凋亡细胞表达升高,Bax的高表达对于该时期的细胞凋亡有着重要的意义。Bax在2 d时达到高峰,而Bcl-2表达量开始降低,Bcl-2/Bax在2 d时达到最低,2 d组的凋亡指数在该时期达到高峰,这可能是由于Bax表达特别高,使形成的Bax同二聚体较多,促使了2 d时的视网膜细胞大量的凋亡,也有可能是Bcl-2家族的其他分子和一些抗凋亡因子、诱导因子的综合调节形成的结果,随着Bax表达量在5 d时减少,我们看到TUNEL检出的阳性细胞数也减少。
综上所述,TUNEL凋亡的阳性表达和Bcl-2、Bax的表达是密切相关的。表明了百草枯诱导的视网膜损伤中Bcl-2、Bax两种蛋白起到了重要的作用,同时Bcl-2/Bax在一定程度上可以反映凋亡的趋势,为以后视网膜色素变性的临床治疗研究提供了基础。百草枯诱导视网膜损伤更详细的机制,需要我们进行更深入的研究。
[1] 张文孝,王 芳,严成明.百草枯中毒抢救体会[J].现代医药卫生,2005,21(18):2472.
[1] Zhang W X,Wang F,Yan C M.Rescue experience of paraquat poisoning[J].Mod Med Health,2005,21(18):2472.
[2] Cingolani C,Rogers B,Lu L,et al.Retinal degeneration from oxidative damage[J].Free Radic Biol Med,2006,40(4):660 -9.
[3] 高 杨,邓新国,孙倩娜,等.灵芝孢子油对N-甲基-N-亚硝酸脲诱导的大鼠视网膜损伤中Caspase-3表达的影响[J].中国药理学通报,2009,25(7):871 -5.
[3] Gao Y,Deng X G,Sun Q N,et al.Effect of ganoderma spore oil on caspase-3 expression in rat retina with photoreceptor damage induced by N-methyl-N-nitrosourea[J].Chin Pharmacol Bull,2009,25(7):871-5.
[4] 陈金卯,胡世兴,邓新国,等.Caspase-3在MNU诱导的视网膜变性大鼠中的作用[J].眼科研究,2005,23(3):238 -40.
[4] Chen J M,Hu S X,Deng X G,et al.Role of Caspase-3 in MNU-induced retinal degeneration[J].Chin Ophthal Res,2005,23(3):238-40.
[5] Landrigan P J,Sonawane B,Butler R N,et al.Early environmental origins of neurodegenerative disease in later life[J].Environ Health Perspect,2005,113(9):1230 -3.
[6] Schlieve C R,Lieven C J,Levin L A.Biochemical activity of reactive oxygen species scavengers do not predict retinal ganglion cell survival[J].Invest Ophthalmol Vis Sci,2006,47(9):3878 - 86.
[7] Yoshizawa K,Nambu H,Yang J,et al.Mechanisms of photoreceptor cell apoptosis induced by N-methyl-N-nitrosourea in Sp-rague-Dawley rats[J].Lab Invest,1999,79(11):1359 -67.
[8] Bazan N G,Marcheselli V L,Cole-Edwards K.Brain response to injury and neurodegeneration:endogenous neuroprotectire signaling[J].Ann N Y Acad Sci,2005,1053:137 -47.
[9] 肖 迎,张效房,金学民,等.GM-1对大鼠视网膜缺血/再灌注损伤的保护作用[J].眼外伤职业眼病杂志,2007,29(6):401-5.
[9] Xiao Y,Zhang X F,Jin X M,et al.Protection of GM-1on rat retinal ischemia-reperfusion injury[J].Chin J Ocul Trauma Occup Eye Dis(With Ophthalmic Surgery),2007,29(6):401 -5.
[10] Zhang Y,Cho C H,Atchaneeyasakul L O,et al.Activation of the mitochondrial apoptotic pathway in a rat model of central retinal artery occlusion[J].Invest Ophthalmol Vis Sic,2005,46(6):2133.
